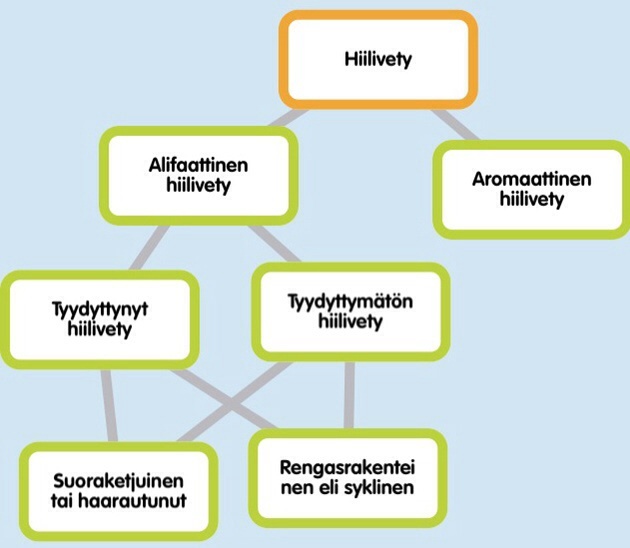
H2 Hiilivedyt ja aromaattiset yhdisteet
Alifaattiset hiilivedyt
Alifaattisiin hiilivetyihin kuuluvat ne hiilivedyt, jotka eivät sisällä bentseenirengasta. Ne voivat sisältää yksinkertaisia sidoksia sekä kaksois- ja kolmoissidoksia. Niiden hiiliketju voi olla suora, haaroittunut tai muodostaa renkaan. Alifaattiset hiilivedyt voidaan luokitella niissä esiintyvien hiili-hiilisidosten mukaan alkaaneihin, alkeeneihin ja alkyyneihin.
Alkaanit
Metaanin jälkeen kokojärjestyksessä seuraavat alkaanit ovat etaani (C2H6), propaani (C3H8), butaani (C4H10) ja pentaani (C5H12). Kun alkaaniin liitetään yksi hiiliatomi lisää, huomataan vetyatomien määrän kasvavan kahdella. Alkaanien sanotaan muodostavan homologisen sarjan, jossa peräkkäisten alkaanien hiiliketju kasvaa CH2-ryhmällä.
https://peda.net/id/ccf78efc4
Hiilivetyjen rakennetta voidaan kuvata monella eri tavalla. Erityisesti suuret molekyylit piirretään usein viivakaavoina (oikealla).
Metaani, etaani, propaani ja butaani. Harmaat atomit ovat hiiliatomeja ja valkoiset vetyatomeja.
Kaikissa alkaaneissa hiiliketju ei ole suora, vaan se voi myös haaroittua. Esimerkiksi butaanissa (C4H10) ja 2-metyylipropaanissa (C4H10) on sama määrä hiili- ja vetyatomeja. Kahdella yhdisteellä voi siis olla sama molekyylikaava, mutta erilainen rakenne. Tätä kutsutaan hiilivetyjen isomeriaksi. Esimerkiksi butaani ja 2-metyylipropaani ovat erilaisia yhdisteitä, sillä rakenteen lisäksi niiden fysikaaliset ja kemialliset ominaisuudet poikkeavat toisistaan.
https://peda.net/id/ccf668384
Butaanilla ja 2-metyylipropaanilla on sama rakennekaava, mutta erilainen rakenne.
Hiiliatomit voivat liittyä toisiinsa myös siten, että hiiliketju muodostaa renkaan. Tällaisia rengasmaisia hiilivetyjä kutsutaan syklisiksi hiilivedyiksi. Syklisiä hiilivetyjä ovat esimerkiksi syklopentaani (C5H10) ja sykloheksaani (C6H12). Sykliset hiilivedyt on erotettava aromaattisista yhdisteistä, jotka sisältävät rengasmaisen bentseenirenkaan.
Sykloheksaanissa hiiliketju muodostaa renkaan.
Tyydyttymättömät hiilivedyt
Alkeenit ovat hiilivetyjä, joissa on ainakin yksi hiiliatomien välinen kaksoissidos eli ne ovat tyydyttymättömiä hiiliyhdisteitä. Pienin alkeeni on kaksi hiiliatomia sisältävä eteeni (C2H4). Alkeenien nimi päättyy päätteeseen –eeni.
https://peda.net/id/ccf48a364
Alkeeneilla on vähintään yksi kaksoissidos. Kuvassa eteeni ja propeeni.
Alkyynit ovat myös tyydyttymättömiä hiilivetyjä, mutta kaksoissidoksen sijaan ne sisältävät ainakin yhden kolmoissidoksen. Pienin alkyyni on hitsauskaasuna käytettävä etyyni eli asetyleeni (C2H2). Alkyynien nimi päättyy päätteeseen –yyni.
https://peda.net/id/ccf518984Alkyyneillä on rakenteessaan kolmoissidos. Kuvassa etyyni ja propyyni.
Aromaattiset yhdisteet
Yksinkertaisin aromaattinen hiilivety on bentseeni (C6H6), joka koostuu pelkästä bentseenirenkaasta. Bentseeni on kirkas, helposti syttyvä neste sekä tunnettu syövälle altistava aine eli karsinogeeni. Bentseenirengas on myös aromaattisten hiilivetyjen funktionaalinen ryhmä. Siihen tutustutaan tarkemmin kemian 2. kurssilla.
Näin bentseenirenkaan delokalisoituminen visualisoitiin vuonna 1865.
https://peda.net/id/cd092ce84
Nykyään se voidaan piirtää myös näin.
Tai näin.
Tietokoneavusteisen molekyylimallinnuksen avulla delokalisaatiomalli voidaan visualisoida myös näin. Kuvassa bentseenimolekyylin ympärille on visualisoitu elektronitiheyskartta. Punainen alue on elektronirikas ja sininen elektroniköyhä.
Hiilivetyjen ominaisuuksia
Hiilivetyjen nimeäminen
| hiiliketjun pituus | perusosan nimi |
| 1 | met- |
| 2 | et- |
| 3 | prop- |
| 4 | but- |
| 5 | pent- |
| 6 | heks- |
| 7 | hept- |
| 8 | okt- |
| 9 | non- |
| 10 | dek- |
Suoraketjuiset, vain yksinkertaisia sidoksia sisältävät hiilivedyt saavat päätteen -aani. Esimerkiksi pentaani.
Tyydyttymättömillä hiilivedyillä pääte on –eeni (kaksoissidos) tai –yyni (kolmoissidos). Lisäksi kaksois- tai kolmoissidoksen paikka ilmoitetaan mahdollisimman pienellä numerolla. Esimerkiksi 2-penteeni.
Hiiliketjussa voi olla myös erilaisia sivuryhmiä ja haaroja. Sivuryhmien pääte on yleensä –yyli.
| sivuryhmä | nimi |
| -CH3 | metyyli |
| -CH2CH3 | etyyli |
| -CH2CH2CH3 | propyyli |
Esimerkiksi 2-metyylibutaani.
Jos hiiliketju muodostaa renkaan, saa nimi etuliitteen syklo–. Esimerkiksi sykloheksaani.
Hiilivetyjä ympäristössä
Hiilivetyjen palaminen tuottaa runsaasti energiaa. Palamisreaktiossa muodostuu hiilidioksidia ja vettä.
Alkeeneista eteeniä voi löytää kaikkialta, missä on kasvillisuutta. Se on kasvien tuottama yhdiste, joka esimerkiksi edistää hedelmien kypsymistä ja kukkien lakastumista. Lisäksi sitä käytetään esimerkiksi muovien valmistamisessa (polyeteeni).
Lisäksi: Tieteelliset tapaamiset ovat tärkeä osa kemian tutkimusta
Vuonna 1859 kemistien keskuudessa vallitsi erimielisyyksiä hyvin keskeisistä kemian käsitteistä, kuten
- mikä on atomi?
- mikä on molekyyli?
Erimielisyydet haittasivat tutkimustyötä, joten Kekulé päätti kutsua koolle kongressin, eli järjestää tieteellisen tapaamisen, jossa kemistit istuisivat saman pöydän ääreen ja sopisivat yhtenäiset määritelmät keskeisille kemian käsitteille.
Kekulén organisoima ensimmäinen kansainvälinen kemian kongressi järjestettiin Saksassa Karlsruhen teknisen korkeakoulun tiloissa vuonna 1860. Kongressi oli menestys ja keskeisistä käsitteistä saatiin muodostettua yhteisymmärrys kemistien kesken.
Sanotaan jopa, että Karlsruhen kongressi johti IUPAC kemian liiton perustamiseen. IUPAC, International Union of Pure and Applied Chemistry, on kansainvälinen kemistien liitto, jonka tavoitteena on standardisoida kemian sanastoa ja mittausmenetelmiä yhteisen kielen ja korkeampilaatuisen tieteen vuoksi.
Tämän tyyppinen tapaaminen oli vuonna 1860 ainutlaatuinen kemiassa. Nykyään vastaavanlaisia konferensseja järjestetään hyvin paljon ja jokapuolella maailmaa. Konferensseissa tieteentekijät verkostoituvat, esittelevät tutkimustaan tapaavat ystäviä ja näkevät maailmaa. Tieteessä matkailu todellakin avartaa, vaikka aina ei tarvitse matkustaa. Nykyään konferensseihin voi osallistua myös verkon välityksellä.
Posteriesitykset ovat olennainen osa tieteellistä konferenssia. Posteri on suuri juliste (esim. koko A0), jolla tutkijat esittelevät tutkimustaan nopeasti omaksuttavassa muodossa. Ideana on esittää omasta tutkimuksesta lyhyt tiivistelmä sekä muutama tutkimusta esittelevä kuva. Tiivistäminen on tärkeää, sillä posteriesityksissä voi olla jopa satoja postereita katsottavana.
Lopuksi
Täydennä vedyt seuraaviin hiilirunkoihin. Mikä on valmiin molekyylin rakennekaava? Etsi myös nimi valmiille molekyylille.
https://peda.net/id/cd43b5fc4
H2.2
Täytä taulukko (alkaanit).
| Hiiliatomien määrä | Nimi | Rakennekaava |
| 1 | metaani | CH4 |
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 | ||
| 7 | ||
| 8 | ||
| 9 | ||
| 10 |
H2.3 (verkkotehtävä)
Ajoneuvojen polttoaineissa ilmaistaan usein ns. oktaaniluku. Esimerkiksi Suomessa myydään 95- ja 98-oktaanista bensiiniä. Selvitä internetin avulla
a) Mitä oktaaniluvulla tarkoitetaan? Mitä se kuvaa?
b) Miten oktaaniluku liittyy oktaaniin (hiilivety)?
c) Miten polttoaineiden oktaanilukua voidaan nostaa?
H2.4 (verkkotehtävä)
Tehtävän tarkoituksena on selvittää hiilivedyn rakenteita, ominaisuuksia ja käyttötarkoituksia. Heittäkää parinne kanssa noppaa. Jos saat silmäluvun 1 tai 2, yhdisteesi on alkaani. Vastaavasti silmäluvuilla 3 tai 4 yhdiste on alkeeni ja silmäluvuilla 5 ja 6 yhdiste on alkyyni. Heittäkää noppaa myös toisen kerran. Tällä kertaa nopan silmäluku kertoo hiiliatomien lukumäärän.
Esimerkiksi: Ensimmäisellä heitolla heitettiin 5 ja toisella 4. Tutkitte siis butyynin rakennetta ja käyttötarkoituksia.
Pyrkikää selvittämään yhdisteenne:a) Rakennekaava
b) Moolimassa
c) Sulamispiste
d) Kiehumispiste
e) Käyttötarkoituksia
f) Käyttöturvallisuuteen liittyvät seikat mahdollisuuksien mukaan
Voit etsiä tietoa esimerkiksi hakukoneista tai internet-tietosanakirjoista.
Tietoa kemikaalien ominaisuuksista: http://www.chemspider.com/ (englanniksi)
H2.5 (verkkotehtävä)
Friedrich August Kekulé von Stradonitz eli vuosina 1829-1896. Hän oli yksi 1800-luvun merkittävimpiä kemistejä. Kekulén tunnetuin oivallus oli bentseenin rengasrakenne, joka auttoi kemistejä ymmärtämään hiiliyhdisteiden kemiaa aivan uudella tavalla.
Kekulé menestyi myös kemian opettajana. Viidestä ensimmäisestä kemian Nobel-palkinnosta kolme myönnettiin hänen opiskelijoilleen.
Selvitä verkosta tai muista lähteistä
a) mitä muita kemian oivalluksia Kekulé teki uransa aikana.
b) ketkä olivat ne kolme Kekulén opiskelijaa, joille kemian Nobelit myönnettiin. Mistä tutkimuksista kyseiset palkinnot annettiin?
H2.6 (verkkotehtävä)
Bentseenin johdannaiset ovat hiilivetyjä, joissa bentseenin vetyatomeja on korvattu muilla atomeilla tai atomiryhmillä. Etsi verkosta tällaisia yhdisteitä ja
- mallinna löytämiesi yhdisteiden molekyylimallit
- piirrä rakennekaavat
- selvitä yhdisteiden käyttökohteita.
H2.7 Mallinna ja visualisoi
Valitse 10 luvussa tai tehtävissä käsiteltyä yhdistettä. Rakenna ne Edumolilla. Aseta molekyylit edustavaan asentoon ja tallenna työ kuvana. Lisää kuvat aloittamaasi orgaanisten yhdisteiden molekyyligalleriaan. Kirjoita oppimista tukevat kuvatekstit.
Malliratkaisut