Ainemäärä
Kemiallisissa reaktioissa on oleellisempaa pystyä vertaamaan hiukkasten lukumääriä kuin esimerkiksi massoja. Reaktioyhtälöt ovat aina tasapainossa hiukkasten lukumäärien suhteen.
[[$ 2H_2\left(g\right)+O_2\left(g\right)\rightarrow2H_2O\left(g\right) $]],
Reaktioyhtälö kuvaa vetykaasun ja happikaasun reaktiota, se kertoo reagoivien aineiden lukumäärällisistä suhteista: vetyä tarvitaan kaksi kertaa niin paljon kuin happea. Tämä ei tarkoita sitä että reaktio onnistuisi niin, että vetyä on 2g ja happea 1g. Massoissa suhde on itse asiassa sellainen, että vettä tarvitaan 2g ja happea 16g! Yksittäisen happiatomin massa on nimittäin noin 16-kertainen vetyyn nähden.
Yhtälön mukaan reaktiossa kuluisi
Yhdessä grammassa ainetta on käsittämätön määrä hiukkasia, joten varsinaisesti lukumäärillä ei kemiassa lasketa. Käyttöön on otettu suure ainemäärä suuretunnus n, yksikkö mooli= mol). Osalle tämä voi olla tuttu fysiikan kurssilta Fy2, missä näitä on käytetty kaasujen tilanyhtälössa.
Edellisessä reaktiossa siis kuluisi
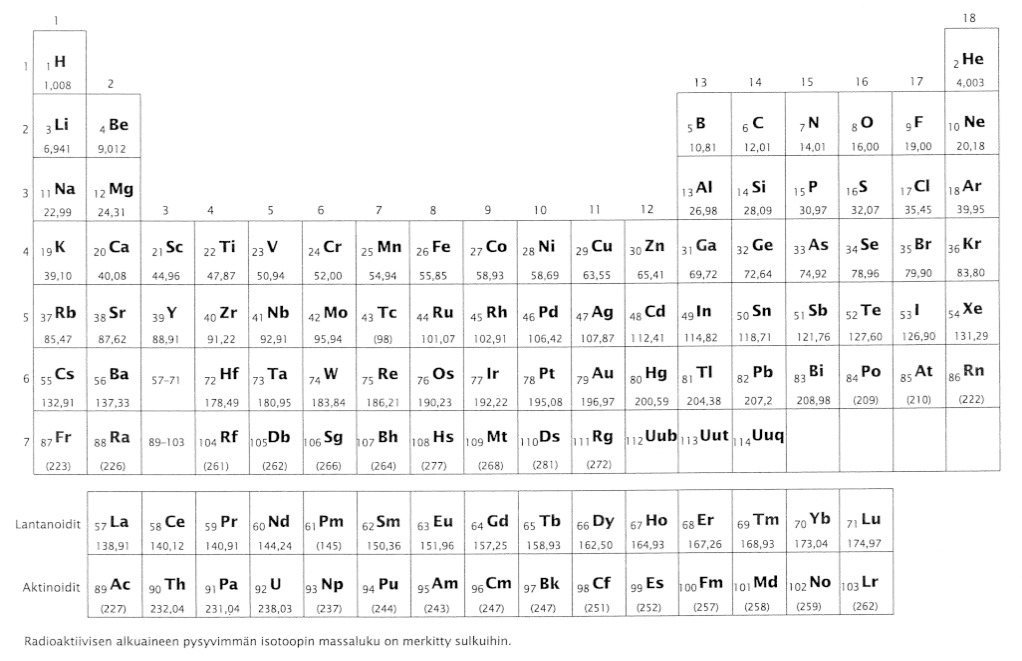
Taulukkokirjassa on luetteloituna jokaiselle alkuaineelle tieto siitä, paljonko keskimäärin painaa 1 mol kyseistä ainetta. (periaatteessahan tähän vaikuttaa isotoopitkin, siksi luvut ovat keskiarvoja aineen eri isotooppien atomimassoista) Nämä ovat niin sanottuja suhteellisia atomimassoja, joista yleensä käytetään nimitystä moolimassa (suuretunnus M ja yksikkö g/mol)
Esimerkiksi
[[$ \mathrm{M\left(H\right)}=1{,}008\ \frac{g}{mol} $]]
[[$ \mathrm{M\left(Au\right)}=196{,}97\ \frac{g}{mol} $]]
Huomaa, miten suuretunnuksen yhteyteen sulkeisiin aina merkitään se aine, josta on kyse.
Yhdisteille voidaan laskea moolimassat laskemalla yhteen niissä esiintyvien atomien moolimassat:
[[$ M\left(H_2O\right)=2\cdot M\left(H\right)+M\left(O\right)=\left(2\cdot1{,}008\ +\ 16{,}00\right)\ \frac{g}{mol}=18{,}016\ \frac{g}{mol} $]]
Moolimassa kertoo, että jos vettä olisi 18,016 g, niin sitä olisi tasan 1 mol
Kun käytetään suuretunnuksia, voitaisiin merkitä sama asia seuraavasti:
[[$ m\left(H_2O\right)=18{,}016\ g\ \Rightarrow\ n\left(H_2O\right)=1{,}00\ mol $]]
Ainemäärän, massan ja moolimassan välinen suureyhtälö on [[$ n=\frac{m}{M} $]]. Jos kaksi näistä tunnetaan, kolmas on aina laskettavissa.
OpetusTV:stä löytyy aiheeseen liittyviä opetusvideoita, jos tuntuu tarpeelliselta: linkki
Seuraavassa on kolmenlaisia harjoituksia:
1. Moolimassan laskeminen eri yhdisteille
2. Ainemäärän laskeminen, jos tiedetään näytteen massa
3. Massan laskeminen, jos tiedetään näytteen ainemäärä
Tee tehtävät ja palauta palautuskansioon.
[[$ 2H_2\left(g\right)+O_2\left(g\right)\rightarrow2H_2O\left(g\right) $]],
Reaktioyhtälö kuvaa vetykaasun ja happikaasun reaktiota, se kertoo reagoivien aineiden lukumäärällisistä suhteista: vetyä tarvitaan kaksi kertaa niin paljon kuin happea. Tämä ei tarkoita sitä että reaktio onnistuisi niin, että vetyä on 2g ja happea 1g. Massoissa suhde on itse asiassa sellainen, että vettä tarvitaan 2g ja happea 16g! Yksittäisen happiatomin massa on nimittäin noin 16-kertainen vetyyn nähden.
Yhtälön mukaan reaktiossa kuluisi
- 2kpl vetymolekyylejä + 1 kpl happimolekyylejä, jolloin syntyy 2 kpl vesimolekyylejä
- 500 kpl vetymolekyylejä + 250 kpl happimolekyylejä, jolloin syntyy 500 kpl vesimolekyylejä
Yhdessä grammassa ainetta on käsittämätön määrä hiukkasia, joten varsinaisesti lukumäärillä ei kemiassa lasketa. Käyttöön on otettu suure ainemäärä suuretunnus n, yksikkö mooli= mol). Osalle tämä voi olla tuttu fysiikan kurssilta Fy2, missä näitä on käytetty kaasujen tilanyhtälössa.
Edellisessä reaktiossa siis kuluisi
- 2,0 mol vetymolekyylejä + 1,0 mol happimolekyylejä, jolloin syntyy 2,0 mol vettä
- 0,64 mol vetymolekyylejä + 0,32 mol happimolekyylejä, jolloin syntyy 0,64 mol vettä
Taulukkokirjassa on luetteloituna jokaiselle alkuaineelle tieto siitä, paljonko keskimäärin painaa 1 mol kyseistä ainetta. (periaatteessahan tähän vaikuttaa isotoopitkin, siksi luvut ovat keskiarvoja aineen eri isotooppien atomimassoista) Nämä ovat niin sanottuja suhteellisia atomimassoja, joista yleensä käytetään nimitystä moolimassa (suuretunnus M ja yksikkö g/mol)
Esimerkiksi
[[$ \mathrm{M\left(H\right)}=1{,}008\ \frac{g}{mol} $]]
[[$ \mathrm{M\left(Au\right)}=196{,}97\ \frac{g}{mol} $]]
Huomaa, miten suuretunnuksen yhteyteen sulkeisiin aina merkitään se aine, josta on kyse.

Yhdisteille voidaan laskea moolimassat laskemalla yhteen niissä esiintyvien atomien moolimassat:
[[$ M\left(H_2O\right)=2\cdot M\left(H\right)+M\left(O\right)=\left(2\cdot1{,}008\ +\ 16{,}00\right)\ \frac{g}{mol}=18{,}016\ \frac{g}{mol} $]]
Moolimassa kertoo, että jos vettä olisi 18,016 g, niin sitä olisi tasan 1 mol
Kun käytetään suuretunnuksia, voitaisiin merkitä sama asia seuraavasti:
[[$ m\left(H_2O\right)=18{,}016\ g\ \Rightarrow\ n\left(H_2O\right)=1{,}00\ mol $]]
Ainemäärän, massan ja moolimassan välinen suureyhtälö on [[$ n=\frac{m}{M} $]]. Jos kaksi näistä tunnetaan, kolmas on aina laskettavissa.
OpetusTV:stä löytyy aiheeseen liittyviä opetusvideoita, jos tuntuu tarpeelliselta: linkki
Seuraavassa on kolmenlaisia harjoituksia:
1. Moolimassan laskeminen eri yhdisteille
2. Ainemäärän laskeminen, jos tiedetään näytteen massa
3. Massan laskeminen, jos tiedetään näytteen ainemäärä
Tee tehtävät ja palauta palautuskansioon.