Tehdyt työt
Kidevesityön kuvia
Viikko 16. Kemiaa
Suunnitelma on seuraava:
tiistai 14.4. Kylläinen suolaliuos ja kiteiden kasvattaminen
perjantai 17.4. Ainemääräkäsite ja palautettavat tehtävät 1-3.
Palauta tehtävät palautettavien töiden kansioon, nimesi tulee niihin automaattisesti, mutta muista otsikoida tehtävän mukaisesti!
Kirjaudu teamsiin oppitunnin alussa, ja ilmoittaudu kertomalla kumpaa työtä alat nyt tehdä.
Jos tiistain kokeellinen työ vaatii sellaisia järjestelyjä, ettet voi sitä heti tehdä (esim ruokasuolan hankkimista, kananmunan kuoren pesemistä), niin voit vaihtaa oppituntien järjestystä. Oleellista on, että saatte kiteiden kasvattamisen käyntiin ja että ainemäärälaskut on harjoiteltu tällä viikolla.
tiistai 14.4. Kylläinen suolaliuos ja kiteiden kasvattaminen
perjantai 17.4. Ainemääräkäsite ja palautettavat tehtävät 1-3.
Palauta tehtävät palautettavien töiden kansioon, nimesi tulee niihin automaattisesti, mutta muista otsikoida tehtävän mukaisesti!
Kirjaudu teamsiin oppitunnin alussa, ja ilmoittaudu kertomalla kumpaa työtä alat nyt tehdä.
Jos tiistain kokeellinen työ vaatii sellaisia järjestelyjä, ettet voi sitä heti tehdä (esim ruokasuolan hankkimista, kananmunan kuoren pesemistä), niin voit vaihtaa oppituntien järjestystä. Oleellista on, että saatte kiteiden kasvattamisen käyntiin ja että ainemäärälaskut on harjoiteltu tällä viikolla.
Kemia: kylläinen liuos ja kananmunageodi
Valmistetaan kylläinen suolaliuos ja tutkitaan sen kiteytymistä.
Pohjatietoa:
Kylläinen suolaliuos on siis sellainen, mihin suolaa on liuotettu niin paljon, ettei suurempi määrä pysty liukenemaan. Liukoisuus vaihtelee eri suoloilla, se voi olla vaikka välillä 0,001mg-30000mg/100g vettä. Osa liukenemistapahtumista on endotermisiä (=suolaa liukenee enemmän lämpimään veteen), osa eksotermisia (=suolan liukeneminen vapauttaa lämpöenergiaa, ja sitä liukenisi enemmän kylmään veteen).
Kun liuos tulee ylikylläiseksi (esimerkiksi jos kylläisestä liuoksesta haihtuu vettä), niin suolaa alkaa kiteytyä. Olemme jo kokeilleet KE1 -kurssilla veden haihduttamista suolaliuoksesta. Silloin suolan kiteet jäivät haihdutusmaljan pohjalle melko rapautuneessa muodossa: valkoisina ja murenevina. Jos halutaan kauniita kidemuodostelmia, kiteytyksen on tapahduttava hitaasti. Ensimmäiset kiteet syntyvät helpoiten liuoksen/astian rajapintoihin: pieniin epäpuhtauksiin tai muihin "herätteisiin". Kokeilemme kahta kiteytystapaa: suolageodin valmistamista sekä yksittäisen suolakiteen kasvattamista. Koska joka kodista löytyy ruokasuolaa, käytämme sitä. Voit halutessasi etsiä jonkin toisenkin suolan, esim ruokasooda tai (pesuaineena myytävä) kidesooda ovat kohtalaisen yleisiä kodin suoloja (ja jonkun kotoa voi löytyä eksoottisempiakin suoloja)
Eri suoloilla on erimuotoisia kiteitä, ja ruokasuolalle (NaCl) tyypillinen kidemuoto on kuutiollinen. Samalla kun te valmistatte kotona ruokasuolakiteitä, minä laitan kemian luokassa kasvamaan kuparisulfaattikiteitä, joista pitäisi tulla vinoneliön muotoisia.
Tarvikkeet:
Tavoitteena on selvittää suolan liukoisuus /100g vettä (eli montako grammaa suolaa liukenee 1dl:aan vettä). Sekoita suolaa veteen niin paljon kuin siihen liukenee (eli kunnes sitä jää liukenematta astian pohjalle).Mieti, miten voit saada suolan punnittua, ja mahdollisimman tarkan tuloksen. Jos kotona ei ole pikkuvaakaa/keittiövaakaa, niin löytyisikö esimerkiksi puhelimelle punnitusapp? en tiedä. Jos tämä ei onnistu, niin sitten ei. Voit kuitenkin varautua siihen, että suolaa liukenee noin 30% veden painosta.
tämän videon alussa näkyy liuoksen valmistus.
2. Kananmunageodi
Yllä olevalla videolla on yksi ohje kananmunageodin valmistamiseksi (siinä munan sisäpintaan laitetaan liimaa ja herätekiteitä). Tässä blogissa on toinen ohje, jossa liimaa ei käytetä, sillä munan kuoren ilmataskut voivat vaikuttaa kidemuodostukseen. Voit toki vaikka kokeilla molempia ja verrata lopputuloksia. Voit halutessasi myös värjätä liemen esimerkiksi elintarvikevärillä tai vesiväreillä.
3. Jättisuolakide
Viritä purkki niin, että sen yläreunassa kulkee poikittain jokin tikku (tulitikku, lusikanvarsi, grillivartaan pätkä, voit kiinnittää vaikka sinitarralla). Tikusta pitäisi roikkua naru kylläiseen suolaliuokseen. Jos haluat aloittaa ihan nollasta, laita purkkiin roikkumaan pelkkä naru. Jos haluat nopeuttaa prosessia, etsi merisuolapurkista mahdollisimman suuri yksittäinen kide ja solmi se naruun (ehkä lanka on osuvampi kuin naru). Purkki pitäisi asettaa niin, että vettä lähtee haihtumaan, jolloin suola kiteytyy naruun/narussa jo roikkuvaan kiteeseen. Prosessi on hidas, ja purkkiin voi halutessaan lisätä lisää kylläistä suolaliuosta, jos liuoksen pinta laskee liikaa.
On ilmeisesti myös mahdollista kasvattaa "tippukiviä" virittämällä lanka niin, että se kulkee kahden kylläisellä suolaliuoksella täytetyn astian välillä. Langanpäät tarvitsevat jonkinlaiset ankkurit purkkeihin. Voit toki kokeilla, jos haluat.
Raportointi:
Ilmoita arviosi sille, mikä suolan liukoisuus oli yksikössä grammaa/100g vettä.
Laske liuenneen suolan ainemäärä.
Kuvaile, miten aloitit kidekasvatukset, ja kuvaa alkuviritykset. Raportti jää toistaiseksi kesken.
Kun saat kiteitä alkaa muodostua, ota kuvia. näin pystyt muodostamaan lyhyen raportin tuloksista.
Ehdimme tehdä muitakin juttuja ennen kuin nämä ovat valmiita, mutta annetaan kiteiden muodostua taustalla.
Pohjatietoa:
Kylläinen suolaliuos on siis sellainen, mihin suolaa on liuotettu niin paljon, ettei suurempi määrä pysty liukenemaan. Liukoisuus vaihtelee eri suoloilla, se voi olla vaikka välillä 0,001mg-30000mg/100g vettä. Osa liukenemistapahtumista on endotermisiä (=suolaa liukenee enemmän lämpimään veteen), osa eksotermisia (=suolan liukeneminen vapauttaa lämpöenergiaa, ja sitä liukenisi enemmän kylmään veteen).
Kun liuos tulee ylikylläiseksi (esimerkiksi jos kylläisestä liuoksesta haihtuu vettä), niin suolaa alkaa kiteytyä. Olemme jo kokeilleet KE1 -kurssilla veden haihduttamista suolaliuoksesta. Silloin suolan kiteet jäivät haihdutusmaljan pohjalle melko rapautuneessa muodossa: valkoisina ja murenevina. Jos halutaan kauniita kidemuodostelmia, kiteytyksen on tapahduttava hitaasti. Ensimmäiset kiteet syntyvät helpoiten liuoksen/astian rajapintoihin: pieniin epäpuhtauksiin tai muihin "herätteisiin". Kokeilemme kahta kiteytystapaa: suolageodin valmistamista sekä yksittäisen suolakiteen kasvattamista. Koska joka kodista löytyy ruokasuolaa, käytämme sitä. Voit halutessasi etsiä jonkin toisenkin suolan, esim ruokasooda tai (pesuaineena myytävä) kidesooda ovat kohtalaisen yleisiä kodin suoloja (ja jonkun kotoa voi löytyä eksoottisempiakin suoloja)
Eri suoloilla on erimuotoisia kiteitä, ja ruokasuolalle (NaCl) tyypillinen kidemuoto on kuutiollinen. Samalla kun te valmistatte kotona ruokasuolakiteitä, minä laitan kemian luokassa kasvamaan kuparisulfaattikiteitä, joista pitäisi tulla vinoneliön muotoisia.
Tarvikkeet:
- vettä (ehkä kannattaa lämmittää),
- ruokasuolaa (merisuola tai hienojakoisempi),
- tyhjä puhdas kananmunankuori + kennopaikka + väriainetta (jos haluat geodia varten)
- tyhjä kapeahko purkki + purkin suun yli menevä tikku+lankaa + yksi suuri merisuolakide kiteen kasvattamista varten
Tavoitteena on selvittää suolan liukoisuus /100g vettä (eli montako grammaa suolaa liukenee 1dl:aan vettä). Sekoita suolaa veteen niin paljon kuin siihen liukenee (eli kunnes sitä jää liukenematta astian pohjalle).Mieti, miten voit saada suolan punnittua, ja mahdollisimman tarkan tuloksen. Jos kotona ei ole pikkuvaakaa/keittiövaakaa, niin löytyisikö esimerkiksi puhelimelle punnitusapp? en tiedä. Jos tämä ei onnistu, niin sitten ei. Voit kuitenkin varautua siihen, että suolaa liukenee noin 30% veden painosta.
tämän videon alussa näkyy liuoksen valmistus.
2. Kananmunageodi
Yllä olevalla videolla on yksi ohje kananmunageodin valmistamiseksi (siinä munan sisäpintaan laitetaan liimaa ja herätekiteitä). Tässä blogissa on toinen ohje, jossa liimaa ei käytetä, sillä munan kuoren ilmataskut voivat vaikuttaa kidemuodostukseen. Voit toki vaikka kokeilla molempia ja verrata lopputuloksia. Voit halutessasi myös värjätä liemen esimerkiksi elintarvikevärillä tai vesiväreillä.
3. Jättisuolakide
Viritä purkki niin, että sen yläreunassa kulkee poikittain jokin tikku (tulitikku, lusikanvarsi, grillivartaan pätkä, voit kiinnittää vaikka sinitarralla). Tikusta pitäisi roikkua naru kylläiseen suolaliuokseen. Jos haluat aloittaa ihan nollasta, laita purkkiin roikkumaan pelkkä naru. Jos haluat nopeuttaa prosessia, etsi merisuolapurkista mahdollisimman suuri yksittäinen kide ja solmi se naruun (ehkä lanka on osuvampi kuin naru). Purkki pitäisi asettaa niin, että vettä lähtee haihtumaan, jolloin suola kiteytyy naruun/narussa jo roikkuvaan kiteeseen. Prosessi on hidas, ja purkkiin voi halutessaan lisätä lisää kylläistä suolaliuosta, jos liuoksen pinta laskee liikaa.
On ilmeisesti myös mahdollista kasvattaa "tippukiviä" virittämällä lanka niin, että se kulkee kahden kylläisellä suolaliuoksella täytetyn astian välillä. Langanpäät tarvitsevat jonkinlaiset ankkurit purkkeihin. Voit toki kokeilla, jos haluat.
Raportointi:
Ilmoita arviosi sille, mikä suolan liukoisuus oli yksikössä grammaa/100g vettä.
Laske liuenneen suolan ainemäärä.
Kuvaile, miten aloitit kidekasvatukset, ja kuvaa alkuviritykset. Raportti jää toistaiseksi kesken.
Kun saat kiteitä alkaa muodostua, ota kuvia. näin pystyt muodostamaan lyhyen raportin tuloksista.
Ehdimme tehdä muitakin juttuja ennen kuin nämä ovat valmiita, mutta annetaan kiteiden muodostua taustalla.
Ainemäärä
Kemiallisissa reaktioissa on oleellisempaa pystyä vertaamaan hiukkasten lukumääriä kuin esimerkiksi massoja. Reaktioyhtälöt ovat aina tasapainossa hiukkasten lukumäärien suhteen.
[[$ 2H_2\left(g\right)+O_2\left(g\right)\rightarrow2H_2O\left(g\right) $]],
Reaktioyhtälö kuvaa vetykaasun ja happikaasun reaktiota, se kertoo reagoivien aineiden lukumäärällisistä suhteista: vetyä tarvitaan kaksi kertaa niin paljon kuin happea. Tämä ei tarkoita sitä että reaktio onnistuisi niin, että vetyä on 2g ja happea 1g. Massoissa suhde on itse asiassa sellainen, että vettä tarvitaan 2g ja happea 16g! Yksittäisen happiatomin massa on nimittäin noin 16-kertainen vetyyn nähden.
Yhtälön mukaan reaktiossa kuluisi
Yhdessä grammassa ainetta on käsittämätön määrä hiukkasia, joten varsinaisesti lukumäärillä ei kemiassa lasketa. Käyttöön on otettu suure ainemäärä suuretunnus n, yksikkö mooli= mol). Osalle tämä voi olla tuttu fysiikan kurssilta Fy2, missä näitä on käytetty kaasujen tilanyhtälössa.
Edellisessä reaktiossa siis kuluisi
Taulukkokirjassa on luetteloituna jokaiselle alkuaineelle tieto siitä, paljonko keskimäärin painaa 1 mol kyseistä ainetta. (periaatteessahan tähän vaikuttaa isotoopitkin, siksi luvut ovat keskiarvoja aineen eri isotooppien atomimassoista) Nämä ovat niin sanottuja suhteellisia atomimassoja, joista yleensä käytetään nimitystä moolimassa (suuretunnus M ja yksikkö g/mol)
Esimerkiksi
[[$ \mathrm{M\left(H\right)}=1{,}008\ \frac{g}{mol} $]]
[[$ \mathrm{M\left(Au\right)}=196{,}97\ \frac{g}{mol} $]]
Huomaa, miten suuretunnuksen yhteyteen sulkeisiin aina merkitään se aine, josta on kyse.
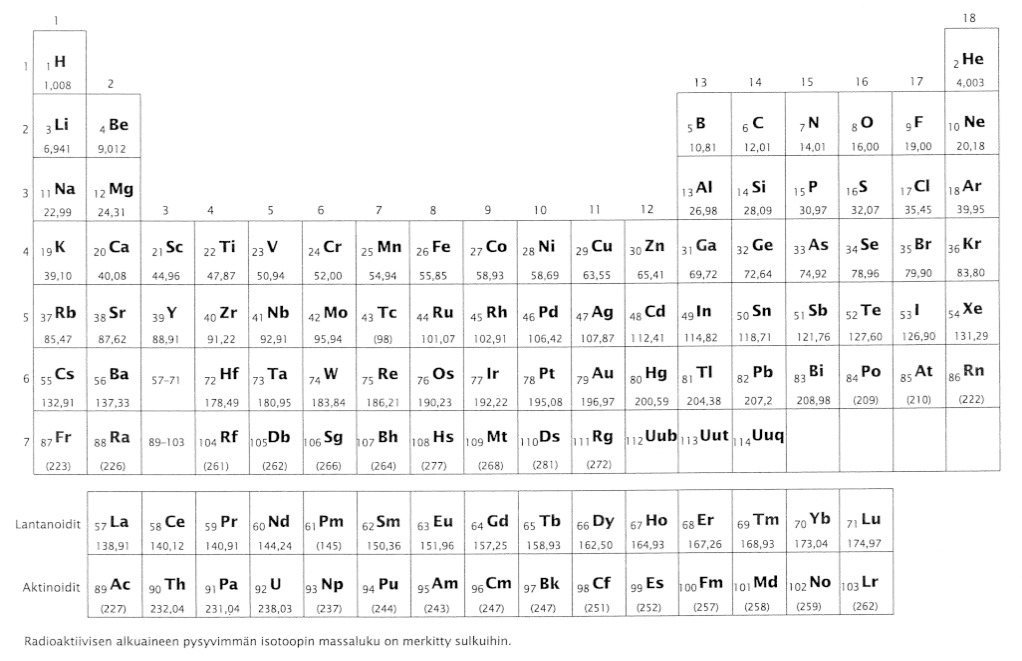
Yhdisteille voidaan laskea moolimassat laskemalla yhteen niissä esiintyvien atomien moolimassat:
[[$ M\left(H_2O\right)=2\cdot M\left(H\right)+M\left(O\right)=\left(2\cdot1{,}008\ +\ 16{,}00\right)\ \frac{g}{mol}=18{,}016\ \frac{g}{mol} $]]
Moolimassa kertoo, että jos vettä olisi 18,016 g, niin sitä olisi tasan 1 mol
Kun käytetään suuretunnuksia, voitaisiin merkitä sama asia seuraavasti:
[[$ m\left(H_2O\right)=18{,}016\ g\ \Rightarrow\ n\left(H_2O\right)=1{,}00\ mol $]]
Ainemäärän, massan ja moolimassan välinen suureyhtälö on [[$ n=\frac{m}{M} $]]. Jos kaksi näistä tunnetaan, kolmas on aina laskettavissa.
OpetusTV:stä löytyy aiheeseen liittyviä opetusvideoita, jos tuntuu tarpeelliselta: linkki
Seuraavassa on kolmenlaisia harjoituksia:
1. Moolimassan laskeminen eri yhdisteille
2. Ainemäärän laskeminen, jos tiedetään näytteen massa
3. Massan laskeminen, jos tiedetään näytteen ainemäärä
Tee tehtävät ja palauta palautuskansioon.
[[$ 2H_2\left(g\right)+O_2\left(g\right)\rightarrow2H_2O\left(g\right) $]],
Reaktioyhtälö kuvaa vetykaasun ja happikaasun reaktiota, se kertoo reagoivien aineiden lukumäärällisistä suhteista: vetyä tarvitaan kaksi kertaa niin paljon kuin happea. Tämä ei tarkoita sitä että reaktio onnistuisi niin, että vetyä on 2g ja happea 1g. Massoissa suhde on itse asiassa sellainen, että vettä tarvitaan 2g ja happea 16g! Yksittäisen happiatomin massa on nimittäin noin 16-kertainen vetyyn nähden.
Yhtälön mukaan reaktiossa kuluisi
- 2kpl vetymolekyylejä + 1 kpl happimolekyylejä, jolloin syntyy 2 kpl vesimolekyylejä
- 500 kpl vetymolekyylejä + 250 kpl happimolekyylejä, jolloin syntyy 500 kpl vesimolekyylejä
Yhdessä grammassa ainetta on käsittämätön määrä hiukkasia, joten varsinaisesti lukumäärillä ei kemiassa lasketa. Käyttöön on otettu suure ainemäärä suuretunnus n, yksikkö mooli= mol). Osalle tämä voi olla tuttu fysiikan kurssilta Fy2, missä näitä on käytetty kaasujen tilanyhtälössa.
Edellisessä reaktiossa siis kuluisi
- 2,0 mol vetymolekyylejä + 1,0 mol happimolekyylejä, jolloin syntyy 2,0 mol vettä
- 0,64 mol vetymolekyylejä + 0,32 mol happimolekyylejä, jolloin syntyy 0,64 mol vettä
Taulukkokirjassa on luetteloituna jokaiselle alkuaineelle tieto siitä, paljonko keskimäärin painaa 1 mol kyseistä ainetta. (periaatteessahan tähän vaikuttaa isotoopitkin, siksi luvut ovat keskiarvoja aineen eri isotooppien atomimassoista) Nämä ovat niin sanottuja suhteellisia atomimassoja, joista yleensä käytetään nimitystä moolimassa (suuretunnus M ja yksikkö g/mol)
Esimerkiksi
[[$ \mathrm{M\left(H\right)}=1{,}008\ \frac{g}{mol} $]]
[[$ \mathrm{M\left(Au\right)}=196{,}97\ \frac{g}{mol} $]]
Huomaa, miten suuretunnuksen yhteyteen sulkeisiin aina merkitään se aine, josta on kyse.

Yhdisteille voidaan laskea moolimassat laskemalla yhteen niissä esiintyvien atomien moolimassat:
[[$ M\left(H_2O\right)=2\cdot M\left(H\right)+M\left(O\right)=\left(2\cdot1{,}008\ +\ 16{,}00\right)\ \frac{g}{mol}=18{,}016\ \frac{g}{mol} $]]
Moolimassa kertoo, että jos vettä olisi 18,016 g, niin sitä olisi tasan 1 mol
Kun käytetään suuretunnuksia, voitaisiin merkitä sama asia seuraavasti:
[[$ m\left(H_2O\right)=18{,}016\ g\ \Rightarrow\ n\left(H_2O\right)=1{,}00\ mol $]]
Ainemäärän, massan ja moolimassan välinen suureyhtälö on [[$ n=\frac{m}{M} $]]. Jos kaksi näistä tunnetaan, kolmas on aina laskettavissa.
OpetusTV:stä löytyy aiheeseen liittyviä opetusvideoita, jos tuntuu tarpeelliselta: linkki
Seuraavassa on kolmenlaisia harjoituksia:
1. Moolimassan laskeminen eri yhdisteille
2. Ainemäärän laskeminen, jos tiedetään näytteen massa
3. Massan laskeminen, jos tiedetään näytteen ainemäärä
Tee tehtävät ja palauta palautuskansioon.
1. Moolimassojen laskeminen eri yhdisteille
Nimeä seuraavat yhdisteet ja laske niiden moolimassat. Merkitse lasku siististi suuretunnuksilla ja yksiköillä yllä olevan [[$ M\left(H_2O\right) $]] mukaisesti.
a) [[$ CaSO_4 $]]
b) [[$ \left(NH_4\right)_2SO_4 $]]
c) [[$ CH_3CH_2COOH $]] (voit ensin laskea päässä montako mitäkin alkuainetta on)
d) [[$ PCl_5 $]]
e) [[$ CuSO_4\cdot5H_2O $]]
(Huom, kertomerkki ei tässä ole kertomerkki, vaan kideveden tunnus. Sinun on laskettava yhteen kuparisulfaatin ja viiden veden moolimassat)
a) [[$ CaSO_4 $]]
b) [[$ \left(NH_4\right)_2SO_4 $]]
c) [[$ CH_3CH_2COOH $]] (voit ensin laskea päässä montako mitäkin alkuainetta on)
d) [[$ PCl_5 $]]
e) [[$ CuSO_4\cdot5H_2O $]]
(Huom, kertomerkki ei tässä ole kertomerkki, vaan kideveden tunnus. Sinun on laskettava yhteen kuparisulfaatin ja viiden veden moolimassat)
2. Ainemäärän laskeminen
Esim:
Astiassa on 27,6 g hiilidioksidia. Mikä on hiilidioksidin ainemäärä?
[[$ m\left(CO_2\right)=27{,}6\ g $]]
[[$ M\left(CO_2\right)=\left(12{,}01+2\cdot16{,}00\right)\ \frac{g}{mol}\ =44{,}01\ \frac{g}{mol} $]]
[[$ n\left(CO_2\right)=\frac{m\left(CO_2\right)}{M\left(CO_2\right)} $]] suureyhtälön mukaisesti, eli
[[$ n\left(CO_2\right)=\frac{m\left(CO_2\right)}{M\left(CO_2\right)}=\frac{27{,}6\ g}{44{,}01\ \frac{g}{mol}}=0{,}62713\ mol\ \approx0{,}627\ mol $]]
Huomaa, että ensin kirjataan tehtävässä annetut tiedot ja moolimassa tunnuksineen ja suureineen (='tietokenttä') ja vasta sitten tehdään laskut. Laskuissakin merkitään yksiköt paikoilleen! Kolmannen rivin voi jättää pois. Lopputulos pyöristetään epätarkimman (tehtävässä annetun) lähtöarvon mukaan. Moolimassa on tilastosuure, jota ei pyöristetä, ja joka ei vaikuta pyöristyksiin.
Laske ainemäärät seuraaville massoille:
a) vettä on 52,3 g
b) kultaa on 1,5 g
c) ruokasuolaa (NaCl) on 28 g
d) kuparisulfaattia on 12,34 g
Astiassa on 27,6 g hiilidioksidia. Mikä on hiilidioksidin ainemäärä?
[[$ m\left(CO_2\right)=27{,}6\ g $]]
[[$ M\left(CO_2\right)=\left(12{,}01+2\cdot16{,}00\right)\ \frac{g}{mol}\ =44{,}01\ \frac{g}{mol} $]]
[[$ n\left(CO_2\right)=\frac{m\left(CO_2\right)}{M\left(CO_2\right)} $]] suureyhtälön mukaisesti, eli
[[$ n\left(CO_2\right)=\frac{m\left(CO_2\right)}{M\left(CO_2\right)}=\frac{27{,}6\ g}{44{,}01\ \frac{g}{mol}}=0{,}62713\ mol\ \approx0{,}627\ mol $]]
Huomaa, että ensin kirjataan tehtävässä annetut tiedot ja moolimassa tunnuksineen ja suureineen (='tietokenttä') ja vasta sitten tehdään laskut. Laskuissakin merkitään yksiköt paikoilleen! Kolmannen rivin voi jättää pois. Lopputulos pyöristetään epätarkimman (tehtävässä annetun) lähtöarvon mukaan. Moolimassa on tilastosuure, jota ei pyöristetä, ja joka ei vaikuta pyöristyksiin.
Laske ainemäärät seuraaville massoille:
a) vettä on 52,3 g
b) kultaa on 1,5 g
c) ruokasuolaa (NaCl) on 28 g
d) kuparisulfaattia on 12,34 g
3. Massan laskeminen ainemäärän avulla
Esim:
Liuoksen valmistamiseen tarvitaan 0,35 mol glukoosia ([[$ C_6H_{12}O_6 $]]). Paljonko sitä on punnittava?
[[$ n\left(C_6H_{12}O_6\right)=0{,}35\ mol $]]
[[$ M\left(C_6H_{12}O_6\right)=\left(6\cdot12{,}01+12\cdot1{,}008+6\cdot16\right)\ \frac{g}{mol}=\ 180{,}156\ \frac{g}{mol} $]]
[[$ n=\frac{m}{M}\ \ \ \ \Rightarrow\ \ \ m=n\cdot M $]] suureyhtälön mukaisesti, eli
[[$ m\left(C_6H_{12}O_6\right)=n\cdot M=0{,}35\ mol\cdot180{,}156\ \frac{g}{mol}=63{,}0546\ g\ \approx63\ g $]]
Jälleen kerran ensin kirjataan tehtävässä annetut ja taulukosta etsityt tiedot (tässä ainemäärä ja moolimassa) suuretunnuksineen ja yksiköineen. Kolmas rivi ei ole välttämätön. Lasku lasketaan niin, että yksiköt ovat mukana ja lopputulos pyöristetään tehtävässä annetun mittatiedon määräämään tarkkuuteen (tarkkuus lasketaan merkitsevien numeroiden lukumääränä)
Laske seuraavien näytteiden massat:
a) vettä on 3,67 mol
b) steariinia ([[$ C_{18}H_{36}O_2 $]]) on 0,50 mol
c) rikkihappoa ([[$ H_2SO_4 $]]) on 0,367 mol
d) hiilidioksidia on 1,579 mol
Liuoksen valmistamiseen tarvitaan 0,35 mol glukoosia ([[$ C_6H_{12}O_6 $]]). Paljonko sitä on punnittava?
[[$ n\left(C_6H_{12}O_6\right)=0{,}35\ mol $]]
[[$ M\left(C_6H_{12}O_6\right)=\left(6\cdot12{,}01+12\cdot1{,}008+6\cdot16\right)\ \frac{g}{mol}=\ 180{,}156\ \frac{g}{mol} $]]
[[$ n=\frac{m}{M}\ \ \ \ \Rightarrow\ \ \ m=n\cdot M $]] suureyhtälön mukaisesti, eli
[[$ m\left(C_6H_{12}O_6\right)=n\cdot M=0{,}35\ mol\cdot180{,}156\ \frac{g}{mol}=63{,}0546\ g\ \approx63\ g $]]
Jälleen kerran ensin kirjataan tehtävässä annetut ja taulukosta etsityt tiedot (tässä ainemäärä ja moolimassa) suuretunnuksineen ja yksiköineen. Kolmas rivi ei ole välttämätön. Lasku lasketaan niin, että yksiköt ovat mukana ja lopputulos pyöristetään tehtävässä annetun mittatiedon määräämään tarkkuuteen (tarkkuus lasketaan merkitsevien numeroiden lukumääränä)
Laske seuraavien näytteiden massat:
a) vettä on 3,67 mol
b) steariinia ([[$ C_{18}H_{36}O_2 $]]) on 0,50 mol
c) rikkihappoa ([[$ H_2SO_4 $]]) on 0,367 mol
d) hiilidioksidia on 1,579 mol