4. Heikot hapot ja emäkset
Happo-emästasapaino
Heikko happo ja happovakio
Heikko emäs ja emäsvakio
[[$Huom!\ hapon\ HA\ happovakiolle\ ja\ tätä\ happoa\ vastaavan\ emäksen\ A^-\ emäsvakion\ kesken\ on\ voimassa:\ K_a\left(HA\right)\cdot K_b\left(A^-\right)=K_w=1{,}008\cdot10^{-14}\ \left(\frac{mol}{l}\right)^2$]]
1. Vahvat hapot
2. Heikot hapot
3. Vahvat emäkset
4. Heikot emäkset
Kotitehtävät 28.4. : 116, 119 ja 127
- Heikot hapot protolysoituvat vedessä vain osittain.
- Heikon hapon HA protolyysi
- [[$HA\left(aq\right)+H_2O\left(l\right)\ \xrightleftharpoons[]{}\ A^-\left(aq\right)+H_3O^+\left(aq\right)$]]
[[$tässä\ A^-\ on\ happoa\ HA\ vastaava\ vastinemäs$]]
[[$K=\frac{\left[A^-\right]\cdot\left[H_3O^+\right]}{\left[HA\right]\cdot\left[H_2O^{ }\right]}\ \ \Leftrightarrow\ K\cdot\left[H_2O\right]=K_a=\frac{\left[A^-\right]\cdot\left[H_3O^+\right]}{\left[HA\right]}{,}\ jossa\ K_a\ on\ happovakio$]]- Huom! happovakion lausekkeen konsentraatiot ovat tasapainokonsentraatioita
- Happo on sitä vahvempi, mitä suurempi on sen happovakio (mitä enemän HA luovuttaa protoneita vesimolekyylille)
- Protolysoitumisaste, α
- [[$\alpha=\frac{\left[A^-\right]}{\left[HA\right]_{alkuper}}\cdot100\%$]]
Heikko emäs ja emäsvakio
- Heikolla emäksellä B on tasapaino
- [[$B\left(aq\right)+H_2O\left(l\right)\ \xrightleftharpoons[]{}\ BH^+\left(aq\right)+OH^-\left(aq\right)$]]
- tässä BH+ on emästä B vastaava vastinhappo
- tasapainovakion lauseke
- [[$K=\frac{\left[BH^+\right]\cdot\left[OH^-\right]}{\left[B\right]\cdot\left[H_2O\right]}$]]
- emäsvakio
- [[$K\cdot\left[H_2O\right]=K_b=\frac{\left[BH^+\right]\cdot\left[OH^-\right]}{\left[B\right]}$]]
- protolysoitumisaste
- [[$\alpha=\frac{\left[BH^+\right]}{\left[B\right]_{alussa}}\cdot100\%$]]
- esimerkki
[[$Huom!\ hapon\ HA\ happovakiolle\ ja\ tätä\ happoa\ vastaavan\ emäksen\ A^-\ emäsvakion\ kesken\ on\ voimassa:\ K_a\left(HA\right)\cdot K_b\left(A^-\right)=K_w=1{,}008\cdot10^{-14}\ \left(\frac{mol}{l}\right)^2$]]
pH:n laskeminen
1. Vahvat hapot
- happovakio, Ka > 1 eli protolysoituvat täysin
- [[$\left[H_3O^+\right]\ saadaan\ suoraan\ vahvan\ hapon\ konsentraatiosta\ \left(K_a\ ei\ tarvita\right)$]]
2. Heikot hapot
- [[$\left[H_3O^+\right]\ tasapainotilassa\ saadaan\ happovakion\ K_a\ avulla\ \Rightarrow\ pH=-\lg\left[H_3O^+\right]$]]
3. Vahvat emäkset
- [[$\left[OH^-\right]\ saadaan\ suoraan\ emäksen\ konsentraatiosta\ \left(K_b\ ei\ tarvita\right)$]]
4. Heikot emäkset
- [[$\left[OH^-\right]\ saadaan\ emäsvakion{,}\ K_b\ avulla$]]
[[$lasketaan\ \left[H_3O^+\right]=\frac{K_w}{\left[OH^-\right]}\ ja\ pH=-\lg\left[H_3O^+\right]\ tai$]]
[[$lasketaan\ pOH=-\lg\left[OH^-\right]\ ja\ pH=14-pOH$]]
Kotitehtävät 28.4. : 116, 119 ja 127
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
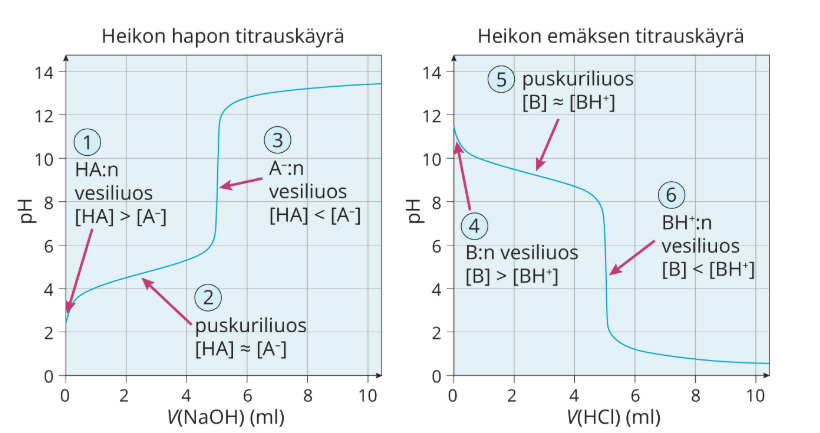
Puskuriliuokset
Puskuriliuos on liuos, jonka pH-arvo ei muutu oleellisesti pienistä happo- tai emäslisäyksistä. Puskuriliuos valmistetaan
1. Happopuskuri
2. Emäspuskuri
Puskuriliuoksen kyky vastustaa pH:n muutoksia on parhaimmillaan, jos heikon hapon ja sen vastinemäksen tai heikon emäksen ja sen vastinhapon konsentraatiot ovat lähes yhtä suuret.
- heikosta haposta ja sen suolasta tai
- heikosta emäksestä tai sen suolasta
1. Happopuskuri
- [[$CH_3COOH\left(aq\right)+H_2O\ \left(l\right)\xrightleftharpoons[]{}CH_3COO^-\left(aq\right)+H_3O^+\left(aq\right)$]]
[[$ja\ CH_3COONa\left(aq\right)\ \rightarrow\ CH_3COO^-\left(aq\right)+Na^+\left(aq\right)$]]- [[$K_a=\frac{\left[CH_3COO^-\right]\cdot\left[H_3O^+\right]}{\left[CH_3COOH\right]}\ \Leftrightarrow\ \ \left[H_3O^+\right]=K_a\cdot\frac{\left[CH_3COOH\right]}{\left[CH_3COO^-\right]}$]]
- [[$Tässä\ \left[CH_3COO^-\right]\ on\ suolaliuoksen\ konsentraatio\ \left(emäspuoli\right)$]][[$ja\ \left[CH_3COOH\right]\ on\ hapon\ alkuperäinen\ konsentraatio\ \left(happopuoli\right)$]]
2. Emäspuskuri
- [[$NH_3\left(aq\right)+H_2O\left(l\right)\ \xrightleftharpoons[\ \ \ ]{}\ NH_4^+\left(aq\right)+OH^-\left(aq\right)\ ja\ NH_4Cl\ \left(aq\right)\ \rightarrow\ NH_4^+\left(aq\right)+Cl^-\left(aq\right)$]]
[[$K_b=\frac{\left[NH_4^+\right]\cdot\left[OH^-\right]}{\left[NH_3\right]}\ \ \Leftrightarrow\ \left[OH^-\right]=K_b\cdot\frac{\left[NH_3\right]}{\left[NH_4^+\right]}$]]- [[$Tässä\ \left[NH_3\right]\ on\ emäspuolen\ konsentraatio\ ja\ \left[NH_4^+\right]\ on\ happopuolen\ konsentraatio$]]
- Happolisäys lisätään happopuolelle ja vähennetään emäspuolelta. Emäslisäys päinvastoin.
Puskuriliuoksen kyky vastustaa pH:n muutoksia on parhaimmillaan, jos heikon hapon ja sen vastinemäksen tai heikon emäksen ja sen vastinhapon konsentraatiot ovat lähes yhtä suuret.
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Happo-emäs -titraus
Hapon ja emäksen neutraloitumisreaktiossa oksoniumionit reagoivat hydroksidi-ionien kanssa, jolloin muodostuu vettä:
[[$H_3O^+\left(aq\right)+OH^-\left(aq\right)\ \rightarrow\ H_2O\left(l\right)$]]
Kun hapon ja emäksen neutraloitumisreaktio kirjoitetaan täydellisesti niin
happo + emäs → suola + vesi'
Tällöin reaktioyhtälössä näkyy mistä haposta ja emäksestä neutraloitumisreaktiossa on kyse ja mitä suolaa muodostuu.
Happo-emästitrauksessa toisen konsentraatio tunnetaan tarkasti ja toisen konsentraatio voidaan määrittää.
Jos esim emäsliuoksen konsentraatio tunnetaan ja hapon konsentraatio halutaan määrittää niin emäsliuos laitetaan pyrettiin. Emästä lisätään pyretistä hapon joukkoon.
Titrauksen ekvivalenttipiste on titrauksen päätepiste
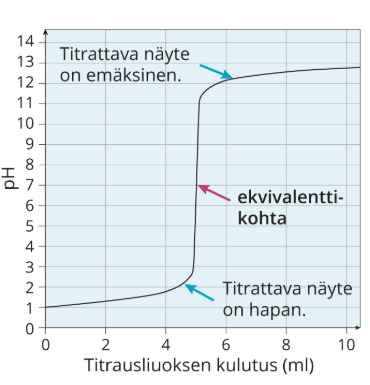
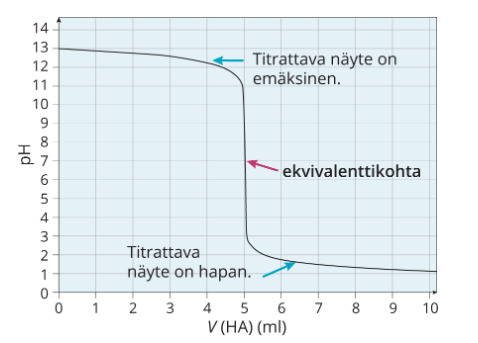
Titrauksen kulkua voidaan seurata myös mittaamalla pH-arvoa titrauksen eri vaiheissa. Kun pystyakselilla on pH-arvo ja vaaka-akselilla titrausliukosen tilavuus, saadaan laadittua titrauskäyrä. Titrauskäyrää tulkitsemalla voidaan
Erilaisia titrauskäyriä
Vahvojen protolyyttien titrauksissa ekvivalenttikohdassa pH on tasan 7.
Kun heikkoja protolyytteja titrataan vahvoilla hapoilla tai emäksillä, ei pH ole tasan 7
[[$H_3O^+\left(aq\right)+OH^-\left(aq\right)\ \rightarrow\ H_2O\left(l\right)$]]
Kun hapon ja emäksen neutraloitumisreaktio kirjoitetaan täydellisesti niin
happo + emäs → suola + vesi'
Tällöin reaktioyhtälössä näkyy mistä haposta ja emäksestä neutraloitumisreaktiossa on kyse ja mitä suolaa muodostuu.
- reaktioyhtälö tapahtuu täysin reaktioyhtälön kertoimien ilmoittamassa ainemääräsuhteissa
Happo-emästitrauksessa toisen konsentraatio tunnetaan tarkasti ja toisen konsentraatio voidaan määrittää.
Jos esim emäsliuoksen konsentraatio tunnetaan ja hapon konsentraatio halutaan määrittää niin emäsliuos laitetaan pyrettiin. Emästä lisätään pyretistä hapon joukkoon.
Titrauksen ekvivalenttipiste on titrauksen päätepiste
- neutraloituminen on tapahtunut täydellisesti
- happoa ja emästä on reaktioyhtälön kertoimien mukaisessa ainemääräsuhteessa
- voidaan havaita pH indikaattorin avulla, jossa tapahtuu värinmuutos liuoksen pH-arvon muuttuessa
Titrauksen kulkua voidaan seurata myös mittaamalla pH-arvoa titrauksen eri vaiheissa. Kun pystyakselilla on pH-arvo ja vaaka-akselilla titrausliukosen tilavuus, saadaan laadittua titrauskäyrä. Titrauskäyrää tulkitsemalla voidaan
- päätellä titrauksen ekvivalenttipiste ja määrittää sen avulla tutkitun liuoksen konsentraatio
- valita titraukseen sopiva indikaattori
- laskea heikon hapon happovakio tai heikon emäksen emäsvakio
Erilaisia titrauskäyriä
1. Vahvan hapon titraus vahvalla emäksellä

2. Vahvan emäksen titraus vahvalla hapolla

3. Heikon hapon tai emäksen titraus vahvalla emäksellä tai hapolla

Vahvojen protolyyttien titrauksissa ekvivalenttikohdassa pH on tasan 7.
Kun heikkoja protolyytteja titrataan vahvoilla hapoilla tai emäksillä, ei pH ole tasan 7
- Heikko happo titrataan vahvalla emäksellä, pH on yli 7
- Tämä johtuu siitä, että syntyvä suolan ioni (heikko emäs) voi protolysoitua vedessä
- Heikko emäs titrataan vahvalla hapolla, pH on alle 7
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
