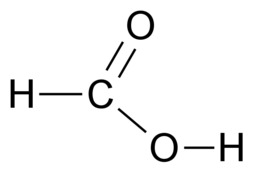
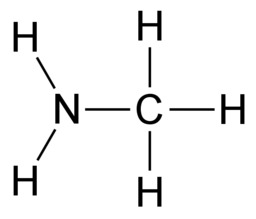
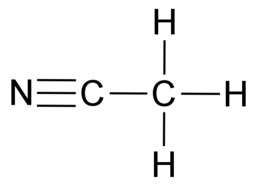
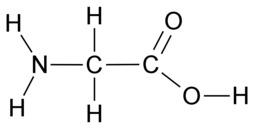
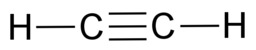E3 Orgaanisten molekyylien sidokset
Aluksi
Sidosten lukumäärä
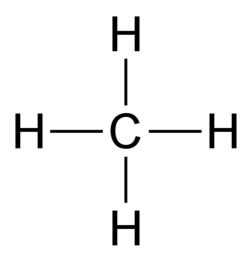
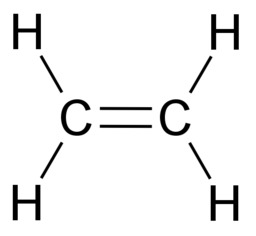
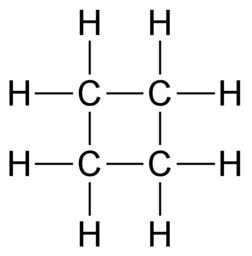
Orgaaninen kemia tutkii hiilen yhdisteitä. Näitä yhdisteitä tunnetaan valtavat määrät, koska hiiliatomit voivat liittyä pitkiksi ketjuiksi loputtoman monilla tavoilla. Moninaisuuden mahdollistaa hiiliatomin kyky sitoutua neljään atomiin yksinkertaisilla kovalenttisilla sidoksilla. Sidokset voivat olla myös kaksois- tai kolmoissidoksia, kunhan sidosten yhteenlaskettu lukumäärä on neljä. Tavalliset vaihtoehdot ovat neljä yksinkertaista sidosta, yksi kaksoissidos ja kaksi yksinkertaista sidosta sekä yksi kolmoissidos ja yksi yksinkertainen sidos.
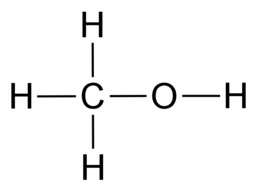
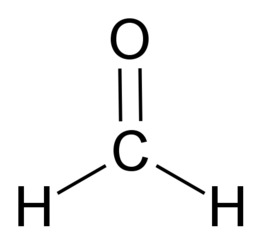
Hiilen tavoin vety, happi ja typpi sitoutuvat orgaanisissa yhdisteissä kovalenttisin sidoksin. Vety sitoutuu yhdellä yksinkertaisella sidoksella. Happi sitoutuu kahdella yksinkertaisella sidoksella tai yhdellä kaksoissidoksella. Typpi sitoutuu kolmella yksinkertaisella sidoksella, yhdellä kolmoissidoksella tai yhdellä kaksoissidoksella ja yhdellä yksinkertaisella sidoksella.
Oktettiin pääseminen
Atomi muodostaa niin monta sidosta, että sen uloin elektronikuori täyttyy. Vetyatomin uloimmalle elektronikuorelle mahtuu kaksi elektronia. Koska vetyatomilla on omasta takaa yksi elektroni, se jakaa tämän elektronin kovalenttisessa sidoksessa ja saa näin ympärilleen toisen elektronin. Heliumatomilla on luonnostaan tällainen vakaa kahden elektronin rakenne, mikä selittää sitä, että yhtään heliumia sisältävää yhdistettä ei ole pystytty valmistamaan.
Hiileltä puuttuu täydestä elektronikuoresta neljä elektronia, joten se muodostaa neljä kovalenttista sidosta. Typeltä puuttuu kolme elektronia ja hapelta kaksi elektronia, joten typpi muodostaa kolme sidosta ja happi kaksi sidosta. Hiili, typpi ja happi saavuttavat kovalenttisilla sidoksilla vakaan kahdeksan ulkoelektronin rakenteen eli oktetin. Oktetin avulla voidaan kuvata monien muidenkin alkuaineiden sitoutumista. Esimerkiksi neonin sitoutumattomuutta selittää se, että neonatomilla on oktetti jo valmiiksi.
https://peda.net/id/ccd4c02a4Sidoselektronien jakautuminen
Hiiliatomilla on kuusi protonia, typpiatomilla on seitsemän protonia ja happiatomilla on kahdeksan protonia. Koska hapella on näistä atomeista ytimessään suurin varaus, se vetää yhteisiä elektroneja keskimäärin eniten puoleensa. Typellä on seuraavaksi suurin ydinvaraus, joten se vetää yhteisiä elektroneja seuraavaksi eniten puoleensa.
Hiili vetää sidoselektroneja puoleensa vähemmän kuin typpi ja happi mutta enemmän kuin vety. Ero vetyyn ei ole kuitenkaan niin suuri kuin voisi päätellä siitä, että hiiliatomilla on kuusi protonia ja vetyatomilla on vain yksi protoni. Vetovoimaan vaikuttaa nimittäin varausten suuruuden lisäksi varausten etäisyys. Vetyatomilla on vain yksi elektronikuori, joten vetyatomi on selvästi pienempi kuin hiiliatomi, jolla on kaksi elektronikuorta. Pieni koko tasaa pienen ydinvarauksen vaikutusta niin paljon, että vety- ja hiiliatomien väliset sidoselektronit jakautuvat melkein tasan.
Atomin kykyä vetää puoleensa yhteisiä sidoselektroneja eli kykyä kerätä itselleen negatiivista varausta sanotaan elektronegatiivisuudeksi. Hapella ja typellä on suuri elektronegatiivisuus, kun taas hiilellä ja vedyllä on keskinkertainen elektronegatiivisuus. Yhdisteen sisältämien alkuaineiden elektronegatiivisuudet vaikuttavat huomattavasti yhdisteen ominaisuuksiin.
https://peda.net/id/ccd552064Asetonissa on elektronegatiivinen happiatomi (kuvassa punaisella), joten varausjakaumassa hapen kohdalla on negatiivisen varauksen alue.
Esimerkiksi
Ratkaisu
a) Hiilen ja hapen välillä on oltava sidos, sillä jos kaikki vedyt sitoutuisivat hiileen, hapelle ei jäisi enää mitään mihin sitoutua. Hiilen ja hapen välisen sidoksen jälkeen jäljelle jää kolme hiilen sidosta ja yksi hapen sidos. Vedyt sitoutuvat näihin jäljelle jääviin sidoksiin.
https://peda.net/id/ccd5e78e4b) Hiilet voivat liittyä toisiinsa tai kumpikin voi liittyä typpeen. Vedyt sitoutuvat jäljelle jääviin sidoksiin.
https://peda.net/id/ccd916fc4c) Molekyyli on mahdollinen vain, jos yksi hiili sitoutuu kahteen muuhun hiileen. Vetyjä ei kuitenkaan riitä kaikkiin sidoksiin, jos hiiliketju on suora ja kaikki sidokset ovat yksinkertaisia. Ongelma poistuu, jos ensimmäinen ja kolmas hiiliatomi sitoutuvat toisiinsa niin, että ketjusta tulee rengas.
Vaihtoehtoisesti hiiliatomien välillä voi olla yksi kaksoissidos. Kaksoissidoksen voi piirtää yhtä hyvin ensimmäisen ja toisen tai toisen ja kolmannen hiiliatomin välille, sillä molemmat kuvaavat samaa molekyyliä.
https://peda.net/id/ccd87c244Lopuksi
E3.2 Mitkä rakenteet ovat mahdollisia, jos molekyylikaava on a) C2H6O, b) C4H8, c) C3H9N, d) C2H4O?
E3.3 Elektronegatiivisuutta mitataan tavallisesti Paulingin asteikolla. Sen mukaan esimerkiksi hapen elektronegatiivisuus on noin 3,4 ja hiilen elektronegatiivisuus on noin 2,6. Selvitä elektronegatiivisuustaulukon avulla, kummassa yhdisteessä hiiliatomien ympärillä on enemmän elektroneja: Teflonin raaka-aineessa tetrafluorieteenissä vai PVC-muovin raaka-aineessa kloorieteenissä eli vinyylikloridissa.
https://peda.net/id/ccd67dd44E3.5 Orgaanisiksi yhdisteiksi ei yleensä lueta aivan kaikkia hiilen yhdisteitä. Selvitä, millä tavoilla orgaaninen yhdiste voidaan määritellä.
Malliratkaisut ja kommentit
Niksi
Sidosten lukumäärän voi palauttaa mieleen HONC-muistisäännöllä. Ensimmäisenä mainittu vety muodostaa yhden sidoksen, toinen alkuaine eli happi muodostaa kaksi sidosta, kolmas eli typpi muodostaa kolme sidosta ja neljäs eli hiili muodostaa neljä sidosta.
Ajatellaan molekyyliä, joka alkaa ja loppuu vetyatomiin. Yksinkertaisimmillaan se on vetymolekyyli H–H. Lisätään molekyyliin happiatomeja: ensin H–O–H, sitten H–O–O–H, sen jälkeen H–O–O–O–H ja niin edelleen. Koska happiatomi muodostaa kaksi sidosta, se ei vaikuta vetyatomien määrään.
Lisätään sitten vetymolekyyliin hiiliatomeja siten, että jäljelle jäävät paikat täytetään vetyatomeilla: H–CH2–H, sitten H–CH2–CH2–H, sitten H–CH2–CH2–CH2–H. Koska hiiliatomi muodostaa neljä sidosta, kukin hiiliatomi tuo kaksi uutta vetyatomia. Typpiatomit taas tuovat mukanaan aina yhden vetyatomin: H–NH–H, sitten H–NH–NH–H, sitten H–NH–NH–NH–H.
Vetyatomien määrä on siis vetyä, happea, hiiltä ja typpeä sisältävissä molekyyleissä 2h + t + 2, missä h on hiiliatomien lukumäärä, t on typpiatomien lukumäärä ja viimeinen kakkonen tulee ketjun ensimmäisestä ja viimeisestä vetyatomista. Laskukaavaan ei vaikuta ketjun haaroittuminen.
Jos ketju muodostaisi renkaan, ensimmäistä ja viimeistä vetyatomia ei tarvittaisi, sillä ensimmäinen ja viimeinen hiiliatomi liittyisivät toisiinsa. Vetyatomien määrä vähenisi tällöin kahdella. Myös kaksoissidos vähentää vetyatomien määrää kahdella, sillä kaksoissidos merkitsee, että kaksi atomia liittyy toisiinsa vetyjen sijasta. Kolmoissidos vastaa kahta kaksoissidosta, eli vetyatomit vähenevät neljällä.
Renkaiden ja kaksoissidosten lukumäärä voidaan siis selvittää laskemalla ”puuttuvien” vetyjen määrä ja jakamalla tulos kakkosella. ”Puuttuvien” vetyjen määrä saadaan vähentämällä molekyylin vetyatomien määrä suurimmasta mahdollisesta vetyatomien määrästä eli luvusta 2h + t + 2. Renkaiden ja kaksoissidosten lukumäärä on siten (2h + t + 2 − v)/2, missä v on vetyatomien lukumäärä.
Molekyylille C3H8 pätee 2h + t + 2 = 2 · 3 + 0 + 2 = 8. Koska molekyylissä vetyatomien määrä on kahdeksan eli suurin mahdollinen, siinä ei ole renkaita tai moninkertaisia sidoksia. Molekyylillä C3H6 taas on kaksi vetyatomia vähemmän kuin olisi hiiliatomien perusteella mahdollista, eli siinä on yksi rengas tai kaksoissidos.
Kofeiinin kaava on C8H10N4O2. Koska tässä tapauksessa pätee 2h + t + 2 = 2 · 8 + 4 + 2 = 22 ja (22 − 10)/2 = 6, kofeiinimolekyylissä on kuusi rengasta tai kaksoissidosta (jos siinä ei ole kolmoissidoksia). Todellisuudessa renkaita on kaksi ja kaksoissidoksia on neljä.
https://peda.net/id/ccd72aea4