8 Happokemia
Toinen toinen koealue 8. luokalla
- Teoriakirja
- Kpl 16-19
- syventävä +kappale
- Muistiinpanot
- Vihko + tämä kertaussivu
- Tärppi oksonium ja hydroksidi
- Tunnistaminen kaavasta ja pallomallista
- Yhdistäminen oikein happamaan ja emäksiseen
- Yhdistäminen oikein pH-arvoon yli tai alle 7
- Tärppi, 4p (kysytään kokeessa varmasti)
- Mallivastaukset kertaussivulla
- Valitse yksi seuraavista:
kaliumhydroksidi, rikkihappo, typpihappo,
hiilihappo, ammoniakki, natriumvetykarbonaatti - Kerro laajasti:
- happo vai emäs?
- vahva vai heikko?
- kemiallinen kaava
- käyttökohteet tai käyttömenetelmät
- ominaisuudet
Kertaustunnilla on ohjelmassa kertausmoniste ja sen ratkaisut.
Löydät ne tarvittaessa täältä
Happamuus ja emäksisyys - muistiinpanot
Hapan liuos
- pH noin 0...4 vahvasti hapan, 5...6 lievästi hapan
- Sisältää oksoniumioneita H3O+
- Hapan liuos koostuu haposta ja vedestä
- Happo on aine, joka voi luovuttaa vesiliuoksessa vetyionin H+
Ⓔ suolahappo eli vetykloridi ja vesi
HCl + H2O → Cl− + H3O+
suolahappo + vesi → kloridi-ioni + oksoniumioni - Happo siis aiheuttaa vedessä oksoniumionin

Kuva: Suolahappo liukenee veteen ioneina. Koska vetyioni ei esiinny yksinään, vesimolekyyli ottaa sen kantaakseen ja muuttuu oksoniumioniksi. Happaman liuoksen tunnistaa oksoniumioneista (H3O+).
Neutraali liuos
- pH 7
- Oksonium- ja hydroksidi-ioneita yhtä paljon tai ei ollenkaan
- Neutraali liuotin yksinään
Ⓔ vesi - Suolaliuos, jossa ei ole happoa tai emästä
Ⓔ vesi ja natriumkloridi
Emäksinen liuos
- pH noin 8-9 lievästi emäksinen, 10-14 vahvasti emäksinen
- Sisältää hydroksidi-ioneita OH−
- Emäksinen liuos koostuu emäksestä ja vedestä
- Emäs on aine, joka voi vastaanottaa vesiliuoksessa vetyionin H+
Ⓔ natriumhydroksidi liukenee veteen ioneina
NaOH → Na+ + OH− - Emäs siis aiheuttaa vedessä hydroksidi-ionin (joka kykenee vastaanottamaan vetyionin)
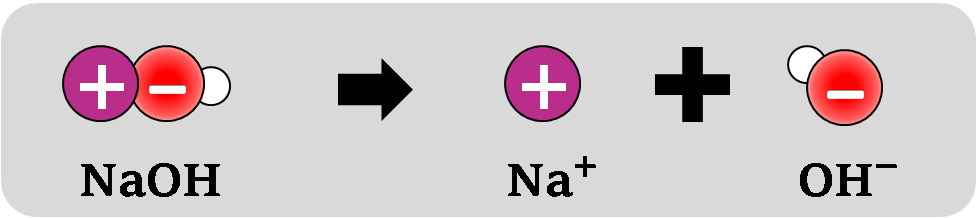
Kuva: Natriumhydroksidi on metallin (Na+) ja epämetallin (OH−) muodostama ioniyhdiste. Vesiliuoksessa ionit vapautuvat toisistaan. Emäksisen liuoksen tunnistaa hydroksidi-ioneista (OH−).
Oppimistavoitteena happamuuden tunnistaminen
- Liuoksen sisältämien aineiden perusteella
Opettele tunnistamaan suolahappo ja natriumhydroksidi (vaaditaan kaikilta)
Opettele muut yleisimmät hapot ja emäkset (hyvä osaaminen)
Opettele niiden kemialliset kaavat ja reaktiot (kiitettävä osaaminen) - Pallomallien avulla
Opettele tunnistamaan liuoksesta oksonium- ja hydroksidi-ionit (vaaditaan kaikilta)
-Alla oleva kuvasarja - pH-arvon avulla
Opettele asteikko, muista neutraali 7. (vaaditaan kaikilta) - Kokeellisesti oppitunnilla (työtapoja kysytään myös kokeessa)
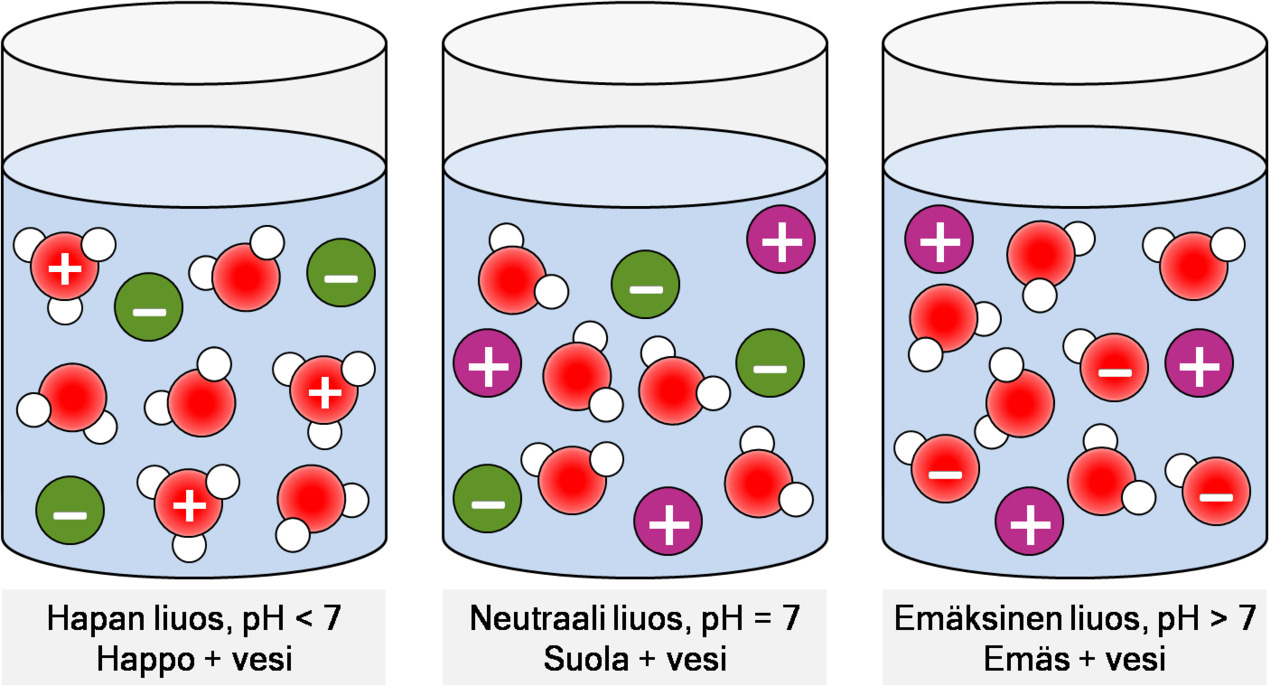
Kuva: Liuosten pallomallit. Vasemmalla hapan liuos (tunnistaa oksoniumioneista), keskellä jokin suolaliuos (ei happamuutta eikä emäksisyyttä), oikealla emäksinen liuos (tunnistaa hydroksidi-ioneista.
Happamuutta tutkitaan
- pH-paperilla
- indikaattoriliuoksella
Ⓔ BTS, lakmus, fenoliftaleiini, mustikkamehu, punakaali - pH-mittarilla
- titraamalla (selitys myöhemmin)
- Keittiöelintarvikkeiden happamuuden voi myös maistaa
- Kun siirrytään yksi askel kauemmas neutraalista, (7) happamuus/emäksisyys kymmenkertaistuu
Ⓔ pH 5 on 10 kertaa happamampi kuin pH 6
Ⓔ pH 10 on 100 kertaa emäksisempi kuin pH 8

Kuva: Mustikkamehun väri happamassa (punainen), neutraalissa (violetti) ja emäksisessä liuoksessa (vihreä). Mustikan väriaine - antosyaniini on oivallinen luonnonindikaattori. Huomaa pallomallit - vesimolekyylit sekä happamuudesta viestivä oksoniumioni ja emäksisyydestä viestivä hydroksidi-ioni.
Tärkeitä emäksiä ja happoja - muistiinpanot
Laimennus
- Happaman tai emäksisen liuoksen vahvuus riippuu pitoisuudesta eli väkevyydestä.
- Väkevä happoliuos on happamampi kuin laimea.
- Suolahappoliuos on happamampi kuin sitruunahappoliuos
- Hyvin happaman tai emäksisen liuoksen laimentaminen tuottaa niin paljon lämpöä, että liuos voi kiehua.
- Siksi astiassa pitää olla ensin riittävästi vettä, sitten lisätään happoa (tai emästä) vähitellen.
Sanotaan: "Ensin vesi, sitten happo. Muuten tulee käteen rakko."
Vahvat hapot ja vahvat emäkset (myöhemmin tarkemmin)
- Yleensä syövyttäviä ja siten vaarallisia
- Teollisuus- tai laboratoriokemikaaleja
Heikot hapot ja heikot emäkset (myöhemmin tarkemmin)
- Näistäkin osa on syövyttäviä mutta kuitenkin vähemmän vaarallisia
- Osa on tavallisia keittiötarvikkeita tai elintarvikkeiden ainesosia
Jaetaan moniste, jossa luetellaan tärkeimmät hapot ja emäkset.
Neutraloituminen
Periaate
- Kemiallinen reaktio
- Hapon ja emäksen välinen
- Reaktiotuotteena on aina vettä ja jotakin suolaa
- Neutraali lopputulos vaatii lähtöaineiden erityisen tarkkaa annostelua!
- Kutsutaan silloin titraamiseksi - varsinkin jos aineiden määrää mitataan
- Reaktion periaate: H3O+ + OH− → 2 H2O
oksoniumioni + hydroksidi-ioni → kaksi vesimolekyyliä - Happamuus häviää ja emäksisyys häviää
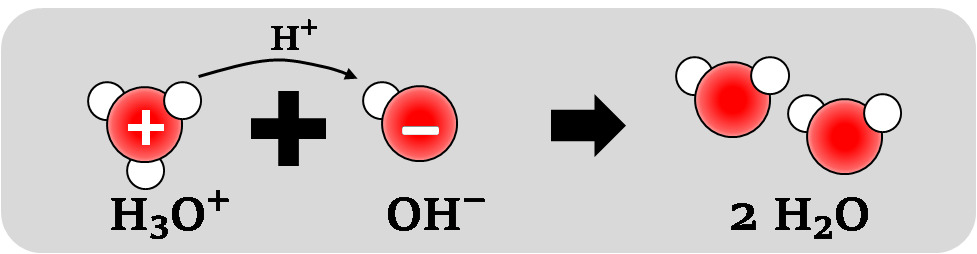
Kuva: Happaman ja emäksisen liuoksen sekoittuessa muodostuu vettä, kun oksonium- ja hydroksidi-ionit reagoivat keskenään.
Esimerkkejä
Salmiakkisuolan muodostuminen:suolahappo + ammoniakki → ammoniumkloridi (salmiakki)
HCl + NH3 → NH4Cl
Tarkemmin, kun huomioidaan hapon ja emäksen vesiliuokset:
Cl− + H3O+ + NH4+ + OH− → NH4Cl + 2 H2O

Kuva: Kerrataan suolahapon liukeneminen veteen. Happo luovuttaa vetyionin, jolloin muodostuu oksoniumioni H3O+.
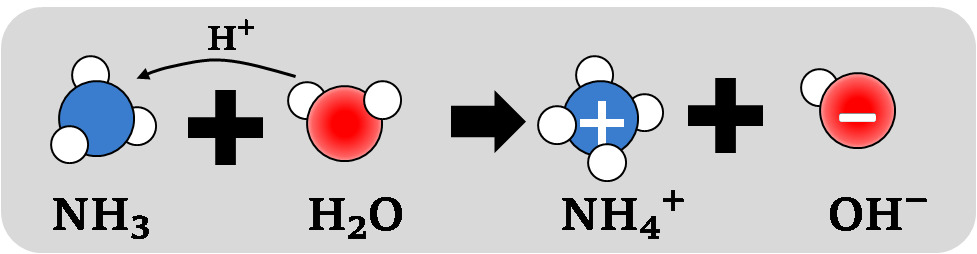
Kuva: Ammoniakin liukeneminen veteen. Emäs vastaanottaa vetyionin, jolloin muodostuu hydroksidi-ioni OH−.
.

Kuva: Sekoitetaan liuokset. Muodostuu suolaa (ammoniumkloridi) ja vettä. Jos vesi haihdutetaan, saadaan kiinteä salmiakkisuola erottumaan haihdutusmaljan pohjalle.
Ruokasuolan muodostuminen:
suolahappo + natriumhydroksidi → natriumkloridi + vesi
HCl + NaOH → NaCl + H2O
Katso alla oleva kuva
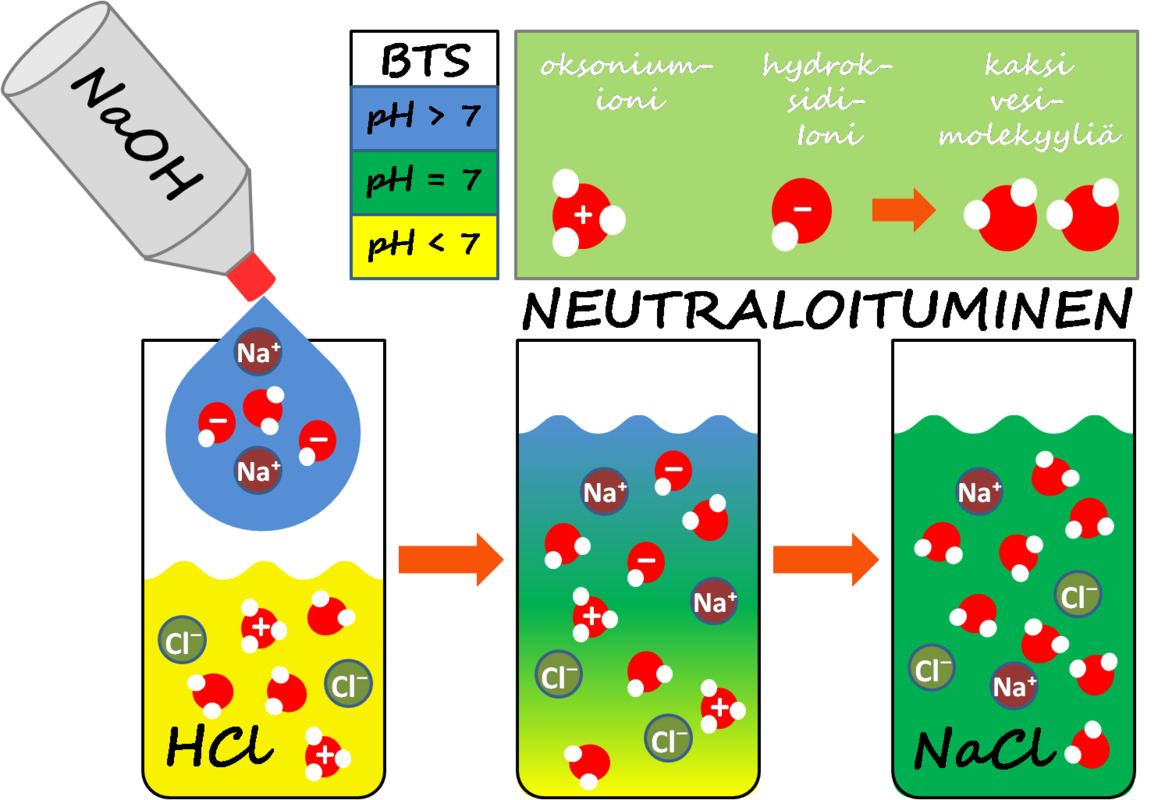
Kuva: Neutraloitumisreaktion periaate, jossa oksoniumioni ja hydroksidi-ioni muodostavat kaksi vesimolekyyliä. Alaosassa sarjakuva, joka esittää suolahapon neutraloimista natriumhydroksidilla. Neutraali lopputulos osoitetaan BTS-indikaattoriliuoksen värin avulla.
Neutraloitumisreaktio käytännössä
- Siivouksessa
- Hapan lika irtoaa emäksisellä pesuaineella
- Emäksinen lika (kalkki) irtoaa happamalla pesuaineella (etikka)
- Vatsan närästykseen
- Liikahappoisuus neutraloituu kun otetaan kalsiumkarbonaattia CaCO3 (emäs)
Miten tehdään vahva happo tai emäs vaarattomaksi?
- Laimentamalla - alennetaan pitoisuutta veden avulla
- Kaadetaan liuos varovaisesti selvästi suurempaan määrään vettä
- Hävitettäessä lisätään vielä runsaasti vettä
- Vaatii hyvin paljon vettä!
- Neutraloimalla
- Väkevät aineet tulee laimentaa ennen neutralointia
- Lisätään
- happamaan liuokseen emästä tai
- emäksiseen liuokseen happoa
- Seuraa pH-arvoa, jotta saat neutraalia
- Vaatii huolellisuutta ja harkintaa!
- Huom: Molemmissa menetelmissä on kiehumisvaara.
- Huom: Jos aine on lisäksi myrkyllinen ja sitä on runsaasti, se pitää toimittaa ongelmajätteen keräykseen.
Puskuriliuos
Puskuriliuos
- Seos heikkoa happoa, heikkoa emästä ja vettä
- Varsinainen määritelmä:
- Heikon hapon ja sen suolan seos tai
- Heikon emäksen ja sen suolan seos
- Vastustaa tiettyyn rajaan asti pH-arvon muutoksia, jos lisätään happoa tai emästä.
- Perustuu neutraloitumisreaktioon
- Puskuriliuoksen ionivarasto on valmiina reagoimaan tarvittaessa
- On tärkeä suojamekanismi eliöissä ja ekosysteemeissä
- Yleensä puskuriliuoksen pH on aika lähellä neutraalia
- Esimerkkejä: sylki, veri
Vahva ja heikko happo
- Vahva happo ionisoituu vesiliuoksessa käytännössä täydellisesti
- Silloin oksoniumioneita muodostuu yhtä paljon, kuin veteen joutui happomolekyylejä
- Kahdesta yhtä väkevästä happoliuoksesta happamampi on se, jossa on vahvempi happo
Ⓔ Suolahappo on vahva happo
Ⓔ Divetysulfidi on heikko happo (joskin myrkyllinen ja haiseva rikkivety) - Tasapainoreaktio
- Heikon hapon reaktio veden kanssa on tasapainoreaktio (lisätietoa).
- Happomolekyylejä hiljalleen hajoaa ja muodostuu yhtä suurella reaktionopeudella.
- Katso alla olevan kuvan oikean puoleinen malli.

Kuva: Vahvan hapon ja heikon hapon ero. Vahva happo (vasemmalla) ionisoituu vedessä täydellisesti. Heikko happo (oikealla) ionisoituu vain osittain. Liuosten pitoisuus on yhtä suuri mutta vahvan hapon liuos on paljon happamampi.
Vahva ja heikko emäs
- Kuten hapoilla - vahva emäs ionisoituu vedessä täysin
- Hydroksidi-ioneita muodostuu yhtä monta kuin veteen joutuneita emäksiä
- Kahdesta yhtä väkevästä emäsliuoksesta emäksisempi on se, jossa on vahvempi emäs
Ⓔ Natriumhydroksidi on vahva emäs
Ⓔ Ammoniakki on heikko emäs (ei kuitenkaan niin heikko, että olisi vaaraton!)
Oksidin liukeneminen veteen - muistiinpanot
Metalli + happi → metallioksidi
metallioksidi + vesi → emäksinen liuos
Ⓔ Magnesiumin palaminen
TYÖ1: magnesiumin polttaminen ja pudotus BTS-liuokseen
- Magnesium + happi → magnesiumoksidi
Mg + O2 → 2 MgO - magnesiumoksidi + vesi → magnesiumhydroksidi
MgO + H2O → Mg(OH)2 - magnesiumhydroksidi liukenee veteen ioneina
Mg(OH)2 → Mg2+ + 2 OH–
Epämetalli + happi → epämetallioksidi
epämetallioksidi + vesi → hapan liuos
Ⓔ Hiilen palaminen
TYÖ2: puhaltaminen keuhkoista BTS:n liuokseen
- hiili + happi → hiilidioksidi
C + O2 → CO2 - hiilidioksidi + vesi → hiilihappo
CO2 + H2O → H2CO3 - hiilihappo + vesi → karbonaatti-ioni + oksoniumioni
H2CO3 + H2O → HCO3– + H3O+
Vaikutuksia
- Valtamerien happamoituminen - hiili
- Johtuu hiilidioksiditason noususta maapallolla. Sitä vapautuu, kun poltetaan eloperäisiä fossiilisia polttoaineita kuten bensiiniä ja kivihiiltä.
- Vaikutus maapallon laajuinen
- Hiilidioksidia liukenee vesistöön ja muodotaa hiilihappoa
- Kehityksen suunta on haastava
- DEMO: auton pakokaasut
- Happamat sateet - rikki
- Johtuvat vanhanaikaisen teollisuuden rikkipäästöistä
- Vaikutus alueellinen
- Rikin oksidit liukenevat tiivistyviin vesipisaroihin
- Päästöjä on opittu hallitsemaan
- DEMO: hapan sade
- Emäksinen tuhka - kalium, kalsium ym.
- Jää takkaan, kun puut ovat palaneet
- Hiilidioksidi on kaasua ja poistuu savupiipusta
- Hivenaineiden oksidit ovat kiinteitä ja jäävät tuhkaan
- Tuhka on niin emäksistä, että kostutettuna sillä voi puhdistaa uunin luukun lasin.
- VIDEO: Uuninluukun puhdistus luontaisesti
Vertaa: K2r käyttöturvallisuustiedote
Ilmakehän kaasut
Tämä kappale ei tule mukaan happokokeeseen.
Alla on muutamia avainkohtia, joihin on hyvä tilaisuuden tullen perehtyä.
Ilmakehän koostumus
Hiilen kierto
Fossiilit polttoaineena
Hiilidioksidipitoisuuden kehitys ja vaikutukset
- Merten happamoituminen
- Kasvihuoneilmiön voimistuminen
- Ilmastolliset haasteet ja luontokato
Hiilidioksidipäästöjä on tärkeää leikata
Yksilön toiminta on "vain pisara meressä" mutta silti pisarat muodostavat meren. Jokainen meistä voi pohtia, minkälainen pisara itse voisi olla ja miten muitakin kannustaa etsimään tietoa, ajattelemaan ja tekemään.
National Atmospheric and Oceanic Administration: Atmospheric Carbon Dioxide