Neutraloituminen
Periaate
- Kemiallinen reaktio
- Hapon ja emäksen välinen
- Reaktiotuotteena on aina vettä ja jotakin suolaa
- Neutraali lopputulos vaatii lähtöaineiden erityisen tarkkaa annostelua!
- Kutsutaan silloin titraamiseksi - varsinkin jos aineiden määrää mitataan
- Reaktion periaate: H3O+ + OH− → 2 H2O
oksoniumioni + hydroksidi-ioni → kaksi vesimolekyyliä - Happamuus häviää ja emäksisyys häviää
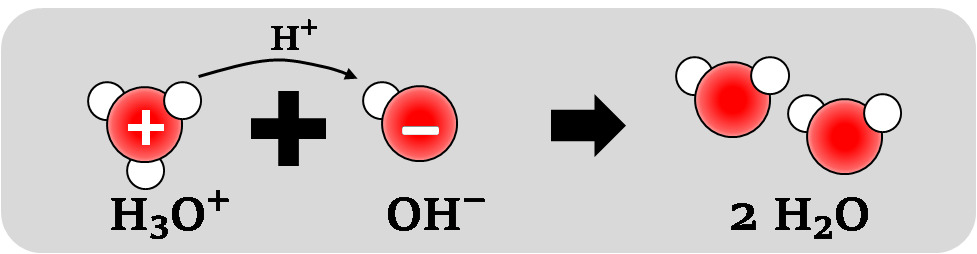
Kuva: Happaman ja emäksisen liuoksen sekoittuessa muodostuu vettä, kun oksonium- ja hydroksidi-ionit reagoivat keskenään.
Esimerkkejä
Salmiakkisuolan muodostuminen:suolahappo + ammoniakki → ammoniumkloridi (salmiakki)
HCl + NH3 → NH4Cl
Tarkemmin, kun huomioidaan hapon ja emäksen vesiliuokset:
Cl− + H3O+ + NH4+ + OH− → NH4Cl + 2 H2O

Kuva: Kerrataan suolahapon liukeneminen veteen. Happo luovuttaa vetyionin, jolloin muodostuu oksoniumioni H3O+.
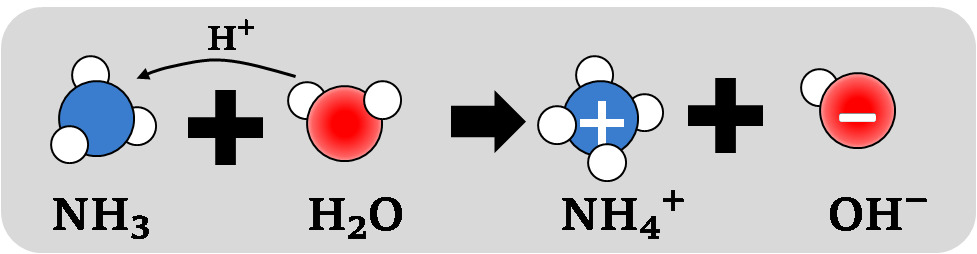
Kuva: Ammoniakin liukeneminen veteen. Emäs vastaanottaa vetyionin, jolloin muodostuu hydroksidi-ioni OH−.
.

Kuva: Sekoitetaan liuokset. Muodostuu suolaa (ammoniumkloridi) ja vettä. Jos vesi haihdutetaan, saadaan kiinteä salmiakkisuola erottumaan haihdutusmaljan pohjalle.
Ruokasuolan muodostuminen:
suolahappo + natriumhydroksidi → natriumkloridi + vesi
HCl + NaOH → NaCl + H2O
Katso alla oleva kuva
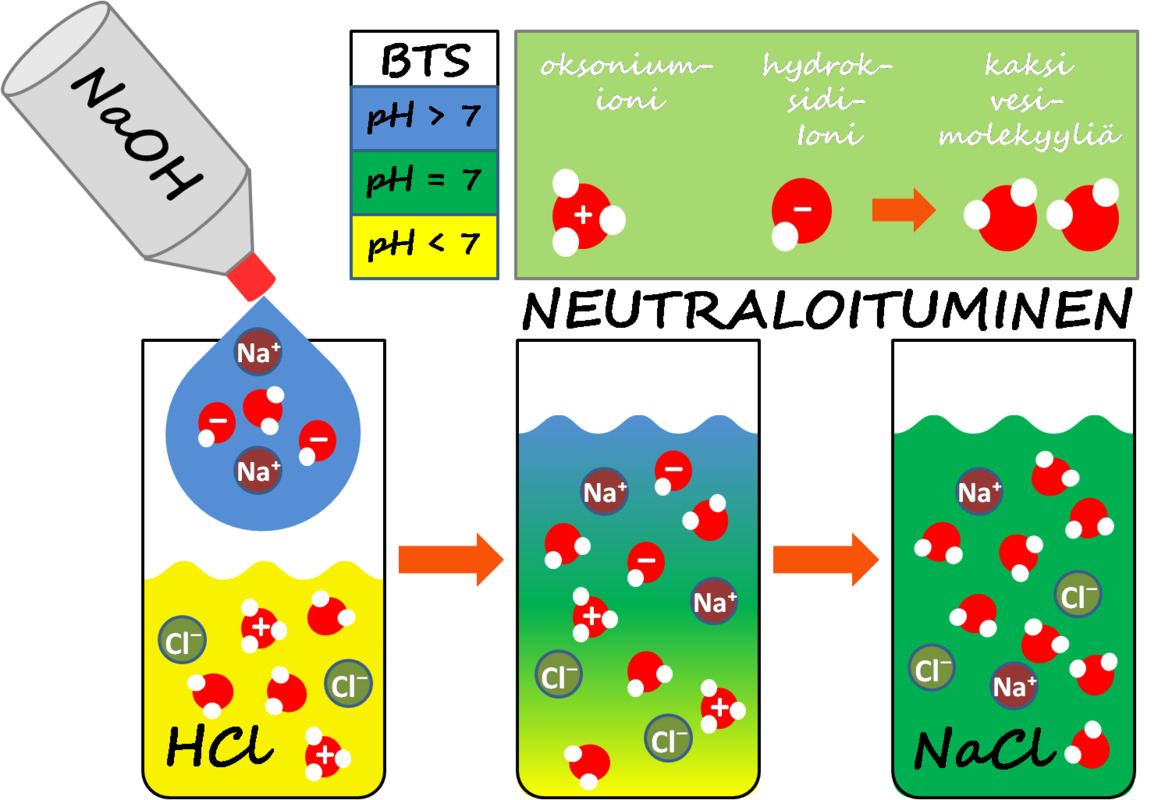
Kuva: Neutraloitumisreaktion periaate, jossa oksoniumioni ja hydroksidi-ioni muodostavat kaksi vesimolekyyliä. Alaosassa sarjakuva, joka esittää suolahapon neutraloimista natriumhydroksidilla. Neutraali lopputulos osoitetaan BTS-indikaattoriliuoksen värin avulla.
Neutraloitumisreaktio käytännössä
- Siivouksessa
- Hapan lika irtoaa emäksisellä pesuaineella
- Emäksinen lika (kalkki) irtoaa happamalla pesuaineella (etikka)
- Vatsan närästykseen
- Liikahappoisuus neutraloituu kun otetaan kalsiumkarbonaattia CaCO3 (emäs)
Miten tehdään vahva happo tai emäs vaarattomaksi?
- Laimentamalla - alennetaan pitoisuutta veden avulla
- Kaadetaan liuos varovaisesti selvästi suurempaan määrään vettä
- Hävitettäessä lisätään vielä runsaasti vettä
- Vaatii hyvin paljon vettä!
- Neutraloimalla
- Väkevät aineet tulee laimentaa ennen neutralointia
- Lisätään
- happamaan liuokseen emästä tai
- emäksiseen liuokseen happoa
- Seuraa pH-arvoa, jotta saat neutraalia
- Vaatii huolellisuutta ja harkintaa!
- Huom: Molemmissa menetelmissä on kiehumisvaara.
- Huom: Jos aine on lisäksi myrkyllinen ja sitä on runsaasti, se pitää toimittaa ongelmajätteen keräykseen.