Happamuus ja emäksisyys - muistiinpanot
Hapan liuos
- pH noin 0...4 vahvasti hapan, 5...6 lievästi hapan
- Sisältää oksoniumioneita H3O+
- Hapan liuos koostuu haposta ja vedestä
- Happo on aine, joka voi luovuttaa vesiliuoksessa vetyionin H+
Ⓔ suolahappo eli vetykloridi ja vesi
HCl + H2O → Cl− + H3O+
suolahappo + vesi → kloridi-ioni + oksoniumioni - Happo siis aiheuttaa vedessä oksoniumionin

Kuva: Suolahappo liukenee veteen ioneina. Koska vetyioni ei esiinny yksinään, vesimolekyyli ottaa sen kantaakseen ja muuttuu oksoniumioniksi. Happaman liuoksen tunnistaa oksoniumioneista (H3O+).
Neutraali liuos
- pH 7
- Oksonium- ja hydroksidi-ioneita yhtä paljon tai ei ollenkaan
- Neutraali liuotin yksinään
Ⓔ vesi - Suolaliuos, jossa ei ole happoa tai emästä
Ⓔ vesi ja natriumkloridi
Emäksinen liuos
- pH noin 8-9 lievästi emäksinen, 10-14 vahvasti emäksinen
- Sisältää hydroksidi-ioneita OH−
- Emäksinen liuos koostuu emäksestä ja vedestä
- Emäs on aine, joka voi vastaanottaa vesiliuoksessa vetyionin H+
Ⓔ natriumhydroksidi liukenee veteen ioneina
NaOH → Na+ + OH− - Emäs siis aiheuttaa vedessä hydroksidi-ionin (joka kykenee vastaanottamaan vetyionin)
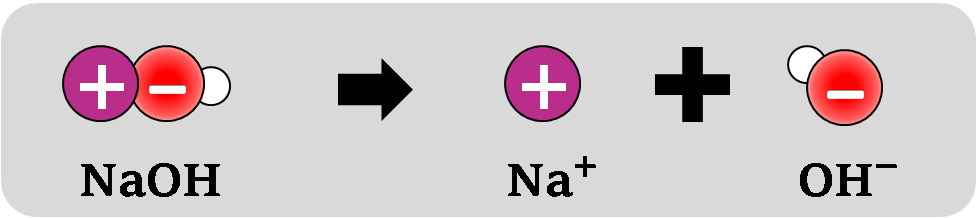
Kuva: Natriumhydroksidi on metallin (Na+) ja epämetallin (OH−) muodostama ioniyhdiste. Vesiliuoksessa ionit vapautuvat toisistaan. Emäksisen liuoksen tunnistaa hydroksidi-ioneista (OH−).
Oppimistavoitteena happamuuden tunnistaminen
- Liuoksen sisältämien aineiden perusteella
Opettele tunnistamaan suolahappo ja natriumhydroksidi (vaaditaan kaikilta)
Opettele muut yleisimmät hapot ja emäkset (hyvä osaaminen)
Opettele niiden kemialliset kaavat ja reaktiot (kiitettävä osaaminen) - Pallomallien avulla
Opettele tunnistamaan liuoksesta oksonium- ja hydroksidi-ionit (vaaditaan kaikilta)
-Alla oleva kuvasarja - pH-arvon avulla
Opettele asteikko, muista neutraali 7. (vaaditaan kaikilta) - Kokeellisesti oppitunnilla (työtapoja kysytään myös kokeessa)
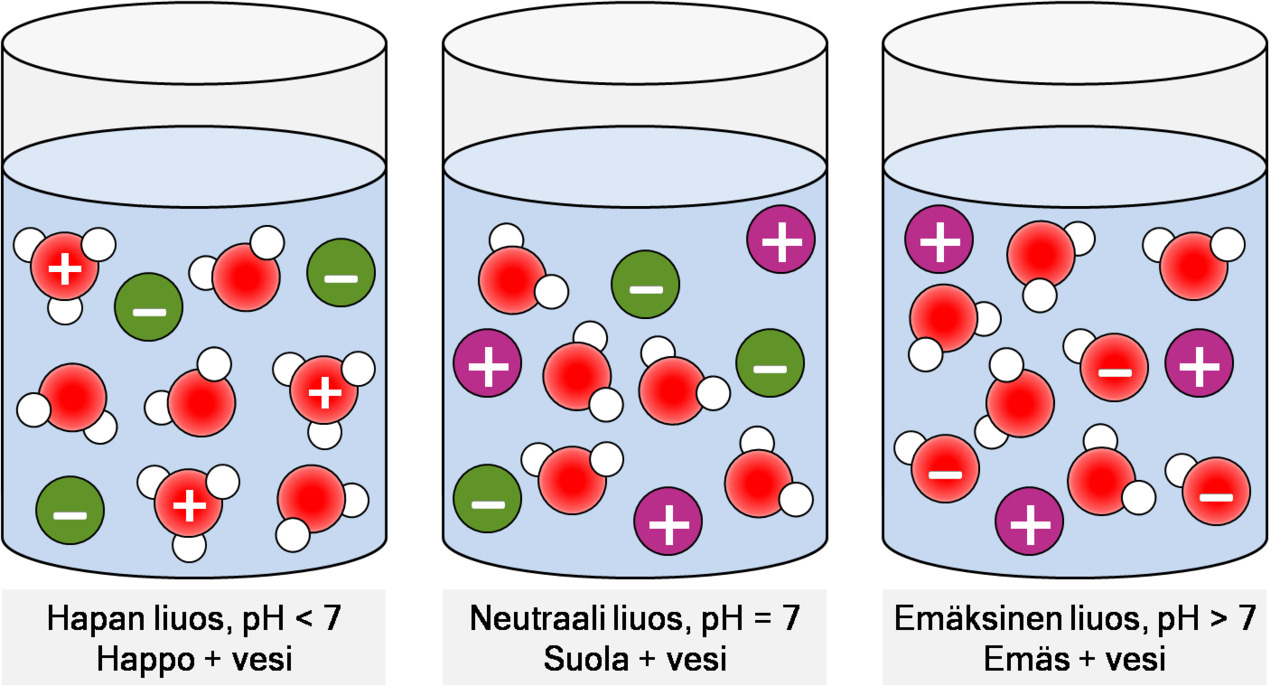
Kuva: Liuosten pallomallit. Vasemmalla hapan liuos (tunnistaa oksoniumioneista), keskellä jokin suolaliuos (ei happamuutta eikä emäksisyyttä), oikealla emäksinen liuos (tunnistaa hydroksidi-ioneista.
Happamuutta tutkitaan
- pH-paperilla
- indikaattoriliuoksella
Ⓔ BTS, lakmus, fenoliftaleiini, mustikkamehu, punakaali - pH-mittarilla
- titraamalla (selitys myöhemmin)
- Keittiöelintarvikkeiden happamuuden voi myös maistaa
- Kun siirrytään yksi askel kauemmas neutraalista, (7) happamuus/emäksisyys kymmenkertaistuu
Ⓔ pH 5 on 10 kertaa happamampi kuin pH 6
Ⓔ pH 10 on 100 kertaa emäksisempi kuin pH 8

Kuva: Mustikkamehun väri happamassa (punainen), neutraalissa (violetti) ja emäksisessä liuoksessa (vihreä). Mustikan väriaine - antosyaniini on oivallinen luonnonindikaattori. Huomaa pallomallit - vesimolekyylit sekä happamuudesta viestivä oksoniumioni ja emäksisyydestä viestivä hydroksidi-ioni.