7 Aineet ja mallintaminen
Ensimmäinen kemian koe - 2025 syksy alustavasti
Koealue: Kpl 1-5 ja syventävä osuus (s. 6-33)
tämän sivun muistiinpanot
Kappale 5 saattaa tulla kokeeseen aika supistetusti. Vesimolekyyli pitää silti aina tunnistaa.
Alkuainemuistipelin tulosteet
Johdatus kemiaan - muistiinpanot
Mitä kemia on
Kokeellinen luonnontiede, joka tutkii- ainetta ja sen ominaisuuksia sekä rakennetta
- aineiden välisiä reaktiota
Kemian hahmottaminen
- Havainnot: mittaukset ja muistiinpanot
- Mallit: molekyylimallit, kemialliset kaavat ja reaktioyhtälöt
- Taulukot ja hakuteokset: aineiden ominaisuudet
- Suureet
Suure on aineen ominaisuus, joka voidaan mitata
Sillä on nimi, tunnus ja yksikkö
Ⓔ massa, m, 1 kg
Ⓔ lämpötila, T, 1 °C
Hiusten likaisuus ei ole suure, koska sille emme keksi mitattavaa yksikköä.
Tieteellinen menetelmä (luonnontieteellinen tutkimus)
Tavoitteena on selittää ilmiöitä, keinoina havaintoja ja teoriaa sopivassa suhteessa.
Tieteellinen tutkimus etenee suunnilleen näin
- Tehdään havaintoja ja tunnistetaan ilmiöitä
- Kehitetään "ennustus" (hypoteesi) selityksestä ilmiölle
- Testataan kokeellisesti, pitääkö ennustus eli hypoteesi paikkansa
- Jos ennustus ei toimi, tehdään uusi hypoteesi ja tutkitaan lisää
- Onnistunut ennustus voi johtaa uuteen vahvistettuun teoriaan
Hypoteeseja ja teoriaa hahmotellaan mallien eli yksinkertaistusten avulla.
Periaatteita:
- Kokeet ovat mahdollisimman pelkistettyjä ja toistettavia
- Tutkijan vaikutus tuloksiin pyritään minimoimaan
- Muut tutkijat varmistavat, että tulokset ovat luotettavia ja teoria toimii
- Jos hypoteesi tai teoria osoittautuu vääräksi, sitä tutkitaan uudelleen ja korjataan
Missä kemiaa tarvitaan
Lääketieteessä, siivouksessa, teollisuudessa, kierrätyksessä, ympäristöteknologiassa, maataloudessa, ruoanvalmistuksessaKemian työvälineet
- Lasiset: keitinlasi, keittopullo, mittalasi, koeputki, lasisauva, petrimalja, kellolasi
- Keraamiset: haihdutusmalja, upokas, huhmare
- Muoviset: kennolevy, pipetti, suppilo
- Metalliset: upokaspihdit, koeputkiteline
- Puiset: koeputkipihdit
- Keittäminen: Kaasupoltin + kolmijalka + kuumennusverkko
- Kiinnitys: Statiivitanko + kaksoispuristin + koura

Kuva: Oppilaskaapin sisältö ja kuivatusteline.
Turvallinen työskentely kemian luokassa
Turvallisuusratkaisut: Sopivat laimennokset!, ensisammutin, hätäsuihku, hätäpoistumistie, sammutuspeite, vesihana, suojahanskat, ensiapukaappi, silmähuuhde, vetokaappi, suojatakki, suojalasit (käytä), varoitusmerkit (opettele), käyttöturvallisuustiedotteet (muista)

Juliste: Aineiden ja ilmiöiden tutkiminen kemian tunnilla on huolellista ja harkitsevaa ryhmätyötä. Nopeus ei ole tavoite - huolellisuus on. Maalissa odottavat tuntitehtävät. Niihin siirrytään omatoimisesti, kun tutkimus on valmis.
Työsäännöt:
- Kuuntele ja lue ohjeet
- Muista oikea lasikaappi
- Käytä suojalaseja (+ takki)
- Ota ja anna vastuuta ryhmässä
- Odota lupaa tulentekoon
- Keskity ja harkitse, kysy tarvittaessa
- Merkitse tulokset muistiin
- Siivoa ja tiskaa jälkesi
-Tarkista opettajalta jätteiden hävitys - Jatka oma-aloitteisesti tuntitehtäviin
- Kielletty: juominen ja syöminen, juoksu ja leikki, ohjeiden päälle puhuminen
Kaasupolttimen käyttö:
- Aseta tukevasti siistille pöydälle
- Kaasuhana ja ilma-aukko tässä vaiheessa kiinni
- Tarkista varovaisesti, että kaasuhanan saa auki
- Sytytä tulitikku ja vie se suuttimen yläpuolelle
- Avaa kaasuhanaa sopivasti, että syttyy kunnolla
- Avaa ilma-aukko, jotta liekki muuttuu siniseksi
Sininen liekki on kuuma eikä nokea niin pahasti - Jos liekki sammuu, käännä heti kaasuhana kiinni
- Varmista palauttaessa, että hana on kiinni
Varoitusmerkit
Opettele varoitusmerkit. Tunnista kotoasi kemikaalipakkauksia, joissa on joitakin näistä merkeistä. Pyydä apua huoltajaltasi. Kirjoita vihkoosi esimerkit kuhunkin merkkiin sopivasta aineesta tai tuotteesta.

Vaarallisten kemikaalien varoitusmerkit. Lähde: https://tukes.fi/luulotpoiskemikaaleista/mista-tietoa-kemikaaleista
Aineiden ominaisuudet - muistiinpanot
Iloisuus? Uteliaisuus? Hyvä ruokahalu? Tunnollisuus? Päättämättömyys? Pituus n. 180 cm? (tämä on myös suure)
Aineiden ominaisuuksia
| Fysiikaalinen | Kemiallinen |
|
väri |
haju maku happamuus liukoisuus reaktiivisuus |
OLOMUODOT ja olomuodonmuutokset
| KAASU | ||
| tiivistyminen ↓ | kp - kiehumispiste | ↑ höyrystyminen |
| NESTE | ||
| jähmettyminen ↓ | sp - sulamispiste | ↑ sulaminen |
| KIINTEÄ |
Kiehumispiste on aineelle ominainen lämpötila, jossa sen olomuoto muuttuu nesteestä kaasuksi (höyrystyminen) tai kaasusta nesteeksi (tiivistyminen).
Sulamispiste on aineelle ominainen lämpötila, jossa sen olomuoto muuttuu kiinteästä nesteeksi (sulaminen) tai nesteestä kiinteäksi (jähmettyminen).
Etsi kirjan taulukoista hopea, missä lämpötilassa se sulaa?
Kuinka kylmää pitää olla, että elohopea muuttuu kiinteäksi?
Mikä on etanolin olomuoto huoneen lämpötilassa?
Entä 90 °C lämpötilassa?
Esimerkkejä asioista ja esineistä. Mitä ainetta? Mitä ominaisuuksia aineella?
- Uima-altaan sisältö:
Vesi - juokseva kirkas neste (huoneen lämpötilassa), varsin mauton, ei ole hapan, johtaa jotenkin sähköä - Sahanterä:
Teräs - kiinteä metalli, sitkeän taipuisa, kiiltävä, lämpöä ja sähköä johtava, melko kova, korkea sulamispiste - Hengityskaasu:
Ilma - kaasuseos, väritön, hajuton, ei kovin reaktiivinen, matala kiehumispiste - Ruokasuola:
Natriumkloridi - kiinteä (huoneenlämpötilassa), kova, kiteinen, vaalea, hauras, korkea sulamispiste - Mehiläisten ravinto:
hunaja - huonosti juokseva sokeripitoinen neste (lämpötilasta riippuen), keltainen, makea
Mallit - muistiinpanot
Malli
- on yksinkertaistus jostakin asiasta
- auttaa oppimaan ja esittämään ilmiöitä itselleen ja muille
- helpottaa asioiden vertailua toisiinsa
- Ⓔ kartta, pohjapiirros, hätäpoistumistien merkki, jalkapallojoukkueen pelimuodostelma, malli veden kiertokulusta
Erityisesti: Malli suurustamisen kemiasta!
Kemian mallit (vihkoon lyhennetysti, keskity pallomalleihin)
- Atomien rakennemallit
- Alkuaineen kemiallinen merkki
Ⓔ vety H ja helium He - Yhdisteen tai alkuainemolekyylin kemiallinen kaava
Ⓔ vesi H2O, happi O2 , ruokasuola NaCl - Piirretyt pallomallit atomeille ja molekyyleille (kutsutaan joskus myös kalottimalleiksi)

- Muoviset pallotikkumallit (kuten rakennussarjamme)
- Rakennemallit, jotka selittävät miten kiinteä aine pysyy koossa
Ⓔ jää, metallit, suolat - Seosten pallomallit
Ⓔ Vesi, johon on liuennut happea ja klooria
Alkuaineet ja atomit - muistiinpanot
Alkuaine
- Alkuaineita on n. 90 kpl. Ⓔ happi ja titaani
- Jokaisella alkuaineella on oma kemiallinen merkki Ⓔ O ja Ti
(Merkissä on aina vain yksi iso kirjain) - Saman alkuaineen atomit ovat samanlaisia.
- Pienin määrä tiettyä alkuainetta on siis yksi alkuaineatomi.
- Jotkin alkuaineet koostuvat yleensä alkuainemolekyyleistä
Ⓔ tavallinen happikaasu O2 koostuu molekyyleistä, joissa on kaksi happiatomia
Ⓔ myrkyllinen O3 on otsonimolekyyli (osattava!)
1. Erä merkkejä opeteltavaksi - 8 tärkeintä
- H - vety, H
- He - helium
- O - happi
- C - hiili
- Mg - magnesium
- Fe - rauta
- Na - natrium
- Cl - kloori
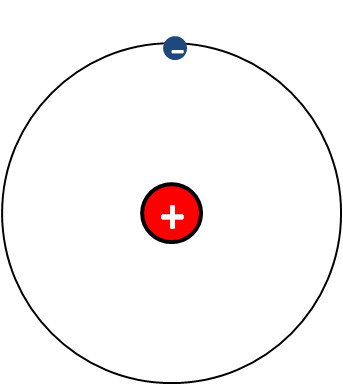
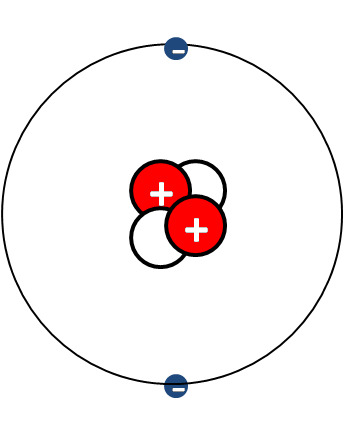
Atomin rakennemalli - mitä pallomalli jättää kertomatta atomista:
- Atomi koostuu ytimestä ja elektroniverhosta.
- Elektronit liikkuvat elektroniverhossa (kehä)
- Protonit sekä neutronit muodostavat atomin ytimen.
- Alkuaineella on järjestysnumero, jonka määrää protonien lukumäärä
- Kevyin alkuaine on 1. vety ja yksi raskaimmista 92. uraani
- Atomilla on yhtä monta protonia ja elektronia.
- Atomi on sähköisesti neutraali.
Yhdisteet - muistiinpanot
Lisäksi: Tätä muistiinpanoa kirjoitettaessa voidaan käsitellä muovisia pallotikkumalleja.
- Erilaisia alkuaineista muodostuvia yhdisteitä voi olla miljoonia
- Yhdisteessä on vähintään kahta eri alkuainetta
- Atomit ovat kemiallisesti sitoutuneita toisiinsa
- Saman yhdisteen pienimmät rakenneosat ovat keskenään samanlaisia (molekyyli)
- Jos rikot molekyylin, aine ei ole enää sama
- Kemiallisesta kaavasta näkee erilaisten atomien lukumäärän
Ⓔ metaanimolekyyli CH4 sisältää yhden hiiliatomin C ja neljä vetyatomia H - Yhdisteen ominaisuudet ovat erilaiset kuin sen muodostaneiden alkuaineiden
Ⓔ vety H2 ja happi O2 ovat huoneen lämpötilassa kaasuja mutta niiden muodostama vesi H2O on nestettä
Vesi - muistiinpanot
Yhdiste
Vesimolekyyli muodostuu kahdesta vetyatomista ja yhdestä happiatomista
| Yleisnimi | Kemiallinen nimi | Kaava | Pallomalli |
| vesi | divetymonoksidi | H2O | 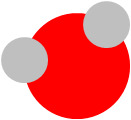 |
Ominaisuudet
- Hyvä liuotin - liuottaa sokeria, suolaa, happea ja ilmaa, etanolia, hieman metalleja ja kalkkia
ei kuitenkaan öljyä - Kiehumispiste on 100 °C
haihtumalla höyrystymistä tapahtuu alhaisemmassakin lämpötilassa - Sulamispiste on 0 °C
- Huoneenlämpötilassa vesi on neste
- Vedellä on suuri lämmönvarauskyky
- Suuri pintajännitys - puun lehti tai vesimittari jää veden päälle, eikä uppoa ollenkaan
- Taittaa valoa - valon suunta muuttuu veden pinnan läpi kulkiessa
- Heijastaa valoa - kun aurinko on matalalla (valon tulokulma on suuri)
- Vedellä toimii kapillaari-ilmiö - Vesi nousee kapeisiin putkiin ja huokoiseen ainekseen. Jos tiskirätti koskettaa veteen, se kastuu hitaasti kokonaan.
- +4 °C vesi on tiheintä ja siksi pohjalla. Talven tullen pinnalla on siis kylmempää!
Kapillaari-ilmiö
 |
Vesi nousee kapillaarisesti sitä korkeammalle, mitä ohuempi pilli on |
Veden puhdistus - extraa
Juomavesi
- Hanasta saatavaa juomavettä tuotetaan pohjavedestä (lähde) tai pintavedestä (järvet)
- Veden puhdistukseen käytetään useita erotusmenetelmiä
- Suodatus, kemiallinen puhdistus
- Hyvä juomavesi ei juuri haise tai maistu eikä siinä saa kasvaa haitallisia mikrobeja
- Veden pH:ta säädetään, jotta putkistot eivät ruostuisi
Jätevesi
- Viemäriin kaadettu vesi puhdistetaan ennen laskemista luonnonvesiin
- Vedestä poistetaan kiintoainesta selkeytysaltaissa
- Lisäksi vedestä pyritään sitomaan ravinteita, koska niillä on rehevöittävä vaikutus vesistöihin