8 Välipalavety
Hei
Toivottavasti kokeesi jaksollisesta järjestelmästä ja sidoksista sujui hyvin!
Mahdoitko ihmetellä, että vetyioneista ei ollut lainkaan puhetta, vaikka melkein kaikkien muistamiesi alkuaineiden ioneita tarkasteltiin. Vetyatomin osaat varmaankin piirtää mutta vetyioni vaatii vähän sulattelua.
Vetyioni on pelkkä vety-ydin
Vety H on alkuaine järjestysnumeroltaan 1. Se koostuu yhden protonin muodostamasta ytimestä ja yhden elektronin kansoittamasta elektroniverhosta. Elektroniverhossaan sillä on 1. jakson alkuaineena yksi elektronikuori.
| Vetyatomi H | Vetyioni H+ |
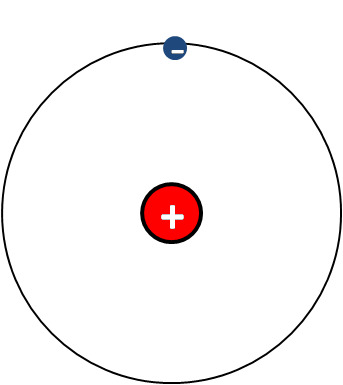 |
 |
1. pääryhmän alkuaineet eli alkalimetallit muodostavat ionin luovuttamalla yhden ulkoelektronin. Tällöin ne saavuttavat oktetin, koska jäljelle jäävistä kuorista uloimmalla on kahdeksan elektronia (litiumin tapauksessa kaksi). Vety kuuluu samaan ryhmään, koska silläkin on tasan yksi ulkoelektroni ja ionisoituessaan vety luovuttaa sen pois.
Kuten alkalimetallit, myös vety luovuttaessaan elektronin menettää uloimman elektronikuoren. Se on vedyn ainoa kuori, joten vetyionille ei jää yhtäkään elektronia eikä elektronikuorta. Vetyioni on siis pelkkä vety-ydin, jolla ei ole niin sanottua elektroniverhoa lainkaan. Koska vedyn ytimessä on tavallisesti vain yksi protoni, vetyionia kutsutaan myös protoniksi.
Vetyatomin ionisoituminen luovuttamalla elektroni:
H → H+ + e−
Tulevaa
Happojen ja emästen reaktiot perustuvat vetyionin luovuttamiseen tai vastaanottamiseen. Nämä reaktiot ovat aivan erityisiä juuri siksi, että vetyioni on niin kovin pieni. Vetyionina oleminen on niin outoa, että semmoinen ei juurikaan liikuskele itsekseen. Hapot ja emäkset käyvät silti vetyionilla kauppaa jatkuvasti. Siihen tarvitaan väliaineeksi vettä ja liukoisten happojen ja emästen lähikohtaamisia.
Myös metallikemian tutkimukset liittyvät vetyyn. Kun vaikkapa sormukselle tehdään happotesti upottamalla sen suolahappoon koru altistuu vetyioneille. Jos metalli ei ole riittävän jaloa, suolahapon HCl tarjoamat vetyionit aiheuttavat metallin syöpymisen.
Vedyn isotoopit
Atomit voidaan tunnistaa tietyiksi alkuaineiksi järjestysnumeronsa eli protonien lukumäärän perusteella. Samalla alkuaineella voi kuitenkin olla useampia eri isotooppeja eli sellaisia muotoja, joilla neutronien lukumäärä vaihtelee.
Vetyä on kolmea lajia
- Tavallinen vety eli protium - protoni
- Deuterium - protoni ja neutroni
- Tritium - protoni ja kaksi neutronia
Ydinfysiikkaa vedyllä
Yhdistetään kaksi deuteriumia ja saadaan yksi helium. Tarkista vaikka: deuteriumilla on yksi protoni ja yksi neutroni, heliumatomilla (järjestysnumero 2) on kaksi protonia ja kaksi neutronia. Tavallisista vedyistä ei kerralla saa kunnollista heliumatomia.
Jos aiot perustaa fuusiovoimalan tai auringon, tarvitset siis melkoiset määrät deuteriumia. Tällä tosiaan tarkoitetaan kemiallisesti ihan samanlaista vetyä kuin muukin vety. Deuteriumia esiintyy tavallisen vedyn tapaan vetymolekyyleissä tai vaikkapa vesimolekyyleissä. Lisätietoa voit hakusanalla raskas vesi.
Muistathan kuitenkin, että kemiassa atomit muodostavat yhdisteitä eivätkä uusia alkuaineita. Kemialliset reaktiot perustuvat atomin uloimpiin elektroneihin. Ydinreaktiot kuuluvat ydinfysiikkaan.
Vety ja atomi
Mitä yhteistä on vedyllä ja atomilla?
Tähän on suomalaisittain ainakin kaksi erinomaisen hyvää vastausta
Vihje 1: Lappeenranta
Vihje 2: Ruokakulttuuria vastakulttuurina isompien uhkailulle
Vihje 3: Japanin ja USA:n välisen sodan päättyminen
Vetytalous
Maailman energiakriisiä ratkaistaan uusiutuvilla energialähteillä kuten tuulella ja auringolla. Aina ei kuitenkaan tuule ja paista mutta sähköä ja muuta energiaa tarvitaan säännöllisesti. Sähkön varastointi vaatii niin paljon akkuja, että niiden raaka-aineet eivät riitä. Siksi vedystä toivotaan ratkaisua varastointiin. Kun sähköä tuotetaan ylimäärin, sen avulla voidaan erottaa vetyä esimerkiksi vedestä, vesimolekyyleistä, ja varastoida kunnes sähköä taas tarvitaan. Vedyn avulla voidaan myös valmistaa bensiinin kaltaisia polttoaineita synteettisesti. Video HS Visio, youtube n. 10 minuuttia.
Linkkejä