8 Metallien kemia
Johdanto
Mitä on luvassa
Metallien kemia on suurelta osin sähkökemiaa.
Johdattelukappale 21 on opiskeltu jaksollisen järjestelmän ja sidosten yhteydessä.
Nyt opiskellaan kappaleet 22-25 sen mukaan, paljonko aikaa riittää
Kirjallinen testi
- kappaleista 22-23
- jakson viimeisellä viikolla joulun jälkeen
- painoarvo puolet kokeesta
- Kertaa nämä:
- jännitesarja
- hapettumispelkistymisreaktio
- sähkökemiallinen pari
- elektrolyysi
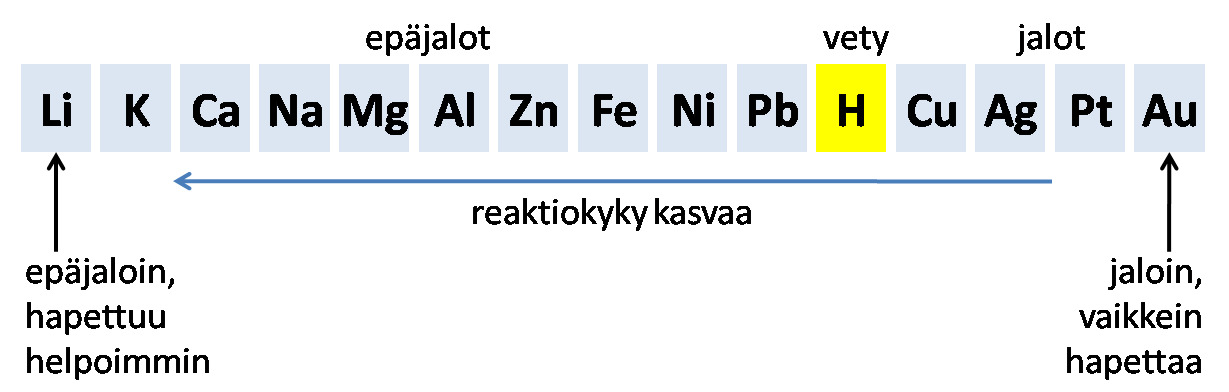
Jännitesarja
Metallien jännitesarja eli reaktiivisuussarja
- Metallien reaktiot ovat pohjimmiltaan sähkökemiallisia.
- Siksi reaktiivisuussarjaa kutsutaan jännitesarjaksi.
- Veden kanssa reagoivat metallit ovat epäjaloja metalleja
- Suolahappo nopeuttaa reaktiota
- Jalometallit eivät reagoi suolahapon luovuttaman vetyionin kanssa
- Silti esim kloori voi syövyttää jopa kultaa
- Jännitesarjassa metallit järjestetään reaktiivisuuden mukaan epäjaloimmasta jaloimpaan
- Vety (epämetalli) sijoitetaan epäjalojen ja jalojen metallien väliin
Hapettumisreaktio
Ⓔ Li → Li+ + e−
Ⓔ Mg → Mg2+ + 2e−
- Metalliatomit luovuttavat reaktioissa ulkoelektroneja ja ionisoituvat
- Tätä sanotaan hapettumiseksi
- Metallin rakenne katoaa ja se liukenee tai muodostaa jonkin yhdisteen
- Mitä epäjalompi metalli, sen helpommin se hapettuu
Pelkistymisreaktio
Ⓔ Li+ + e− → Li
Ⓔ Mg2+ + 2e− → Mg
- Pelkistyminen on hapettumisen vastakohta
- Metalli-ioni ottaa vastaan elektroneja ja muuttuu takaisin atomiksi
- Tuloksena kiinteää puhdasta metallia
- Mitä jalompi metalli, sen helpommin se pelkistyy
Hapettumis-pelkistymisreaktio
Ⓔ Mg + Cu2+ → Mg2+ + Cu
Ⓔ Mg2+ + 2 Li → Mg + 2 Li+
- Kaksi metallia reagoi keskenään
- Epäjalompi metalleista hapettuu, jalompi pelkistyy
- Joten aluksi:
- Jalompi metalleista on ioneina (liuoksena), jotta se voi pelkistyä
- Epäjalompi metalleista on atomeina (kiinteää), jotta se voi hapettua
- Toisin päin reaktio ei voi edetä
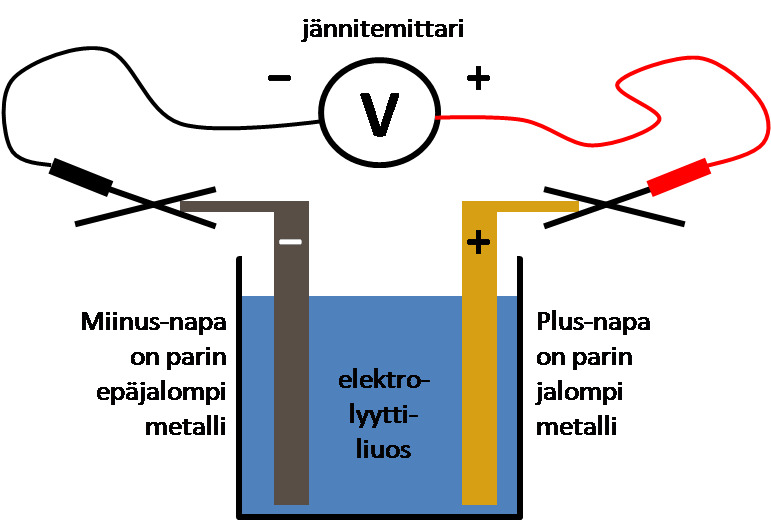
Sähkökemiallinen pari - muistiinpanot
Sähkökemiallinen pari eli paristo
Periaate
Ts. hapettumis-pelkistymisreaktio muuttaa kemiallista energiaa sähköenergiaksi. Mitä kauempana metallit ovat toisistaan jännitesarjassa, sitä suurempi jännite niiden välille muodostuu. (Eli miten suuri jalousero niillä on)
- Aina, kun kaksi eri metallia on elektrolyytin välityksellä kosketuksessa toisiinsa, syntyy ns. sähkökemiallinen pari.
- Elektrolyytti on ioneja sisältävä liuos, yleensä suola- tai happoliuos
- Kun metallit yhdistetään johtimilla esim lamppuun, sen läpi kulkee sähkövirta ja laite toimii.
- Kemiallinen energia → sähköenergia

Periaate
- Selvitetään, kumpi metalleista on epäjalompi. Se hapettuu eli luovuttaa elektroneja e−
- Epäjalommasta metallista muodostuu sähköparin miinusnapa (sisältää elektroneja)
- Elektroneja alkaa virrata miinusnavalta johdinta pitkin kohti jalompaa metallia, joka plusnapana vetää elektroneja puoleensa.
- Virtapiirin pitää olla suljettu, jotta sähkövirta kulkisi siinä.
→ Elektrolyytin positiiviset metalli-ionit kulkeutuvat liuoksessa kohti epäjalompaa metallia, joka miinusnapana vetää niitä puoleensa.
Ts. hapettumis-pelkistymisreaktio muuttaa kemiallista energiaa sähköenergiaksi. Mitä kauempana metallit ovat toisistaan jännitesarjassa, sitä suurempi jännite niiden välille muodostuu. (Eli miten suuri jalousero niillä on)
Elektrolyysi
- Ulkoisen jännitelähteen synnyttämä sähkövirta aiheuttaa kemiallisen reaktion
- Mahdollistaa hapettumispelkistymisreaktion ns. väärään suuntaan
- Käyttökohteita:
- puhtaiden metallien tuottaminen
- metalliesineiden pinnoittaminen
- molekyylien kuten veden hajottaminen alkuaineiksi
- akun lataaminen
Rautamalmista teräkseksi
- Epäjalot metallit esiintyvät maankuoressa oksideina ja muina yhdisteinä
- Ne ovat siis muodostaneet ioniyhdisteitä epämetallien kuten hapen kanssa
- Ioniyhdisteessä metalli on positiivisena ionina, kun se on luovuttanut ulkoelektroninsa epämetallille
- Metallien valmistus vaatii siis metalli-ionien pelkistämistä atomeiksi, jotta metalli voidaan erottaa ioniyhdisteestä.
Ⓔ Esimerkiksi raudan erottaminen rautamalmista - Pelkistäminen vaatii paljon energiaa. Siksi terästeollisuus on yksi suurimpia energiankuluttajia.
- Jalometalleja kuten kultaa voidaan löytää maaperästä puhtaana
Korroosio - muistiinpanot
Korroosio
- On metallin hapettumista olosuhteiden vaikutuksesta
- kosteus, likaisuus, hapekkuus ja suolaisuus
- Uhkaa epäjaloja metalleja
- Raudan korroosiota kutsutaan ruostumiseksi
- Jotkin metallit hapettuvat vain pinnastaan Ⓔ alumiini
- Riippuu myös siitä, onko muodostunut sähkökemiallinen pari.
Tällöin kahdesta metallista epäjalompi hapettuu eli syöpyy.
Ruoste on ruskea ja hauras yhdiste, joka koostuu pääosin rautaoksidista Fe2O3 ja vedestä. Ruostuminen etenee ruosteen alla hyvin, koska se huokoisena sitoo vettä. Siksi ruoste kannattaa poistaa nopeasti ja suojata pinta asianmukaisesti.
Keinoja estää ruostumista, Ⓔ polkupyörän:
- Säilytys kuivassa
- Materiaalin valinta (rauta vai alumiini)
- Puhdistus ja öljyäminen
- Maalaus (tai muu pintakäsittely)
- Estää sähkökemiallinen pari
- Uhrimetallin käyttö (sinkitty runko)
- Poista alkava ruoste