5. Ilma
1. Virittäytyminen – onko ilma ainetta?
2. Ilmalla on ainetta ja sillä on massa
 Ilma on ainetta. Sen voi todeta siitä, että sillä on massa ja se tarvitsee tilaa.
Ilma on ainetta. Sen voi todeta siitä, että sillä on massa ja se tarvitsee tilaa.
Ilma vaikuttaa kevyeltä, sillä yksi litra huoneenlämpöistä ilmaa on massaltaan vain 1,3 grammaa. Kuutio ilmaa, eli 1 x 1 x 1 m tilavuinen määrä on massaltaan 1,3 kg. Tavallisen noin kolme metriä korkean, kymmenen metriä leveän ja kymmenen metriä pitkän luokkahuoneen ilman massa on jo lähes 390 kg!
Kaikilla kaasuilla on ilman tavoin massa. Kaasun massa riippuu ensisijaisesti siitä, mistä alkuaineista se koostuu.
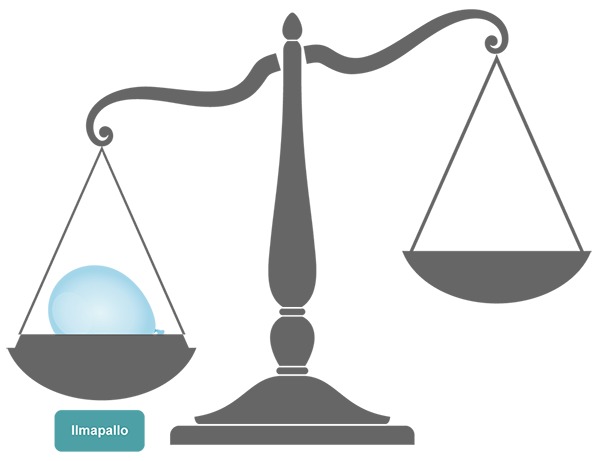
Ilma tarvitsee tilaa ja kaasumaisena aineena se leviää koko käytettävissä olevaan tilaan. Kun ilmapallon avaa veden alla, veden pinnalle nousee kuplia. Ne ovat sen kaasun kuplia, joilla ilmapallo oli täytetty. Kaasukuplat ovat veden pinnan alla havaittavissa selvärajaisina, tilaa tarvitsevina kaasukuplina, mutta veden pinnalle päästyään leviävät koko huoneilmaan.

3. Ilman koostumus, TÄRKEÄ
Ilma on kaasuseos, josta noin 78 % on typpeä ja noin 21 % happea. Jäljelle jäävä yksi prosentti koostuu pääasiassa jalokaasuista, hiilidioksidista, vesihöyrystä ja otsonista. Ilmassa on myös vaihteleva määrä saasteita.
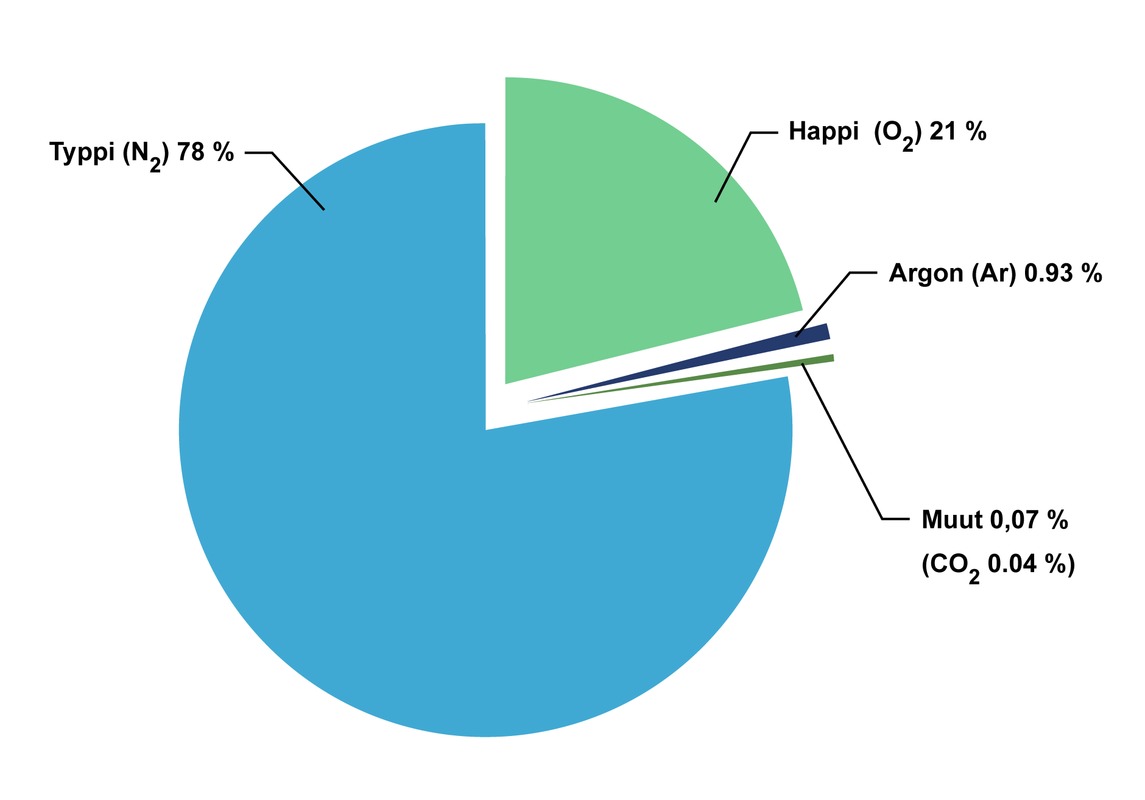
Ilma on välttämätön aine maapallon elämälle. Ilman rakenneosat ovat vuoroin sitoutuneina erilaisiin yhdisteisiin vedessä sekä maa- ja kallioperässä ja vuoroin vapaina alkuaineina ja yhdisteinä ilmakehässä. Ihmiset hyödyntävät alkuainemuotoista happea soluhengityksessä ja yhdistemuotoista happea juodessaan vettä.
 Ilman ominaisuuksia.
Ilman ominaisuuksia.4. Happi ja otsoni

Happi
Happi on tavallisissa olosuhteissa hajuton, mauton ja väritön kaasu. Hapen kemiallinen merkki on O, mutta luonnossa se esiintyy tavallisesti kahden atomin muodostamana happimolekyylinä O2 tai kemiallisiin yhdisteisiin sitoutuneena. Yksiatomista happea ei tavata muuten kuin erityisolosuhteissa. Happi muodostaa helposti yhdisteitä muiden aineiden kanssa. Kemiassa aineen palamisella tarkoitetaan hapen yhtymistä palavaan aineeseen.Otsoni
Hapella on toinenkin muoto, otsoni O3. Sitä esiintyy ylempänä ilmakehässä, jossa se suojaa maata auringon haitalliselta ultraviolettisäteilyltä. Otsonimolekyylin hajoaminen kuluttaa auringosta tulevaa UV-säteilyä ja vähentää siten maapallon pinnalle saapuvan UV-säteilyn määrää. Reaktiossa otsonimolekyyli hajoaa UV-säteilyn vaikutuksesta ja tuotteena muodostuu vapaa happiatomi ja happimolekyyli. Vapaa happiatomi reagoi nopeasti lähimmän happimolekyylin kanssa ja muodostaa uuden otsonimolekyylin. Ilmakehän epäpuhtaudet häiritsivät otsonin uudelleenmuodostumisen prosessia eli regeneraatiota. Regeneraation häiriöstä seurasi otsonikato eli yläilmakehän otsonin määrän väheneminen. Monikansallisten ilmastosopimusten ansiosta otsonin määrä on vähitellen palaamassa ennalleen.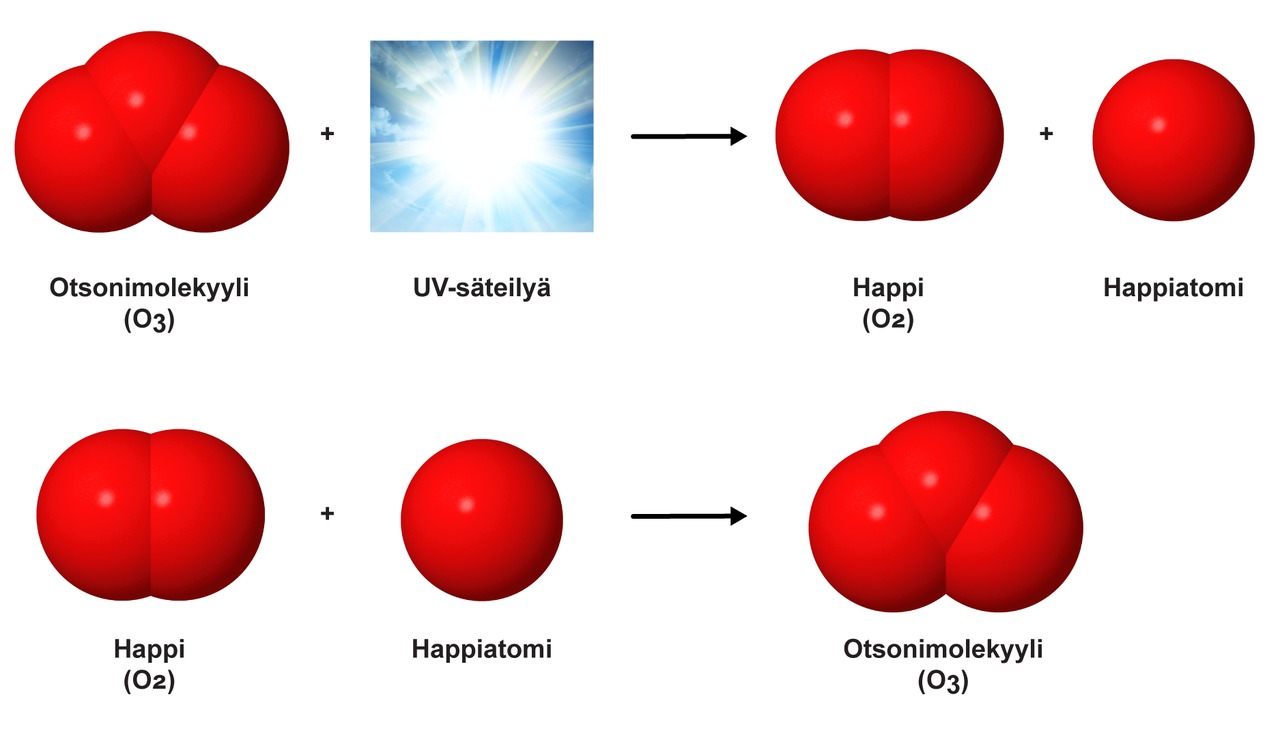
Otsonin regeneraatioprosessi.
5. Hiilidioksidi
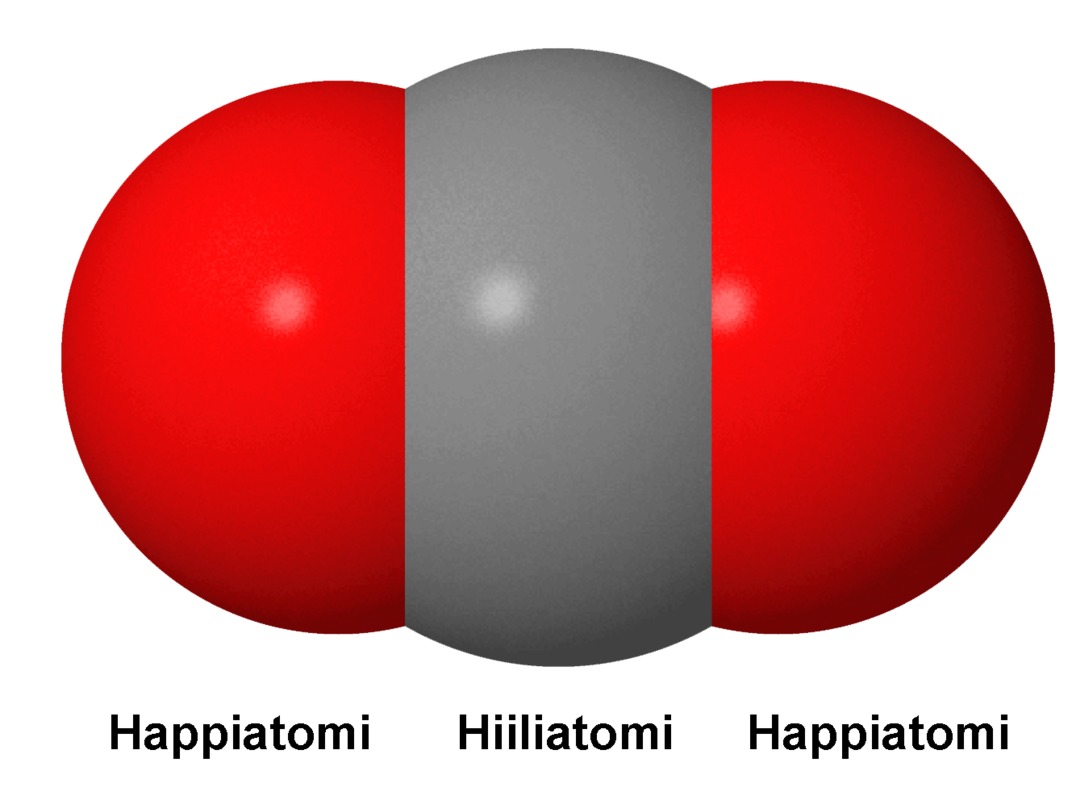
Hiilidioksidi on hajuton, mauton ja väritön kaasu. Hiilidioksidi rakentuu hiiliatomista ja siihen liittyneistä kahdesta happiatomista. Sen kemiallinen merkki on CO2. Litra huoneenlämpöistä hiilidioksidikaasua on massaltaan noin 2 grammaa, eli se on ilmaa raskaampaa. Litra huoneenlämpöistä ilmaa painaa noin 1,3 grammaa.
Hiilidioksidin muodostuminen
Hiilidioksidia muodostuu hiiltä sisältävien aineiden palamisreaktion lisäksi happaman aineen kuten etikan reagoidessa ruokasoodan, kalkkikiven tai munankuorien kanssa. Hiilidioksidi on väritön kaasu, mutta reaktiossa samaan aikaan muodostuva vesi voi kylmällä ilmalla tiivistyä silmin havaittavaksi pilveksi. Hiilidioksidi on yksi ilmaston lämpenemistä aiheuttavista kasvihuonekaasuista.
Sovelluksia
Hiilidioksidin liuetessa veteen muodostuu hiilihappoa, joka on tuttu aine muun muassa virvoitusjuomista. Veteen liuennut hiilidioksidi voi vapautua näyttävästi kuohuen.
Hiilidioksidia käytetään myös palosammuttimissa. Tästä opitaan lisää hieman myöhemmin luvussa Palaminen ja paloturvallisuus.

6. Typpi

Typpi on hajuton, mauton ja väritön kaasu. Sen kemiallinen merkki on N. Luonnossa se esiintyy tavallisesti kahden atomin muodostamana typpimolekyylinä N2 tai kemiallisiin yhdisteisiin sitoutuneena.
![]() Typpi
Typpi
Typpi suojakaasuna
Typpimolekyyli on hyvin passiivinen eikä juuri reagoi muiden aineiden kanssa. Ominaisuutensa perusteella sitä käytetään muun muassa elintarvikepakkauksissa suojakaasuna.
Pakattu suojakaasuun.

Kinkkuleikkeleen tuoteseloste. Suojakaasuun pakkaamisesta ilmoitetaan selosteen vasemmassa alalaidassa.
7. Vesi ja ilmankosteus
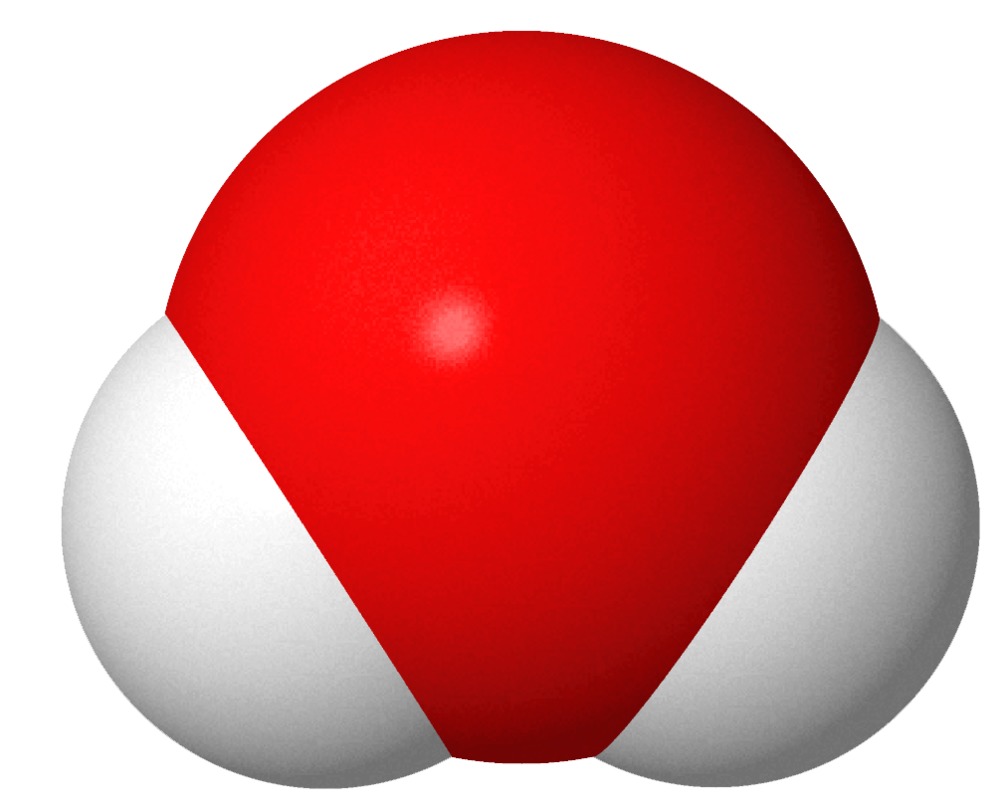
Vesi on hajuton, mauton ja väritön kaasu. Sen kemiallinen kaava on H2O. Se koostuu siis hapesta ja vedystä.
Kuten jo Vesi-luvussa opittiin, vesi esiintyy luonnossa kiinteänä (jää), nestemäisenä ja kaasuna (höyry). Ilmakehän vesihöyrypitoisuus on suurin ilmakehän alaosissa. Ilmakehässä oleva vesi tulee helposti havaittavaksi pilvissä. Myös vesihöyry on kasvihuonekaasu.
Tiivistyminen ja härmistyminen
Silmälasit huurtuvat kylmästä lämpimään tultaessa. Esimerkiksi virvoitusjuomapullon kylmä pinta kostuu helteellä ja talvella kylmän ikkunalasin pinta huurtuu, kun siihen hönkäisee. Ilmiö johtuu ilmassa ja uloshengityskaasussa olevan vesihöyryn tiivistymisestä nesteeksi kylmälle pinnalle.

Vesihöyryn tiivistyessä viileälle pinnalle siihen muodostuu ensin pieniä vesipisaroita. Tiivistymisen jatkuessa vettä kerääntyy lisää ja pisaroista kasvaa silmin nähtäviä, jopa pieniä lätäköitä.

Tiivistymisessä vesimolekyylit törmäävät aineen pintaan ja menettävät liike-energiaa. Törmäyksessä pinnan molekyylien liike kasvaa, joten aine lämpenee, mutta vesimolekyylien liike vähenee, joten vesi jäähtyy. Höyrymäinen vesi tiivistyy nestemäiseksi vedeksi. Joskus energian menetys voi olla niin suuri, että kaasu muuttuu suoraan kiinteäksi huurteeksi eli härmistyy.

8. Simuloi veden tiivistyminen ja härmistyminen.
![]() Tutki seuraavan simulaation avulla veden tiivistymistä ja härmistymistä.
Tutki seuraavan simulaation avulla veden tiivistymistä ja härmistymistä.
Tiivistyminen
- Valitse Phase Changes.
- Muuta tutkittavaksi aineeksi vesi eli Water.
- Lämpötilan voit muuttaa celsius-asteiksi. Lämmitä systeemi noin 500 asteeseen, jolloin vesi on varmasti kaasumaisessa muodossa. Tutki, miten kaasu täyttää kaiken vapaan tilan.
- Seuraavaksi tiivistä kaasu nesteeksi laskemalla lämpötilaa. Laske lämpötila noin 55 asteeseen. Havainnoi, miten aineen tilankäyttö muuttuu.
Härmistyminen
- Valitse tilaksi States.
- Muuta tutkittavaksi aineeksi vesi.
- Muuta veden olomuotoa suoraan kaasusta (gas) kiinteäksi (solid). Havainnoi, miten rakenneosien liike ja tilavuus muuttuvat.
- Voit härmistää kaasun kiinteäksi myös Phase changes -tilassa laskemalla lämpötilaa manuaalisesti.
Tiivistelmä
- Kaikilla kaasuilla on massa. Kaasun massa riippuu sen alkuainekoostumuksesta.
- Ilma on kaasuseos, josta noin 78 % on typpeä ja noin 21 % happea.
- Typpikaasua käytetään elintarvikepakkauksissa suojakaasuna.
