3. Vesi
1. Virittäytyminen – Onko hanavesi puhdasta ainetta?
2. Vesi
Vesi on kaikille tuttu aine. Jokainen ihminen tarvitsee vettä joka päivä. Ihminen juo vettä vuodessa noin 1000 litraa. Aikuinen ihminen tarvitsee sitä päivittäin 2–3 litraa. Määrästä noin litra tulee ruoasta ja loput nautitaan nesteenä. Osa vedestä juodaan sekoittuneena muihin nesteisiin, kuten maitoon ja piimään. Janojuomaksi suositellaan pelkästään vettä.

3. Juomavesi on seos (vko 38)
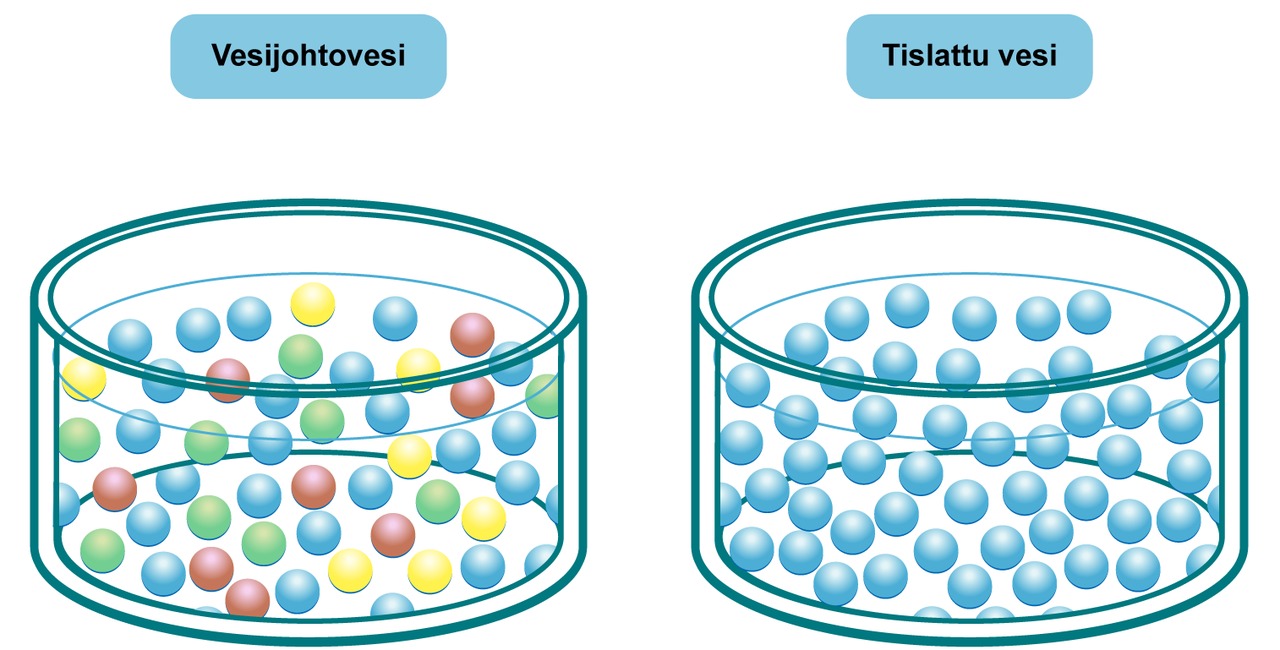
 Puhdas vesi koostuu vain vesimolekyyleistä. Se vesi, mitä juomme ja käytämme talousvetenä, ei ole kemiallisesta näkökulmasta katsottuna puhdasta ainetta.
Puhdas vesi koostuu vain vesimolekyyleistä. Se vesi, mitä juomme ja käytämme talousvetenä, ei ole kemiallisesta näkökulmasta katsottuna puhdasta ainetta.
Vesijohtovesi on seos, johon on vesilaitoksella lisätty monia aineita muun muassa veden happamuuden säätämiseksi. Siihen on myös liuennut pintamateriaalia kaikista veden keräämiseen, säilyttämiseen ja kuljettamiseen liittyvistä välineistä, astioista ja putkistoista.
Välineistä, astioista ja putkistoista veteen liuenneiden aineiden määrät ovat mitätöntä vähäisempiä, eikä niillä ole terveydellistä merkitystä, mutta ne voivat häiritä laboratorioiden tarkkoja kemiallisia reaktioita ja mittauksia. Tästä syystä laboratoriossa käytetään tislattua vettä.
4. Aineiden olomuodot (vko 37)
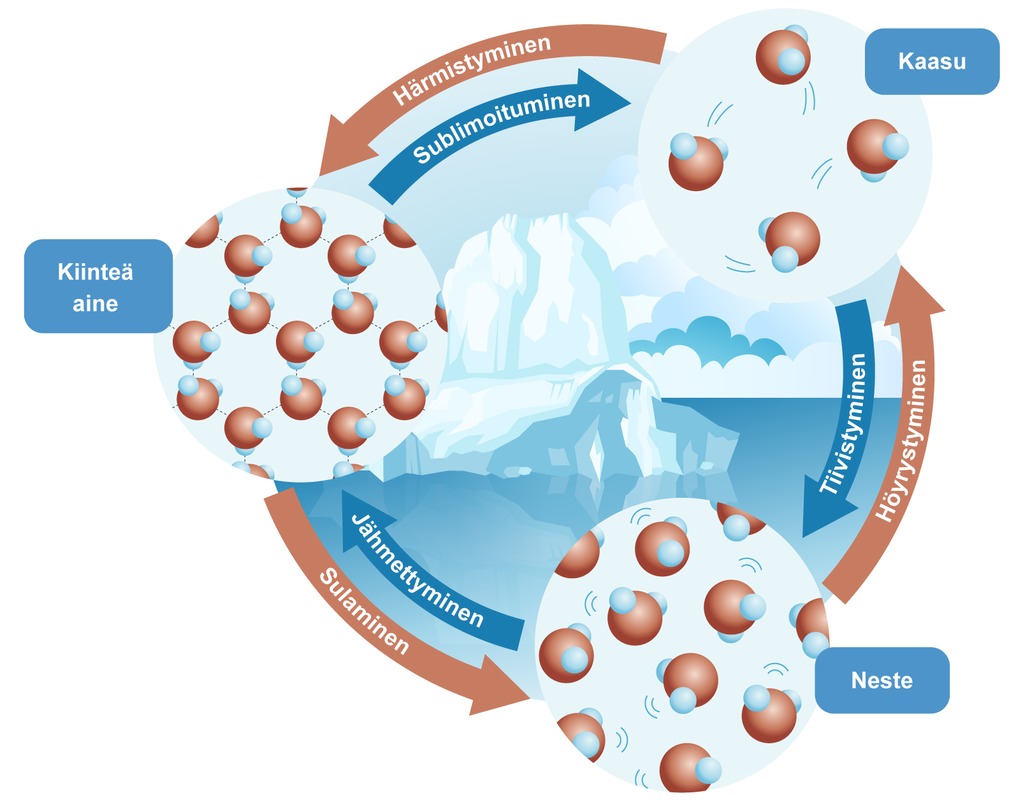
Aineen kolme yleisintä olomuotoa ovat kiinteä, neste ja kaasu.
- Kiinteällä aineella on tietty muoto. Kiinteässä aineessa rakenneosat ovat lähellä toisiaan ja liikkuvat vain vähän. Rakenneosat ovat liittyneet toisiinsa kemiallisilla sidoksilla.
- Nesteellä on sama muoto kuin astialla, jossa sitä säilytetään. Nestepinta asettuu aina vaakasuoraan. Nesteessä rakenneosat ovat toisiinsa liittyneinä vain hetkittäin. Etäisyydet rakenneosien välillä ovat melkein samat kuin jos aine olisi kiinteää, mutta nesteessä rakenneosat voivat liikkua toistensa ohi.
- Kaasu täyttää kaiken tarjolla olevan tilan. Jos kaasu suljetaan astiaan, se täyttää koko astian. Jos astia avataan suljetussa huoneessa, kaasu leviää tasaisesti koko huoneeseen. Kaasuissa rakenneosat ovat kaukana toisistaan ja liikkuvat melko vapaasti. Kaasussa hiukkaset myös liikkuvat nopeasti.
Vedellä nämä kolme olomuotoa ovat kiinteä jää, nestemäinen vesi ja vesihöyry, joka on kaasu.

Huomaa, että vaikka veden olomuoto muuttuu, niin sen rakenneosat pysyvät samanlaisina. Siis vesi on vettä, olipa se sitten jäätä, vettä tai vesihöyryä. Katso eri olomuodoista video. Kiinnitä videon katselussa huomiota yllä lueteltuihin eri olomuotojen ominaisuuksiin.
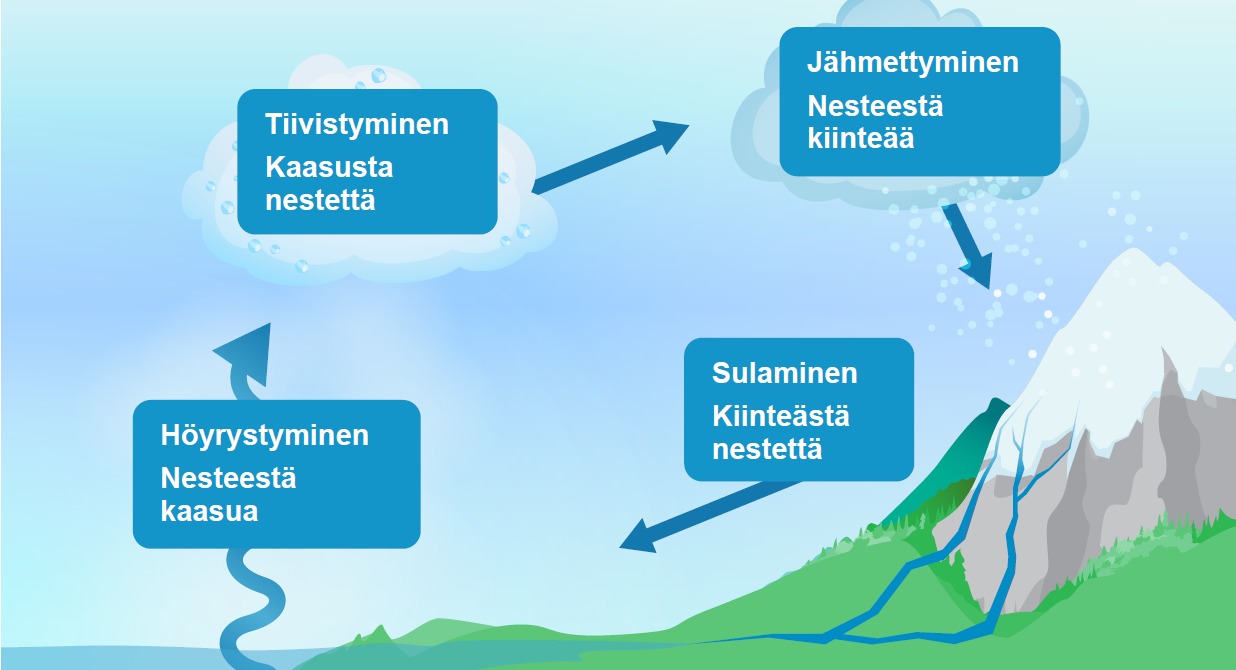
5. Veden kiertokulku (vko 37)
Vesi kiertää luonnossa jatkuvasti olomuodosta toiseen. Jokaisella muutoksella on oma nimensä. Vesistöistä neste höyrystyy kaasuksi. Ilmassa vesihöyry tiivistyy nesteeksi, jolloin se sataa maahan nesteenä. Jos on tarpeeksi kylmä, niin neste voi myös jähmettyä kiinteäksi ja se sataa alas lumena. Jäätiköt ovat vettä kiinteässä muodossa. Jää ja lumi muuttuvat nesteeksi sulamisen myötä. Kiertokulkua ylläpitää aurinko.
Lämpötilaa, jossa kiinteä aine muuttuu nesteeksi eli sulaa, nimitetään sulamispisteeksi. Päinvastaista muutosta nimitetään jähmettymiseksi ja sitä vastaavaa lämpötilaa jähmettymispisteeksi. Kiehumispisteessä neste muuttuu kaasuksi ja vastaavasti tiivistymispisteessä kaasu tiivistyy nesteeksi.
Kaasu voi muuttua suoraan kiinteäksi olematta välillä nestemäisessä olomuodossa. Tällaista muutosta nimitetään härmistymiseksi. Esimerkiksi vesihöyry voi jähmettyä suoraan jääksi, kun hönkäisee kylmän ikkunalasin pintaan. Päinvastaista muutosta, jossa kiinteä aine kaasuuntuu, nimitetään sublimoitumiseksi.
6. Simuloi veden olomuodonmuutokset (vko 37)
![]() Tutki seuraavan simulaation avulla veden tiivistymistä, härmistymistä, sulamista ja jähmettymistä.
Tutki seuraavan simulaation avulla veden tiivistymistä, härmistymistä, sulamista ja jähmettymistä.
Asetukset
- Valitse Phase Changes.
- Muuta tutkittavaksi aineeksi vesi eli Water.
- Muuta lämpötila celsius-asteiksi.
- Avaa Phase Diagram, josta näet, missä olomuodossa aine on.
Simulointi
Vesi on simulaation lähtötilanteessa kiinteässä muodossa (−116 °C). Aloita siis sulattamalla se nesteeksi ja tarkkaile, miten aine käyttäytyy.Lämmitä vesi seuraavaksi höyrymuotoon ja tarkkaile, kuinka kaasu täyttää kaiken vapaan tilan.
Seuraavaksi voit alkaa jäähdyttää systeemiä. Jäähdytä systeemiä hieman, jotta vesi tiivistyy takaisin nesteeksi. Jatka lopuksi jäähdyttämistä niin kauan, että simuloitava aine jähmettyy takaisin kiinteäksi.
Palautuskansio
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
7. Aineiden luokittelu (vko 39)
Kaikki aineet koostuvat rakenneosista. Puhdas aine sisältää vain samoja rakenneosia, kun taas seoksissa kahden tai useamman eri aineen rakenneosat ovat sekoittuneet keskenään. Seokset voidaan jakaa kahteen ryhmään.
 1. Tasakoosteiset seokset (Homogeeninen seos)
1. Tasakoosteiset seokset (Homogeeninen seos)
Tasakoosteiset seokset ovat seoksia, joiden ainesosia ei pysty silmämääräisesti erottamaan. Esimerkiksi liuokset ovat tasakoosteisia seoksia. Merivesi on liuos, jossa vesi toimii liuottimena. Meriveteen on liuennut muun muassa suoloja, joita et pysty näkemään, mutta maistamaan kyllä pystyt. Toinen esimerkki tasakoosteisesta seoksesta olisi ilma, joka on kaasuseos.
Liuos voi olla myös kylläinen. Kylläinen liuos syntyy, kun liuottimeen "ei mahdu" enempää liuotettavaa ainetta. Testataan tätäkin luvun kokeellisissa töissä.
2. Sekakoosteiset seokset (Heterogeeninen seos)
Sekakoosteisten seosten eri ainesosat pystytään erottamaan silmillä. Kemistien kielellä sanotaan, että sekakoosteisessa seoksessa aineet ovat eri faaseissa. Faasilla tarkoitetaan kemiallisesti tasalaatuista, fysikaalisesti erillistä ja mekaanisesti toisistaan erotettavissa olevaa olomuotoaluetta. Aineen olomuoto faasissa voi olla kiinteä, neste tai kaasu.
Eri faasien välillä on silminnähtävä rajapinta. Esimerkiksi veden joukkoon pudotettu kivi muodostaa kaksi faasia. Aineet ovat keskenään eri olomuodossa (neste ja kiinteä), ja niiden välillä on selkeä rajapinta. Myös vesi ja ruokaöljy muodostavat sekakoosteisen seoksen. Aineiden olomuoto on sama (molemmat nesteitä), mutta nestekerrosten välillä on selkeä rajapinta.

Vesi ja ruokaöljy muodostavat sekakoosteisen seoksen.
Myös savu ja sumu ovat sekakoosteisia seoksia. Savussa on pieniä, kiinteitä hiilipartikkeleita ilmassa. Sumu puolestaan on seos, jossa näkyy nestemäisiä vesipisaroita ilmassa, joka on kaasu.
 Vasemmalla savua ja oikealla sumua.
Vasemmalla savua ja oikealla sumua.
8. Kokeellisuutta kotona: liukoisuuteen vaikuttavat tekijät, (vko 39)
![]()
![]() Liukenemista voidaan hallita, sillä sen nopeuteen vaikuttavat useat seikat. Voit testata tätä kotonasi vaikkapa liuottamalla sokeria erilaisissa olosuhteissa. Tarvitset vain kylmää ja kuumaa vettä, kaksi lasia, lusikan, palasokeria ja hienoa sokeria.
Liukenemista voidaan hallita, sillä sen nopeuteen vaikuttavat useat seikat. Voit testata tätä kotonasi vaikkapa liuottamalla sokeria erilaisissa olosuhteissa. Tarvitset vain kylmää ja kuumaa vettä, kaksi lasia, lusikan, palasokeria ja hienoa sokeria.
Tutkimusasetelma
-
Vaihtele liuotettavan aineen määrää. Ota kaksi vesilasia joissa on sama määrä vettä. Ota vettä vain vähän, sillä kemian kokeissa ainemäärät on syytä pitää pieninä. Lisää ensimmäiseen vesilasiin yksi ruokalusikallinen hienoa sokeria ja toiseen kaksi. Huomaat varmaan, että pienempi sokerimäärä liukenee nopeammin.
-
Huomaa myös, että sekoitus nopeuttaa liukenemisprosessia.
-
Jos kaikki sokeri ei liuennut, tarvitset lisää liuotinta. Lisää siis vettä, sillä liuottimen määrä vaikuttaa liukenemiseen.
-
Testaa seuraavaksi, miten liuotettavan aineen hienojakoisuus vaikuttaa. Toista sama testi palasokerilla ja hienolla sokerilla. Mitä havaitset?
-
Kokeile seuraavaksi muuttaa lämpötilaa. Ota toiseen lasiin kuumaa ja toiseen kylmää vettä. Huomaat varmaan, että aineet liukenevat nopeammin lämpimään liuottimeen.

Johtopäätös
Analysoidaanpa liukoisuuskokeen tuloksia hieman tasa- ja sekakoosteisten seosten näkökulmasta. Kokeessa nimittäin tapahtui mielenkiintoinen asia – sekakoosteinen seos muuttui liukenemisen myötä tasakoosteiseksi seokseksi.Kun sokeripala pudotettiin veteen, muodostui sekakoosteinen seos. Aineiden välillä oli selkeä rajapinta. Sokeri kuitenkin liukeni vähitellen veden joukkoon ja jossain vaiheessa ei voitu enää silmämääräisesti erottaa, missä on sokeria ja missä vettä. Muodostui siis tasakoosteinen seos – veden ja siihen liuenneen sokerin muodostama liuos.
9. Aineiden erottaminen toisistaan, (vko 40 ja 41)
Seosten kanssa työskenneltäessä on tärkeää pystyä erottamaan sen komponentit toisistaan. Aineiden erottamista tarvitaan esimerkiksi silloin, kun halutaan eristää kasveista vaikuttava lääkeaine tai kofeiini teen lehdistä tai kahvinpuruista. Erotusmenetelmiä sovelletaan myös pyykin linkouksessa, jossa vesi erotetaan pyykistä. Samalla linkousmenetelmällä voitaisiin erottaa myös verihiutaleet verestä, sille ne ovat suurempia ja tiheämpiä kuin veren muut komponentit.
Aineiden erottaminen on siis kemiassa tärkeää. Erottamisessa siis hyödynnetään aineiden erilaisia kemiallisia ja fysikaalisia ominaisuuksia, kuten olomuotoja, kokoa, tiheyttä, liukoisuutta tai kiehumispistettä.
Suodatus
Kiinteät aineet erotetaan nesteestä mekaanisesti suodattamalla. Suodatukseen tarvitaan suppilo, jonka suulle asetetaan suodatinpaperi. Pienet hiukkaset pääsevät kulkemaan suodatinpaperin verkon läpi, mutta suuret jäävät siihen kiinni. Sama menetelmä on käytössä esimerkiksi kahvinkeitossa.
Tislaus
Tasakoosteisen nesteseoksen nesteet erotetaan erilleen tislaamalla. Tislauksessa haihtuva neste kerätään talteen. Tislaus perustuu siihen, että erotettavilla nesteillä on eri kiehumispisteet. Esimerkiksi kun tislataan seosta, jossa on 100 °C:isia ja 150 °C:isia kiehuvia nesteitä, niin ensimmäinen neste haihtuu seoksesta pois 100 asteessa ja 150 asteen kiehumispisteen omaava aine jää vielä tislausastiaan.
Haihdutus
Kiinteä aine erotetaan nesteestä haihduttamalla. Haihdutuksessa nestettä ei oteta talteen kuten tislaamisessa.
Ohutkerroskromatografia, EI TULE KOKEESEEN
Ohutkerroskromatografialevy voidaan korvata joissain tilanteissa paperilla, jolloin kyseessä on paperikromatografia.
Uutto
 Uutto on kemiallinen erotusmenetelmä, jossa eristettävä aine erotetaan seoksesta liuottamalla aine sopivan liuottimen avulla. Esimerkiksi kahvin ja teen valmistuksessa kuumalla vedellä uutetaan kahvijauheen ja teen lehtien sisältämä kofeiini juotavaan muotoon.
Uutto on kemiallinen erotusmenetelmä, jossa eristettävä aine erotetaan seoksesta liuottamalla aine sopivan liuottimen avulla. Esimerkiksi kahvin ja teen valmistuksessa kuumalla vedellä uutetaan kahvijauheen ja teen lehtien sisältämä kofeiini juotavaan muotoon.Oheisessa kuvassa on erotussuppilo, jossa erotetaan vettä öljystä.
Erotuskaavio EI TULE KOKEESEEN
Erotustapahtumaa voidaan kuvata erotuskaaviolla, jossa ilmenevät alkutilanne (lähtöaineet), käytetty erotusmenetelmä ja toisistaan erotetut aineet (lopputuotteet). Lopputulos ei välttämättä koostu pelkästään puhtaista aineista, vaan uusista seoksista. Erotustapahtuma voi olla monivaiheinen.Erotuskaavio on siis erotusmenetelmän käyttöön liittyvä graafinen esitys. Siinä kuvataan seos, erotusmenetelmä ja erotetut aineet, esimerkkinä kahvin valmistuksen erotuskaavio. Kaaviossa aineosat ovat laatikoissa. Erotusmenetelmä on kirjattu laatikoiden väliin sinisellä värillä.

10. Yhteenveto erotusmenetelmistä, EI KOKEESEEN
| Fysikaaliset menetelmät | Erottuminen perustuu |
|---|---|
| Sihtaus | Hiukkaskoko |
| Suodatus | Hiukkaskoko |
| Sentrifugointi | Tiheys |
| Linkous | Tiheys |
| Tislaus | Höyrynpaine, erityisesti kiehumispiste |
| Haihdutus | Höyrynpaine |
| Kemialliset menetelmät | Ominaisuus, johon erottuminen perustuu |
| Uuttaminen | Liukoisuus |
| Saostaminen | Liukoisuus ja erityisesti saostuminen |
| Kromatografia | Liukoisuus |
11. Vedenpuhdistus, EI TULE KOKEESEEN
Vesihanasta tuleva vesi on puhdistettua pohja- tai pintavettä. Vesi puhdistetaan vesilaitoksella ennen kuin se lasketaan vesijohtoverkostoon. Puhdistuksessa vedestä erotetaan haitalliset aineet, säädetään happamuus sopivaksi ja poistetaan mikrobit desinfioinnilla. Vettä puhdistetaan mekaanisesti, kemiallisesti ja biologisesti.
Mekaanisessa puhdistuksessa vedestä ensin seulotaan isoimmat kiinteät hiukkaset pois, jonka jälkeen vesi suodatetaan tiheämmällä suodattimella.
Kemiallisessa puhdistuksessa veteen lisätään kemikaaleja, jotka muuttavat nestemäisiä haitta-aineita kiinteiksi. Menetelmää kutsutaan saostamiseksi. Saostaminen on liukenemisen vastakohta. Kemiallisella puhdistuksella voidaan tuhota myös pieneliöitä. Esimerkiksi uima-altaaseen lisätään klooria, joka tappaa bakteereja ja leviä.
Biologisessa puhdistusvaiheessa veteen liuenneet ravinteet hapetetaan tai kulutetaan muuten biologisesti bakteerien avulla. Bakteerien avulla vedestä voidaan myös saostaa rautaa.

Kemiallista vedenpuhdistusta. Vasemmalla on kuva ison mittakaavan puhdistamisesta. Oikealla on retkeilykäyttöön valmistettuja vedenpuhdistustabletteja. Tabletti lisätään vesipulloon ja annetaan vaikuttaa noin puoli tuntia. Puolen tunnin päästä pieneliöt ovat kuolleita ja vesi juomakelpoista.
Jätevedet
Myös jätevedet täytyy puhdistaa ennen kuin vesi lasketaan takaisin luontoon. Suomalaisesta syntyy päivittäin noin 200 litraa jätevettä. Määrä on aika suuri, ja siksi jokaisen kannattaa pohtia, voiko omassa elämässä säästää vedenkulutusta. Esimerkiksi kylvyt voi vaihtaa lyhyeen suihkuun, ja rikkinäiset hanat pitää korjata. Samalla on syytä muistaa, että vesijohtovettä pitää käyttää. Putkistossa seisova vesi pilaantuu, jos se seisoo paikallaan liian pitkään.
Muista, että viemäriin ei saa kaataa mitään ylimääräistä. Ylimääräiset aineet (esim. ruoka) ja esineet (esim. pumpulipuikot) haittaavat jäteveden puhdistamista.
Tiivistelmä
- Kaikki aineet koostuvat rakenneosista. Puhdas aine sisältää vain samoja rakenneosia, kun taas seoksissa kahden tai useamman eri aineen rakenneosat ovat sekoittuneet keskenään.
- Tasakoosteiset seokset ovat seoksia, joiden ainesosia ei pysty silmämääräisesti erottamaan.
- Sekakoosteisten seosten eri ainesosat pystytään erottamaan silmillä.
- Aineen kolme yleisintä olomuotoa ovat kiinteä, neste ja kaasu.
- Vesi kiertää luonnossa jatkuvasti olomuodosta toiseen.
- Aineita voidaan erottaa toisistaan erotusmenetelmillä.

