4. Olomuodon muutokset
Olomuodon muutokset
Kuten hyvin tiedämme, niin aine voi esiintyä kolmessa eri olomuodossa: kiinteänä, nesteenä ja kaasuna. Aine voi myös esiintyä hieman erilaisissakin olomuodoissa, kuten esimerkiksi plasmana tai amorfisena aineena.
 Vettä kolmessa eri olomuodossa: kiinteänä eli jäänä, nesteenä eli vetenä ja kaasuna eli vesihöyrynä.
Vettä kolmessa eri olomuodossa: kiinteänä eli jäänä, nesteenä eli vetenä ja kaasuna eli vesihöyrynä.
Jos aine on tarpeeksi alhaisessa lämpötilassa, että sen rakenneosilla ei ole riittävästi liike-energiaa irrottautua toisistaan ja ne korkeintaan värähtelevät paikoillaan, niin tällöin aine on kiinteää. Kiinteälle aineelle on tyypillistä, että sen rakenneosat ovat järjestäytyneet paikoilleen säännönmukaiseen (kide-)rakenteeseen. Esimerkiksi lumihiutaleen kaunis muoto johtuu kiderakenteesta.
Kun kiinteää ainetta lämmitetään tarpeeksi, niin sen rakenneosat saavat lisää liike-energiaa. Kun lämpötila saavuttaa sulamispisteen, niin rakenneosilla on riittävästi energiaa irrottautua kiderakenteesta ja ne pääsevät liikkumaan vapaammin. Rakenneosat ovat yhä sidoksissa toisiinsa, mutta ne voivat liikkua vapaasti. Tällöin tapahtuu sulamista eli aine muuttuu nesteeksi. Jos neste muuttuu kiinteäksi, on muutoksen nimi kiinteytyminen.
Kun nestettä lämmitetään kiehumispisteeseen asti, niin rakenneosien väliset sidokset katkeavat ja rakennosat pääsevät liikkumaan vapaasti. Tällöin tapahtuu höyrystymistä eli aine muuttuu kaasuksi. Jos kaasu muuttuu nesteeksi, on muutoksen nimi tiivistyminen.
Kaasuhiukkasten liikettä voivat yhä rajoittaa vaikkapa astian seinät, joihin hiukkaset törmäilevät. Mitä enemmän törmäyksiä tapahtuu, niin sitä suurempi on kaasun aiheuttama paine astiassa.
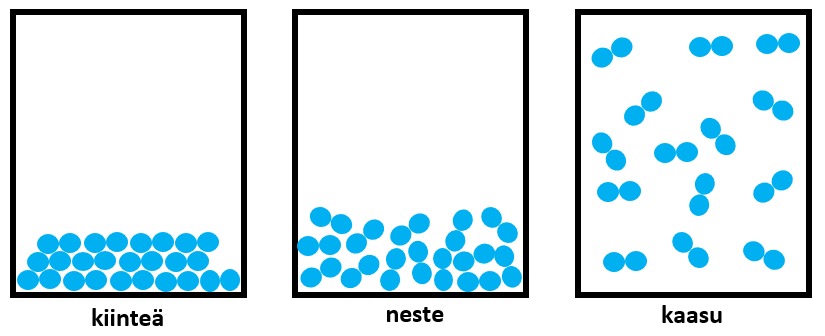
Aineen ollessa kiinteätä, sen rakenneosat ovat siistissä järjestyksessä paikoillaan. Nesteenä rakenneosat pääsevät liikkumaan, mutta ovat vahvasti sidoksissa toisiinsa. Kaasussa rakenneosien väliset sidokset katkeavat ja niiden välinen etäisyys kasvaa ja aineen tiheys pienenee huomattavasti.
Sulamis- ja kiehumispiste
Kaikilla aineilla on omat sulamis- ja kiehumispisteensä. Sulamis- ja kiehumispisteisiin voidaan vaikuttaa ympäristön ulkoiselle paineella ja aineen epäpuhtauksilla. Kovassa paineessa vesi kiehuu korkeammassa lämpötilassa kuin 100[[$^\circ$]]C (painekattila), mutta pienessä paineessa (esimerkiksi korkealla vuorella) vesi kiehuu alle 100[[$^\circ$]]C asteessa.
Kaikilla ainella ei ole tarkkaa sulamispistettä. Esimerkiksi lasi ja muovi pehmenevät lämmetessään pikkuhiljaa. Aineita, joilla ei ole tarkkaa sulamispistettä, kutsutaan amorfisiksi aineiksi.
Nesteen muuttumista kaasuksi ei tapahdu ainoastaan kiehumispisteessä. Neste voi haihtua höyryksi myös haihtumalla, jota voi tapahtua kaikissa lämpötiloissa.
Eräiden aineiden sulamis- ja kiehumispisteitä.
Kuten havaitsit oppilastyössä, niin sulamisen ja kiehumisen aikana lämpötila ei muutu. Aineeseen tuotu energia kuluu olomuodon muutokseen, eikä aineen lämpötila muutu ennen kuin olomuoto on muuttunut kokonaan.
 Vettä kolmessa eri olomuodossa: kiinteänä eli jäänä, nesteenä eli vetenä ja kaasuna eli vesihöyrynä.
Vettä kolmessa eri olomuodossa: kiinteänä eli jäänä, nesteenä eli vetenä ja kaasuna eli vesihöyrynä.Jos aine on tarpeeksi alhaisessa lämpötilassa, että sen rakenneosilla ei ole riittävästi liike-energiaa irrottautua toisistaan ja ne korkeintaan värähtelevät paikoillaan, niin tällöin aine on kiinteää. Kiinteälle aineelle on tyypillistä, että sen rakenneosat ovat järjestäytyneet paikoilleen säännönmukaiseen (kide-)rakenteeseen. Esimerkiksi lumihiutaleen kaunis muoto johtuu kiderakenteesta.
Kun kiinteää ainetta lämmitetään tarpeeksi, niin sen rakenneosat saavat lisää liike-energiaa. Kun lämpötila saavuttaa sulamispisteen, niin rakenneosilla on riittävästi energiaa irrottautua kiderakenteesta ja ne pääsevät liikkumaan vapaammin. Rakenneosat ovat yhä sidoksissa toisiinsa, mutta ne voivat liikkua vapaasti. Tällöin tapahtuu sulamista eli aine muuttuu nesteeksi. Jos neste muuttuu kiinteäksi, on muutoksen nimi kiinteytyminen.
Kun nestettä lämmitetään kiehumispisteeseen asti, niin rakenneosien väliset sidokset katkeavat ja rakennosat pääsevät liikkumaan vapaasti. Tällöin tapahtuu höyrystymistä eli aine muuttuu kaasuksi. Jos kaasu muuttuu nesteeksi, on muutoksen nimi tiivistyminen.
Kaasuhiukkasten liikettä voivat yhä rajoittaa vaikkapa astian seinät, joihin hiukkaset törmäilevät. Mitä enemmän törmäyksiä tapahtuu, niin sitä suurempi on kaasun aiheuttama paine astiassa.

Aineen ollessa kiinteätä, sen rakenneosat ovat siistissä järjestyksessä paikoillaan. Nesteenä rakenneosat pääsevät liikkumaan, mutta ovat vahvasti sidoksissa toisiinsa. Kaasussa rakenneosien väliset sidokset katkeavat ja niiden välinen etäisyys kasvaa ja aineen tiheys pienenee huomattavasti.
Sulamis- ja kiehumispiste
Kaikilla aineilla on omat sulamis- ja kiehumispisteensä. Sulamis- ja kiehumispisteisiin voidaan vaikuttaa ympäristön ulkoiselle paineella ja aineen epäpuhtauksilla. Kovassa paineessa vesi kiehuu korkeammassa lämpötilassa kuin 100[[$^\circ$]]C (painekattila), mutta pienessä paineessa (esimerkiksi korkealla vuorella) vesi kiehuu alle 100[[$^\circ$]]C asteessa.
Kaikilla ainella ei ole tarkkaa sulamispistettä. Esimerkiksi lasi ja muovi pehmenevät lämmetessään pikkuhiljaa. Aineita, joilla ei ole tarkkaa sulamispistettä, kutsutaan amorfisiksi aineiksi.
Nesteen muuttumista kaasuksi ei tapahdu ainoastaan kiehumispisteessä. Neste voi haihtua höyryksi myös haihtumalla, jota voi tapahtua kaikissa lämpötiloissa.
| Aine | Sulamispiste ([[$^\circ$]]C) | Kiehumispiste ([[$^\circ$]]C) |
| rauta | 1535 | 2750 |
| kupari | 1083 | 2570 |
| tina | 232 | 2270 |
| vesi | 0 | 100 |
| elohopea | -38,9 | 356,7 |
| ruokasuola | 802 | 1440 |
| happi | -218 | -183 |
| typpi | -209 | -195 |
Kuten havaitsit oppilastyössä, niin sulamisen ja kiehumisen aikana lämpötila ei muutu. Aineeseen tuotu energia kuluu olomuodon muutokseen, eikä aineen lämpötila muutu ennen kuin olomuoto on muuttunut kokonaan.