8 Jaksollinen järjestelmä ja sidokset
Ensimmäinen kemian koe - 2025 syksy
Koealue:
- jaksollinen järjestelmä ja sidokset: kpl11-15 (+syventävä osa)
- kpl 21 metallit ja niiden sidokset (erityisesti muistiinpanot)
Alkuainemuistipelin tulosteet
Johdanto
7. luokalla opimme, minkälaisia ominaisuuksia aineella voi olla. Nyt opiskelemme aineen rakennetta ja yritämme ymmärtää syitä aineiden ominaisuuksien taustalla. Lisäksi pyrimme ymmärtämään paremmin, mitä kemiallisissa reaktioissa tapahtuu.
Aineen rakenne
Esineet ja ihmiset koostuvat erilaisista aineista. Kukin puhdas aine koostuu sille tyypillisistä pienimmistä rakenneosista kuten atomeista, ioneista (tai esim ionipareista) tai molekyyleistä. Lopulta kyse on siitä, miten atomit käyttäytyvät toistensa läheisyydessä. Atomin päällimmäinen osa on elektroniverho, joka koostuu elektronikuorista. Atomi tervehtii viereistä atomia uloimpien elektroniensa avulla. Jaksollinen järjestelmä auttaa ymmärtämään, mitä silloin tapahtuu.
Sidostyypit
- Ionisidos - epämetallin ja metallin välillä
- Molekyylisidos - epämetallin ja epämetallin välillä
- Metallisidos - metallin ja metallin välillä
Sähköinen vuovovaikutus
Kemialliset sidokset perustuvat hiukkasten pieniin sähkövarauksiin. Sähköopin kokonaisuus kuuluu fysiikkaan mutta tässä lyhyt kooste sähköisistä vuorovaikutuksista eli voimien muodostamista pareista.Kertaa atomi
Atomin piirtäminen
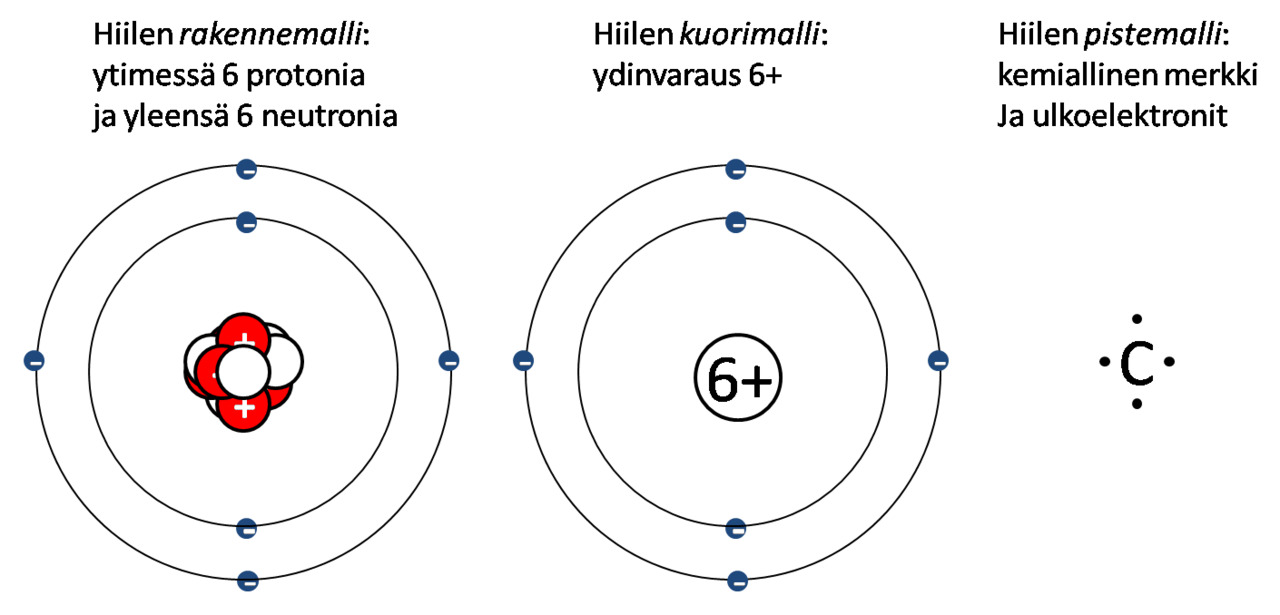
Atomin rakenne:
- Ydin keskellä, sisältää neutronit ja protonit
- Elektronit kiertävät ydintä elektroniverhossa
- joka voi koostua useammasta elektronikuoresta
- Rakenneosat ja niiden sähkövaraukse
- Neutroni varaukseton
- protoni positiivinen eli +
- elektroni negatiivinen eli -
- Neutroni varaukseton
Järjestysluku
- Alkuaineen tai sen atomin järjestysluku = protonien lukumäärä ytimessä
Atomi on varaukseton, koska protonien lukumäärä = elektronien lukumäärä
Atomi pysyy koossa, koska + ja - varausten välillä
puoleensa vetävä vuorovaikutus - Ensimmäiset kymmenen alkuainetta
1 H, 2 He, 3 Li, 4 Be, 5 B, 6 C, 7 N, 8 O, 9 F, 10 Ne
vety, helium, litium, beryllium, boori, hiili, typpi, happi, fluori, neon
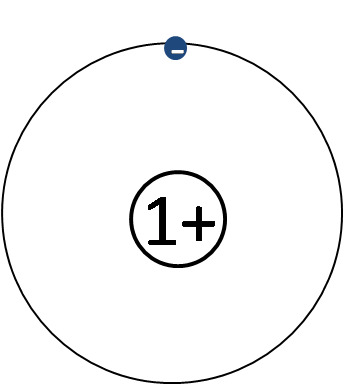
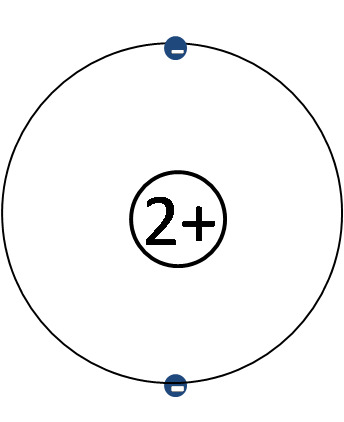
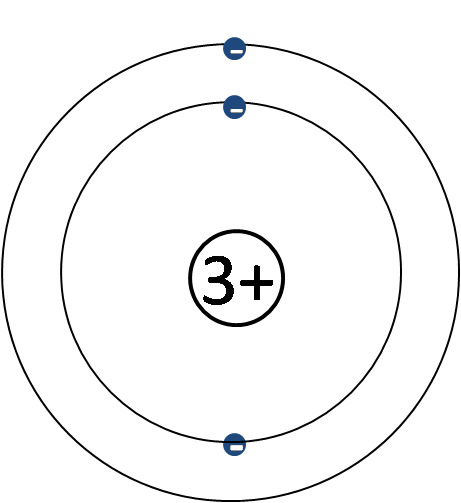
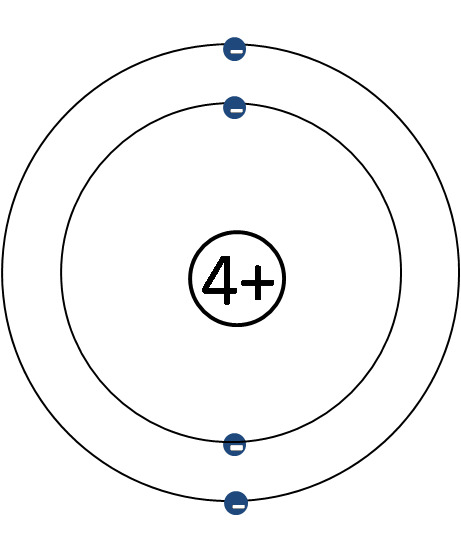
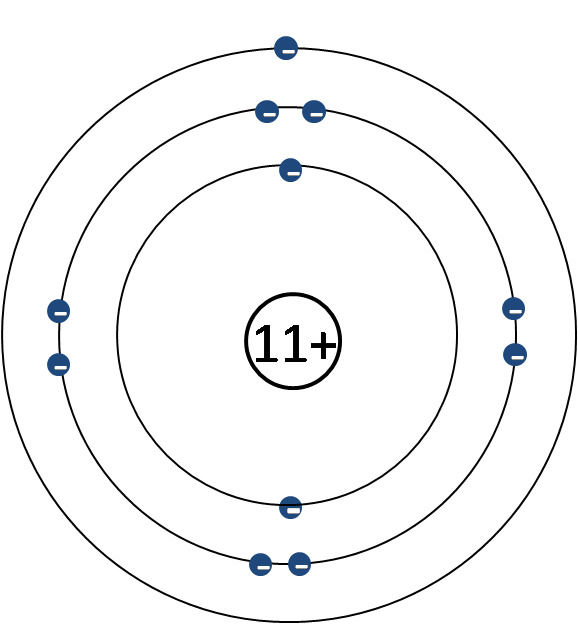
Kuorimalli
- Keskittyy elektronikuoriin ja elektroneihin
- Ytimen rakenne jätetään pois ja korvataan sen sähkövarauksella
- Ytimen sähkövaraus selviää alkuaineen järjestysluvusta (ja siten protonien lukumäärästä)
- Elektroneja tulee yhtä monta kuin ydinvaraus
Pistemalli
Pistemalli koostuu alkuaineen kemiallisesta merkistä ja sen ulkoelektroneista.
Tässä kuorimalliteorian alkuaineet pistemalleina ja mielenkiintoisesti järjestettynä.
Tästä alkaakin muodostua jaksollinen järjestelmä!
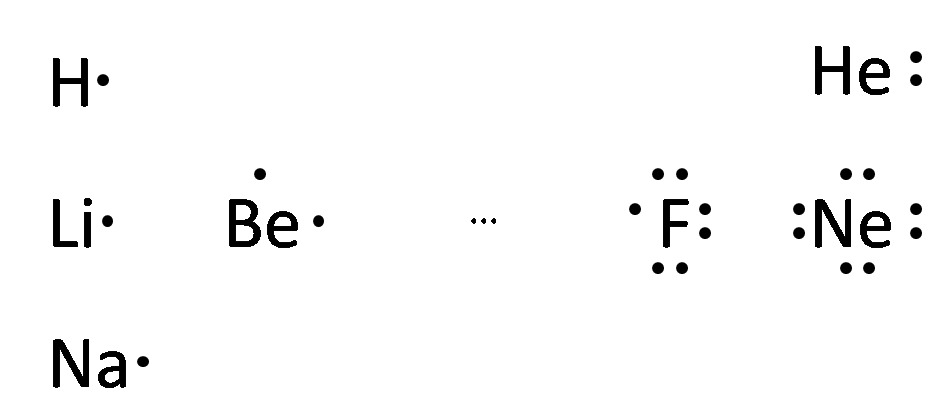
Yhteenveto malleista - hiiliatomi C eri mallinnuksilla
Jaksollinen järjestelmä
Johdanto
- 1800-luvulla alkuaineet osattiin järjestää atomipainoltaan kevyimmästä raskaimpaan.
- Alkuaineen järjestysnumero kasvaa tässä samassa järjestyksessä.
- Mendelejev havaitsi, että alkuaineet muodostavat ryhmiä, joiden ominaisuudet muistuttavat toisiaan
- Alkuaineet jaksotettiin riveittäin niin, että samankaltaiset ryhmät muodostuivat pystysarakkeisiin.
- Myöhemmin havaittiin, että jakso eli rivi merkitsee elektronikuorien lukumäärää ja ryhmästä eli sarakkeesta voi päätellä ulkoelektronien lukumäärän.
Tässä kohtaa oppitunnilla:
Alkuainekorttien järjestäminen
Oppilaan oman jaksollisen järjestelmän täyttäminen (aihio monisteena)
Linkki tulostettavaan pohjaan ja Malliratkaisu
Pääryhmät
- Alkalimetallit
Erittäin reaktiivisia
Pehmeitä metalleja (paitsi vety)
Muodostavat suoloja eli suolayhdisteitä varsinkin 6. tai 7. pääryhmän alkuaineiden kanssa
Ⓔ NaCl natriumkloridi eli ruokasuola
Natrium vedessä 200 g
Natrium vedessä 1 kg
Kalium vedessä 10 g - Maa-alkalimetallit
Reaktiivisia
Muodostavat tällöin suoloja
Ⓔ CaCl₂ kalsiumkloridi - Booriryhmä
Boori on kasveille välttämätön hivenaine - Hiiliryhmä
Hiil: orgaaninen kemia, pii ja germanium: mikropiirien puolijohteet - Typpiryhmä
Typpi ja fosfori ovat tärkeitä ravinteita, liiallisina rehevöittävät vesistöjä - Happiryhmä
Happimolekyylit O₂ kaasua
Rikkimolekyylit S₂ kiinteää
Happea ja rikkiä on useissa metallimalmeissa. - Halogeenit
Reaktiivisia epämetalleja, molekyyleinä
Kaasumaisia (F₂ ja Cl₂), nestemäisiä (Br₂) ja kiinteitä (I₂)
- Jalokaasut
Yksiatomisia kaasuja, He, Ne, Ar...
Passiivisia (ei reaktiivisia)
Eivät siis juuri muodosta yhdisteitä
Syynä oktettirakenne, kahdeksan ulkoelektronia
Ⓔ Vappupalloissa käytetään kevyttä heliumia, koska se on herkästi syttyvää vetyä turvallisempaa
Videolla onnettomuus, jossa vetykaasulla oli merkittävä osuus: Hindenburg
Oktetti
Atomin uloimmalla kuorella voi olla 1-8 elektronia (heliumilla 2)
Oktettitilassa uloin kuori on "täynnä" eli ulkoelektroneja on 8 (heliumilla 2)
Atomit "pyrkivät" oketettiin luovuttamalla, vastaanottamalla tai jakamalla ulkoelektroneja.
→ kemialliset sidokset
Poikkeuksena jalokaasut, joiden ei tarvitse.
Oktettitila on ns. matalimman energian tila, jossa aine on levollisinta ja sen reaktiohalut tipotiessään.
Elektronikuorien täyttäminen - säännöt
Kuorimallin piirtäminen jaksollisen järjestelmän avulla
- Elektronien määrä on sama kuin alkuaineen järjestysnumero
- 1. kuori täytetään ensin, mahtuu 2 elektronia (1. jakso)
- 2. kuori täytetään sitten, mahtuu 8 elektronia (2. jakso)
- Uloimmalle kuorelle elektroneja pääryhmän mukainen määrä (1-8)
- Jos kuoria on neljä, loput elektronit sijoitetaan 3. elektronikuorelle.
Atomin muuttuminen ioniksi
- elektroneja luovuttamalla (metallit)
- Elektroneja (-) on silloin vähemmän kuin protoneja (+)
- Muodostuu positiivinen (+) ioni
- Pääryhmien 1-3 alkuaineet, joilla on 1-3 ulkoelektronia
- Uloin kuori "häviää" ja sisemmästä kuoresta tulee uloin kuori.
Nyt uloimmalla kuorella on 2 tai 8 elektronia (oktetti)
- elektroneja vastaanottamalla (epämetallit)
- Elektroneja (-) on silloin enemmän kuin protoneja (+)
- Muodostuu negatiivinen (-) ioni
- Pääryhmien 5-7 alkuaineet, joilta "puuttuu" 1-3 elektronia
- Uloin kuori täyttyy,
Nyt uloimmalla kuorella on 8 elektronia (oktetti)
Ⓔ Muodostetaan ionit alkuaineista kalsium ja fluori jaksollisen järjestelmän avulla
- kalsium, Ca on 2. pääryhmän alkuaine
sillä on 2 ulkoelektronia
luovuttaa ne pois ja saa varauksen +2
muodostuu kalsiumioni Ca2+ - fluori, F on 7. pääryhmän alkuaine
sillä on 7 ulkoelektronia
vastaanottaa yhden elektronin ja saa varauksen -1
muodostuu fluoridi-ioni F−
Ionien nimeäminen
Metalli-ionit: lisätään alkuaineen perään ioni Ⓔ magnesium → magnesiumioni
Epämetalli-ionit: lisätään alkuaineen perään di-ioni Ⓔ jodi → jodidi-ioni
Epäsäännölliset taivutukset:
happi → oksidi-ioni
rikki → sulfidi-ioni
(typpi → nitridi-ioni)
HOX-taulu. Hiiliryhmä ja jalokaasut eivät muodosta ioneita kovin helposti.
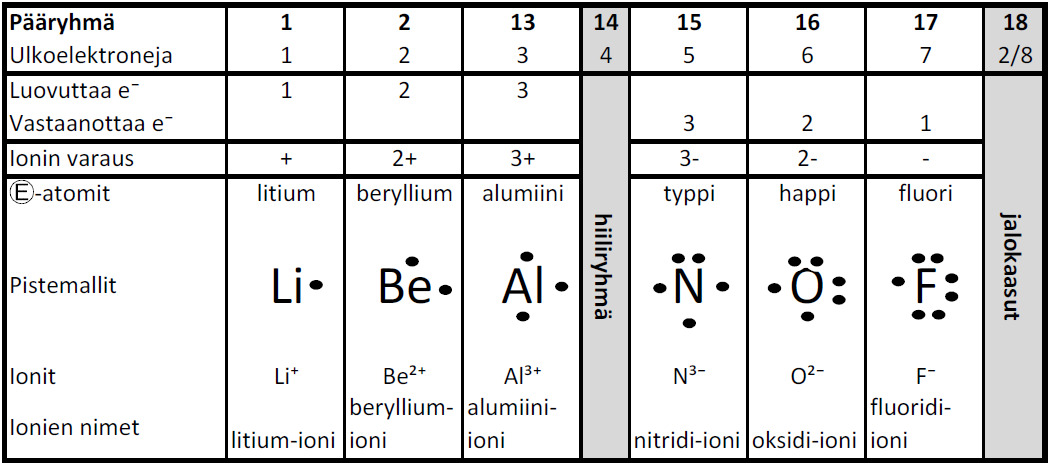
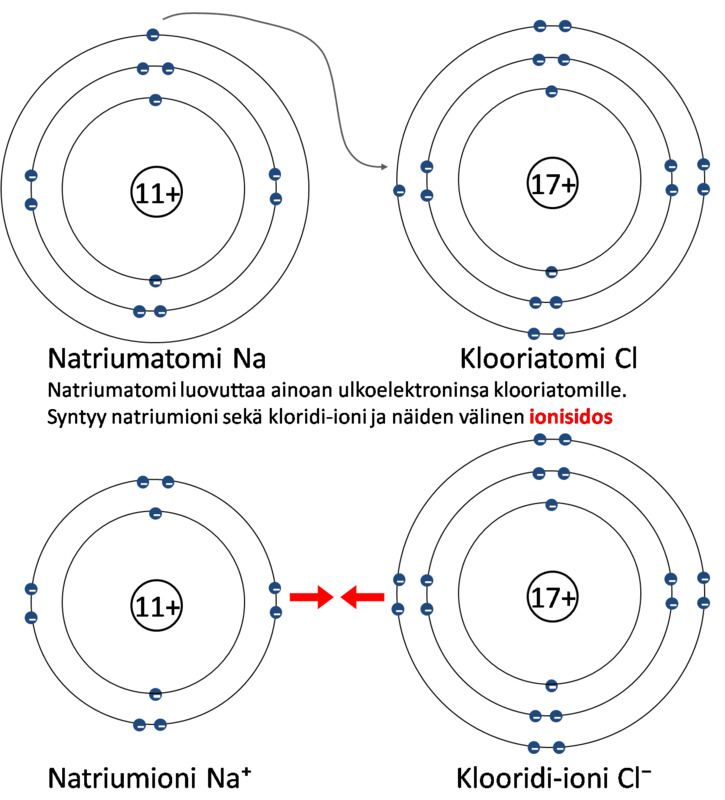
Ionisidos ja ioniyhdiste
Lisätietoa - ionisoitumisen reaktioyhtälöt
(Tämä esitystapa käydään huolellisemmin metallien kemiassa)
Natriumatomi luovuttaa elektronin ja muuttuu natriumioniksi:
Na → Na+ + e−

Klooriatomi vastaanottaa elektronin ja muuttuu kloridi-ioniksi:
Cl + e− → Cl−
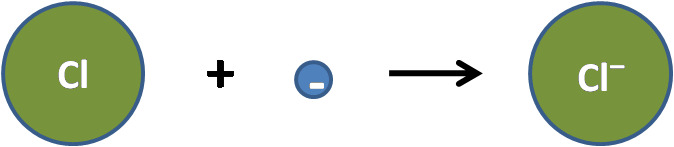
Yhdistelmä: kloori vastaanottaa elektronin natriumilta ja molemmat ionisoituvat
muodostaen natriumkloridia eli ruokasuolaa
Na + Cl → Na+ + Cl− → NaCl
Ioniyhdisteet ja niiden ominaisuudet
- ioniyhdistettä sitoo ionisidos
- se on positiivisen ja negatiivisen ionin välinen vuorovaikutus
- ioniyhdisteitä sanotaan suoloiksi
- muodostuvat metallista Ⓔ natrium ja epämetallista Ⓔ kloori
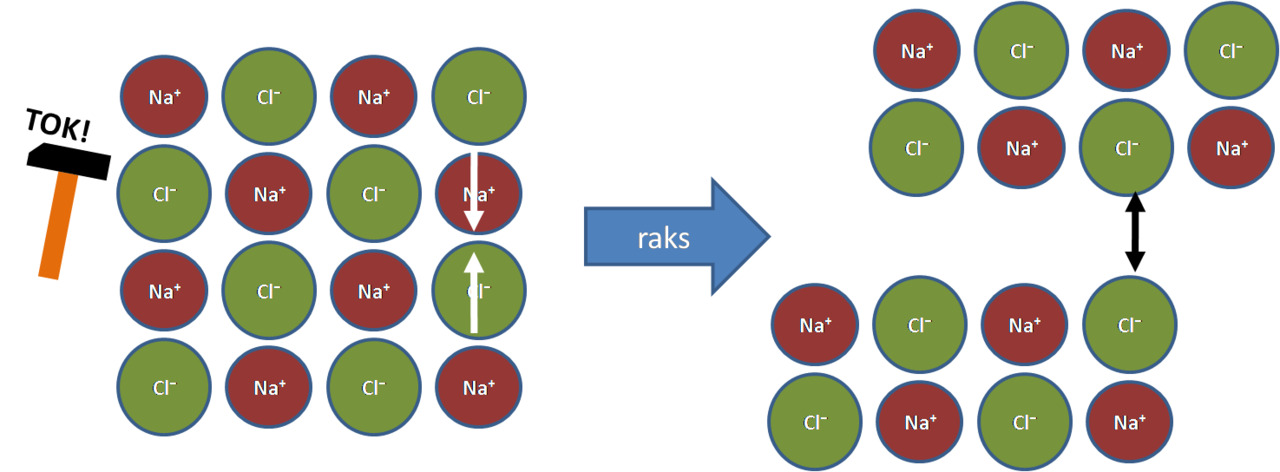
- kiinteinä kovia mutta hauraita, eivät johda sähköä
- sulatettuina tai vesiliuoksessa sähköä johtavia
- korkea sulamispiste
Kuva:
Vasen: Kide on kovaa, koska ionien paikat on tarkasti määrätty (puoleensa vetävä sähköinen vuorovaikutus)
Oikea: Kide on hauras. Kopautus liikauttaa samanmerkkiset ionit vierekkäin ja kide hajoaa (hylkivä sähköinen vuorovaikutus)
Nimeäminen ja kaava
- Metalli ennen epämetallia, epämetallissa di-pääte.
Ⓔ Natriumkloridi, NaCl - Ionien varaukset, + tai -, eivät näy kaavasta
- Ionien lukumäärä näkyy tarvittaessa alaindeksissä
Ⓔ Kalsiumkloridi, CaCl2
yhtä kalsiumionia kohden on kaksi kloridi-ionia
SYY:
Kalsiumionin varaus on +2 ja kloridi-ionin -1
Sähkövarausten pitää silti mennä tasan:
Ca2+ + 2 Cl− → CaCl2
SEURAUS:
Kalsiumkloridin pienin rakenneyksikkö sisältää yhden kalsiumionin ja kaksi kloridi-ionia

Moniatomiset ionit
Joitain moniatomisia ioneita on syytä tietää ja tunnistaa, koska niitä esiintyy usein käyttämissämme suolaliuoksissa.
- Nitraatti-ioni, NO3− ionin varaus -1 tärkeä
- Sulfaatti-ioni, SO42− ionin varaus -2 tärkeä
- Fosfaatti-ioni, PO43− ionin varaus -3 ei kovin tärkeä
- Ammoniumioni, NH4+ ionin varaus +1 tärkeähkö
Moniatomisten suoloja:
Ⓔ Ammoniumkloridi, NH4Cl - salmiakki
Ⓔ Kuparisulfaatti, CuSO4 - sininen suola ja liuos
Ⓔ Kuparinitraatti, Cu(NO3)2 - näin merkitään, että yhtä kupari-ionia kohden on kaksi nitraatti-ionia
Kahden suolan välinen reaktio
Kaksi suolaa eli ioniyhdistettä voidaan sekoittaa toisiinsa liuoksina
Suola + suola → kaksi uutta suolaa
Ⓔ natriumkloridi + hopeanitraatti → natriumnitraatti + hopeakloridi
NaCl + AgNO3 → NaNO3 + AgCl
Kuva: suolojen sekoituksessa kaikki neljä suolaa. Hopeakloridi kuitenkin saostuu pohjalle ja liuoksen veden kanssa muodostaa natriumnitraatti. Katso liukoisuustaulukkoa alempana.

Ioniyhdisteiden liukoisuustaulukko:

Ⓔ * Muodosta ja tasapainota kaliumfluoridin ja magnesiumkloridin reaktio ja tarkista sakka. Ratkaisu
Ⓔ *** Muodosta ja tasapainota kuparisulfaatin ja natriumnitraatin rektio ja tarkista sakka. Ratkaisu
Molekyylisidos ja molekyyliyhdisteet
Molekyyliyhdisteet ja niiden ominaisuudet
- Molekyyliä pitävät koossa molekyylisidokset eli kovalenttiset sidokset
- Jokainen sidos syntyy kahden epämetalliatomin välille
- Molekyylisidokset muodostuvat vierekkäisten atomien jakamista yhteisistä elektronipareista
- Sidoselektronit lasketaan ulkoelektroneiksi molemmille atomeille
- Molekyyliyhdisteitä on paljon ja hyvin erilaisia
- Eivät johda sähköä
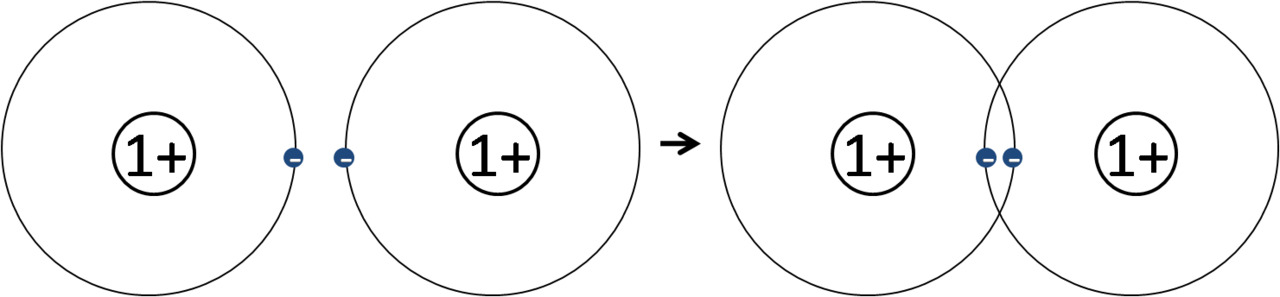
Vetymolekyylin, H2 muodostuminen kuorimallin avulla
Huom: vedyn oketti on 2 ulkoelektronia, koska vety on 1. jakson alkuaine.
Vesimolekyylin H2O muodostuminen kuorimallin avulla

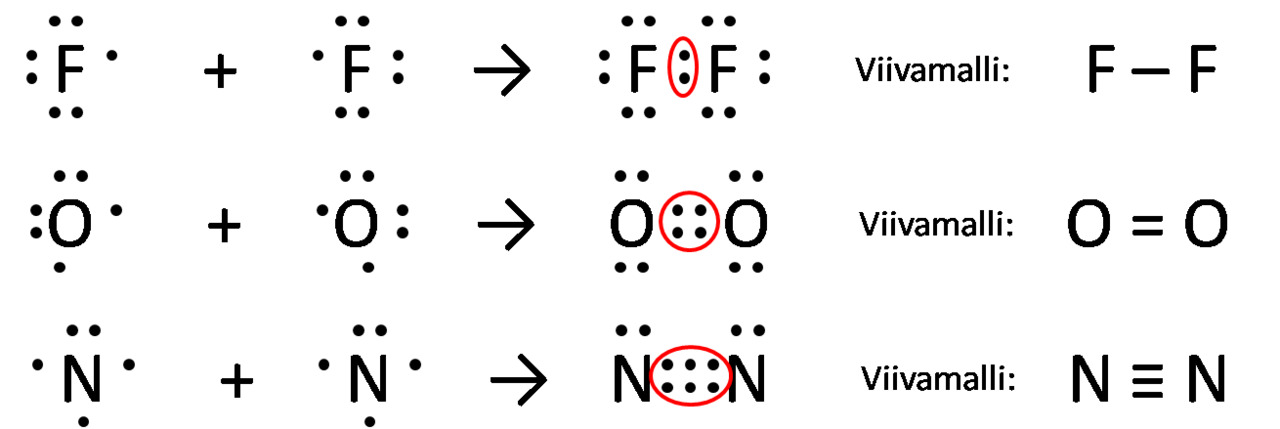
Yksöissidos, kaksoissidos ja kolmoissidos
Yksöissidoksessa on yksi pari yhteisiä elektroneja Ⓔ fluorimolekyyli, F2
Kaksoissidoksessa on kaksi kaksi paria yhteisiä elektroneja Ⓔ happimolekyyli, O2
Kolmoissidoksessa on kolme paria yhteisiä elektroneja Ⓔ typpimolekyyli N2
Näiden molekyylien sidokset voidaan selittää oktettisäännöllä:
Esim typpi N. Sille jäi kaksi omaa ulkoelektronia ja sidoksessa on kuusi.
Molekyylin N2 kummallakin typpiatomilla on siis 2+6=8 ulkoelektronia eli oktetti.
Harjoitustöissä käsitellään molekyylisidoksia vielä kuorimallien avulla.
Eräitä melko pienikokoisia molekyyliyhdisteitä:
vetysyanidi, hiilidioksidi, metaani, fluorometaani, vesi, etanoli, etaani, eteeni, etyyni, asetoni, muurahaishappo.
Eräitä monimutkaisia molekyyliyhdisteitä:
karoteeni, kapsaisiini, kofeiini, MTBE
Vetysyanidimolekyylin kuorimalli

Molekyyliyhdisteiden nimeäminen
Nimeäminen muistuttaa suolojen nimeämistä. Happi tai halogeeni tulee yleensä lopuksi ja saa di-päätteen.
Molekyyliyhdisteillä käytetään myös etuliitteitä, jotka osoittavat atomien lukumäärän (katso taulukko).
| etuliite | selitys | Ⓔ kaava | yhdisteen nimi |
| mono | yksi | CO | hiilimonoksidi eli häkä |
| di | kaksi | CO2 | hiilidioksidi |
| tri | kolme | SO3 | rikkitrioksidi |
| tetra | neljä | CCl4 | hiilitetrakloridi |
| penta | viisi | N2O5 | dityppipentaoksidi |
Päättele kemiallinen kaava seuraaville molekyyliyhdisteille:
- rikkidioksidi
- divetymonoksidin
- dihappidifluoridi
Metallisidos ja metallin rakenne
Metallisidos
- Metalliatomeilla on 1-3 ulkoelektronia
- Muodostaessaan kappaleen ne antavat ulkoelektroninsa kappaleen yhteiseen käyttöön
- Vapaat elektronit muodostavat ns. elektronien meren, joka liikkuu vapaasti ja koska eletronit ovat negatiivisia, ne vetävät puoleensa positiivisia metalli-ioneita. Näin rakenne pysyy koossa.
- Jos elektronit poistetaan kokonaan, metallin rakenne pettää. Silloin metalli esim. ruostuu tai liukenee veteen.
Litium muodostaa ionin: Li → Li+ + e− (tarkoittaa elektronia)

Alumiini muodostaa ionin: Al → Al3+ + 3 e−

Metallihilan rakenne litiumilla ja alumiinilla:

Osaisitko vielä piirtää kuorimallit litiumista ja alumiinista?
Ominaisuudet
- Tiheys - metallit ovat yleensä tiheitä, koska rakenneosat ovat lähellä toisiaan.
- Hyvä lämmönjohtavuus
SYY: tiheässä aineessa värähtelyt siirtyvät tehokkaasti metalli-ionilta toiselle - Hyvä sähkönjohtavuus
SYY: vapaat elektronit kuljettavat sähkövarausta - Sitkeys ja muokattavuus
SYY: vapaat elektronit toimivat liikkuvana liimana, joten ionien liikahtaminen Ⓔ vasaran iskusta ei yleensä riko metallisidoksia kuten ioniyhdisteessä
Metalliseos eli lejeerinki
- Metalleja käytetään harvoin puhtaina
- Esimerkiksi teräksessä raudan ominaisuuksia parannellaan seosmetallien avulla käyttötarkoituksen mukaan
(teräs sisältää tosin myös jonkin verran hiiltä, joka ei ole metalli) - Messinki on kuparin ja sinkin seos
- Pronssi on kuparin ja tinan seos
Lisätietoa, uudenvuodentina ja juotostina:
https://www.suomela.fi/uudenvuoden-tina-on-paaasiassa-lyijya
https://fi.wikipedia.org/wiki/Juotostina
Tinan sulamispiste: 232 °C
Lyijyn sulamispiste: 327 °C
Juotostinan (sisältää molempia) sulamispiste: alhaisimmillaan 183 °C
Erikoista. Metalliseoksen sulamispiste on alempi kuin kummankaan seosaineen sulamispiste.