Koekertaus
Jaksollinen järjestelmä
Pikakertaus
Allaoleva tukee valmistautumista mutta ei korvaa koealueen lukemista
Opettele alkuaineiden kemialliset merkit
H vety, He helium
Li litium, Be beryllium, B boori, C hiili, N typpi, O happi, F fluori, Ne neon,
Na natrium, Mg magnesium, Al, alumiini, Si pii, P fosfori, S rikki, Cl kloori, Ar argon
K kalium, Ca kalsium, Fe rauta, Cu kupari, Zn sinkki, Br bromi, Kr krypton
Ag hopea, Sn tina, I jodi, Xe ksenon
Pt platina, Au kulta, Hg elohopea, Pb lyijy, Rn radon
Paina mieleen jokin metalli ja jokin epämetalli
Muista metallien ominaisuudet
Opettele jaksollinen järjestelmä ja mihin sitä käytetään
Mikä on järjestysluku?
Mikä on jakso?
Mikä on pääryhmä? Ryhmän numero ja nimi!
Pääryhmien 1, 2, 17 ja 18 tärkeimmät ominaisuudet
Miksi happi-ionin sähkövaraus on 2- ja litiumionin +?
Miksi argon ei muodosta ionia eikä molekyylejä
Miksi metalli-ionien sähkövaraus on yleensä +, 2+ tai 3+
Mallit - kuva alhaalla
Atomin rakenne
Pallotikkumallien ja kalottimallien lukeminen esitietona
Tässä jaksossa:
1. Kuorimalli atomista, ionista tai molekyylistä
2. Pistemalli atomista ja molekyylistä, ionin muodostuminen pistemallin avulla
3. Viivamalli molekyylistä
Nämä kannattaa opetella tässä järjestyksessä!
Reaktioyhtälöt suolanmuodostuksessa:
Metalli + suolahappo, metalli + epämetalli, suolaliuos + suolaliuos
Ionien sekä ioni- ja molekyyliyhdisteiden kemialliset kaavat
Nimet
Ionit, ioniyhdisteet, molekyyliyhdisteet
esim: magnesiumioni ja kloridi-ioni, magnesiumkloridi, divetyoksidi ja hiilimonoksidi (etuliitteet)
Oktetti - kahdeksan ulkoelektronia
Poikkeus! Jos vain yksi elektronikuori, oktetti on kaksi.
Jalokaasuilla on oktetti
Muut atomit pyrkivät oktettiin sitoutumalla.
Ionien varaus voidaan päätellä oktetista.
Molekyylisidosten lukumäärä voidaan päätellä oktetista.
Sidostyyppejä on kolme ja ne perustuvat kaikki sähköiseen vuorovaikutukseen.
Kaikkia voidaan perustella myös sillä, että atomit saavat oktetin sidoksen muodostuessa.
Vuorovaikutus on sitä voimakkaampi, mitä suuremmat varaukset ovat ja mitä lähempänä varaukset ovat toisiaan.
Samanmerkkiset varaukset hylkivät toisiaan.
Erimerkkiset varaukset vetävät toisiaan puoleensa.
Opettele alkuaineiden kemialliset merkit
H vety, He helium
Li litium, Be beryllium, B boori, C hiili, N typpi, O happi, F fluori, Ne neon,
Na natrium, Mg magnesium, Al, alumiini, Si pii, P fosfori, S rikki, Cl kloori, Ar argon
K kalium, Ca kalsium, Fe rauta, Cu kupari, Zn sinkki, Br bromi, Kr krypton
Ag hopea, Sn tina, I jodi, Xe ksenon
Pt platina, Au kulta, Hg elohopea, Pb lyijy, Rn radon
Paina mieleen jokin metalli ja jokin epämetalli
Muista metallien ominaisuudet
Opettele jaksollinen järjestelmä ja mihin sitä käytetään
Mikä on järjestysluku?
Mikä on jakso?
Mikä on pääryhmä? Ryhmän numero ja nimi!
Pääryhmien 1, 2, 17 ja 18 tärkeimmät ominaisuudet
Miksi happi-ionin sähkövaraus on 2- ja litiumionin +?
Miksi argon ei muodosta ionia eikä molekyylejä
Miksi metalli-ionien sähkövaraus on yleensä +, 2+ tai 3+
Mallit - kuva alhaalla
Atomin rakenne
Pallotikkumallien ja kalottimallien lukeminen esitietona
Tässä jaksossa:
1. Kuorimalli atomista, ionista tai molekyylistä
2. Pistemalli atomista ja molekyylistä, ionin muodostuminen pistemallin avulla
3. Viivamalli molekyylistä
Nämä kannattaa opetella tässä järjestyksessä!
Reaktioyhtälöt suolanmuodostuksessa:
Metalli + suolahappo, metalli + epämetalli, suolaliuos + suolaliuos
Ionien sekä ioni- ja molekyyliyhdisteiden kemialliset kaavat
Nimet
Ionit, ioniyhdisteet, molekyyliyhdisteet
esim: magnesiumioni ja kloridi-ioni, magnesiumkloridi, divetyoksidi ja hiilimonoksidi (etuliitteet)
Oktetti - kahdeksan ulkoelektronia
Poikkeus! Jos vain yksi elektronikuori, oktetti on kaksi.
Jalokaasuilla on oktetti
Muut atomit pyrkivät oktettiin sitoutumalla.
Ionien varaus voidaan päätellä oktetista.
Molekyylisidosten lukumäärä voidaan päätellä oktetista.
Sidostyyppejä on kolme ja ne perustuvat kaikki sähköiseen vuorovaikutukseen.
Kaikkia voidaan perustella myös sillä, että atomit saavat oktetin sidoksen muodostuessa.
Vuorovaikutus on sitä voimakkaampi, mitä suuremmat varaukset ovat ja mitä lähempänä varaukset ovat toisiaan.
Samanmerkkiset varaukset hylkivät toisiaan.
Erimerkkiset varaukset vetävät toisiaan puoleensa.
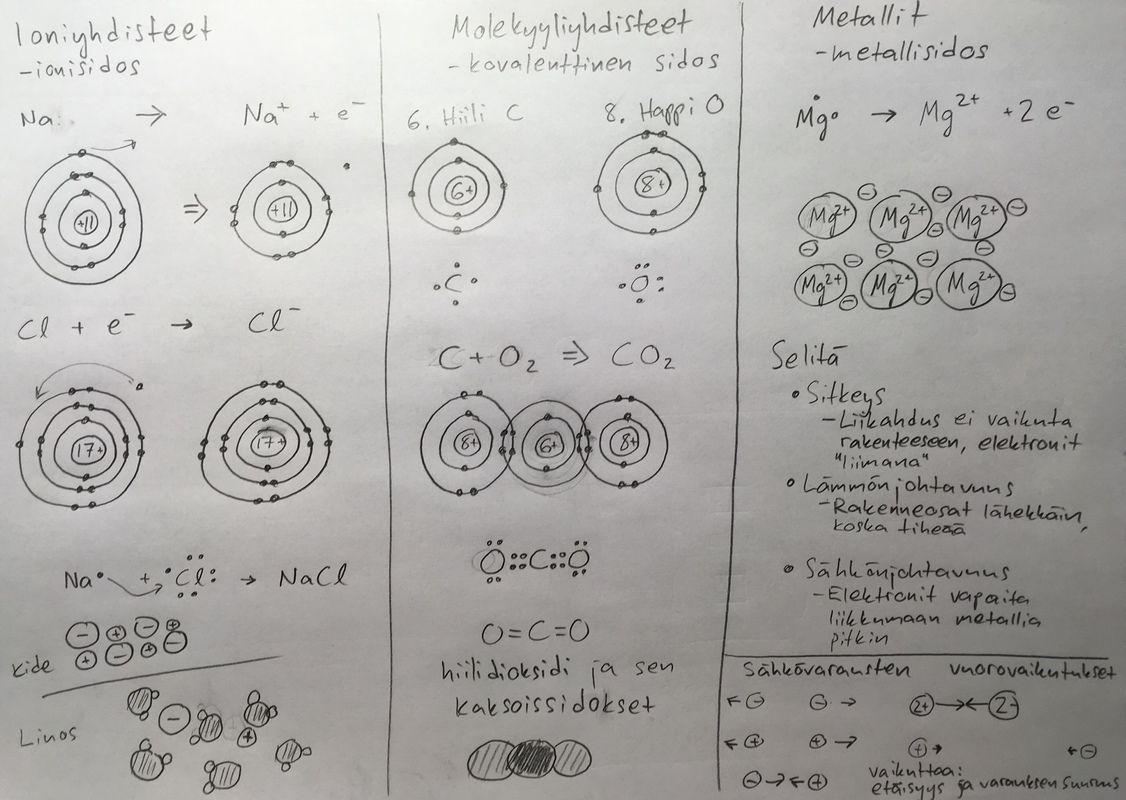
- Ionisidos sitoo ioniyhdisteen
- Muodostuu metalli-ionin ja epämetalli-ionin välille
- Positiiviset ja negatiiviset ionit ovat lähinnä toisiaan
- Oktetti saadaan luovuttamalla ja vastaanottamalla elektroneja
- Ioniyhdisteet eli suolat huoneenlämpötilassa kiinteitä
- Molekyylisidos pitää koossa yksittäisen molekyylin
- Muodostuu epämetalliatomien välille
- Sidos muodostuu jaetusta elektroniparista (tai pareista, kaksois- ja kolmois-)
- Oktetti saadaan, kun lasketaan yhteen omat ulkoelektronit ja yhteiset sidoselektronit
- Alkuainemolekyylit huoneenlämpötilassa usein kaksiatomisena kaasuna
- Happi, vety, typpi, kloori, fluori
- Molekyyliyhdisteet huoneenlämpötilassa kiinteitä, nesteitä tai kaasumaisia
- Metallisidos
- Muodostuu kahden metalli-ionin välille
- Vapaat elektronit toimivat liimana
- Oktetti saadaan päästämällä ulkoelektronit liikkumaan vapaasti metallihilassa
- Metallit huoneenlämpötilass kiinteitä (paitsi elohopea)
Malleja
Kaikki sidostyypit vielä kerran
Huomaa erikoinen sattuma: 3. jakson alkuaineilla kuten natrium ja kloori järjestysluku on sama kuin ryhmän numero.
Muissa jaksoissa näin ei toki ole.
Tarkista, että tiedät, miksi natriumilla on 1, hiilellä 4, hapella 6, kloorilla 7 ja magnesiumilla 2 ulkoelektronia.
Tarkista, muistatko näiden aineiden ryhmien nimet.
Kaikki sitoutuneet aineet alla ovat saavuttaneet oktetin. Tarkkaa itsellesi miten.