7. Kemiallinen reaktio
1. Virittäytyminen – voiko kemiallista reaktiota nopeuttaa?
2. Kemiallisia reaktioita arkielämässä
Kokemuksesta tiedämme ilotulitteen ulkoisen olemuksen olevan varsin erilainen ennen sen sytyttämistä ja räjähdyksen jälkeen. Samoin kuoritun omenan ja banaanin olemus muuttuu peruuttamattomasti, jos ne jätetään lojumaan suojaamattomina pöydälle. Jos pyörä jätetään pitkäksi ajaksi taivasalle, alttiiksi lialle ja sateelle, metalliosat menettävän hiljalleen niille tunnusomaisen kiillon ja kovuuden metallissa oleva raudan ruostuessa.

Räjähtäneen ilotulitteen palasista ei saa enää rakennettua alkuperäistä ilotulitetta eikä pilaantuneesta hedelmästä tuoretta tai ruosteisesta metallista kiiltävää, koska aineille on tapahtunut kemiallinen reaktio. Esimerkiksi puhdas rauta on kiiltävää, kovaa ja harmaata metallia, mutta ruostumisilmiössä muodostuva ruoste himmeää, haurasta ja punertavaa. Näin siksi, että rauta ja ruoste ovat tosiasiassa eri aineita. Aineita kuitenkin yhdistää se, että ruoste muodostuu raudasta. Rauta on ruosteen osa, toisin sanoen ilman rautaa ei olisi ruostettakaan.
Kemiallisissa reaktioissa lähtöaineista muodostuu uusia aineita uusin ominaisuuksin.
3. Kemiallisen reaktion tunnuspiirteet. TÄRKEITÄ SANOJA: KEMIALLINEN REAKTIO, LÄHTÖAINEET, REAKTIOTUOTTEET.
KEMIALLINEN REAKTIO ON TAPAHTUMA, JOSSA AINEET REAGOIVAT KESKENÄÄN JA MUUTTUVAT UUSIKSI AINEIKSI
Kemiallisia reaktioita: palaminen, ruostuminen, patinoituminen
Fysikaalisia tapahtumia: sulaminen, höyrystyminen, jähmettyminen
Fysikaalisissa tapahtumissa aine pysyy samana. Siksi ne eivät ole kemiallisia reaktioita.
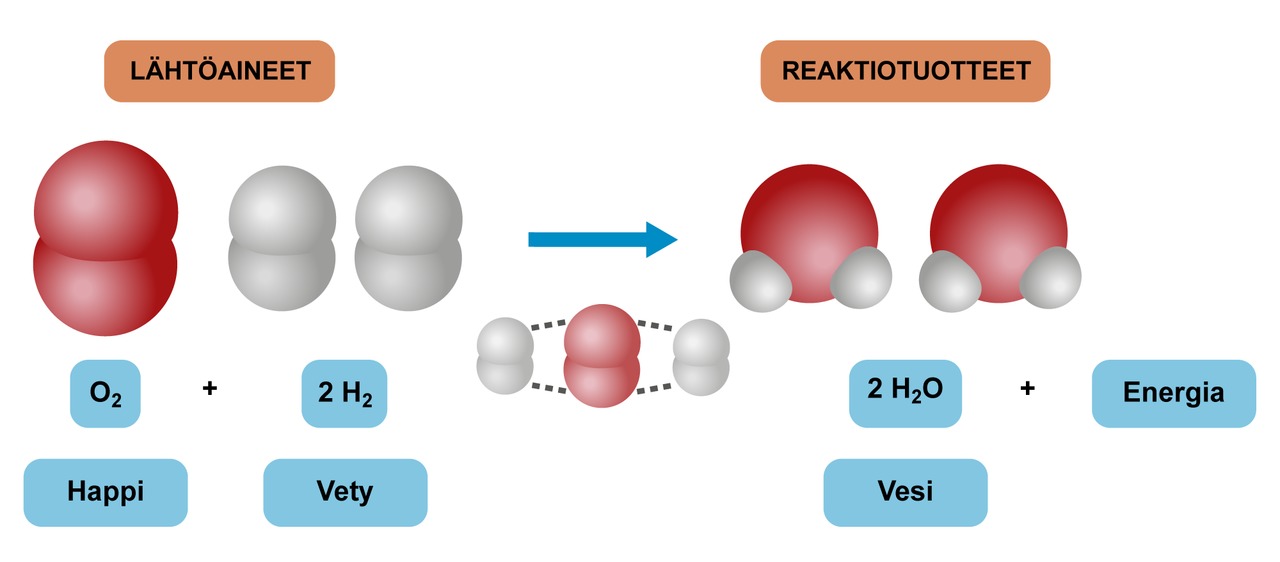
Opettaja valmistaa suolahapon ja metallin reaktiolla vetykaasua ja kerää sen koeputkeen. Toisella reaktiolla hän valmistaa vetyperoksidista mangaanioksidin avulla happea ja kerää sen samaan koeputkeen. Kaasuseosta lämmitetään tuomalla palava tulitikku koeputken suuaukolle. Kuumentuneet kaasut reagoivat herkästi. Reaktiotuotteena muodostuu vettä ja samalla vapautuu suuri määrä energiaa valona ja lämpönä.
Valo ja lämpö ovat peräisin happi- ja vetyatomien sitoutumisessa vapautuvasta energiasta. Vapautunut lämpöenergia kuumentaa tuotteena muodostuneen veden höyryksi. Höyry vaatii suuremman tilan kuin sama määrä vettä nesteenä, sillä höyry laajenee nopeasti ympäröivän ilman joukkoon ja muodostaa paineaallon. Korva aistii ilmanpaineen vaihtelut äänenä, mikä tässä tapauksessa havaitaan poksahduksena tai vingahduksena.
Esimerkki: vetykaasun muodostuminen
Esimerkkikokeessa kuumentaminen saa aikaan sen, että molekyylit törmäilevät toisiinsa yhä useammin ja yhä voimakkaammin. Monet törmäyksistä ovat sellaisia, että happi- ja vetymolekyylien atomit pääsevät riittävän lähelle toisiaan, mikä mahdollistaa reaktion niiden välillä. Lähtöainemolekyylien sisäiset sidokset heikkenevät ja uusia muodostuu happi- ja vetyatomien kesken. Lopulta alkuperäiset sidokset katkeavat ja lähtöaineatomit ryhmittyvät uudelleen siten, että jokaiseen happiatomiin liittyy kaksi vetyatomia. Reaktiotuotteena muodostuu uusi yhdiste vesimolekyylejä.
4. Yhteenveto tunnuspiirteistä.
| Kuvaus | Tarkastelutaso |
|---|---|
|
Atomitaso |
|
Havaintomaailma |
5. Stoikiometria tarkastelee reaktioon tarvittavien aineiden määriä.
Reaktiossa ei häviä mihinkään atomeja eikä niitä tule mistään lisää. Stoikiometria kiinnittää huomiota siihen, kuinka paljon lähtöaineita pitää olla, jotta kemiallinen reaktio tapahtuisi täydellisesti.
Täydellisesti tapahtuneessa kemiallisessa reaktiossa kaikki lähtöaineet kulutetaan loppuun ja niistä muodostuu reaktiotuotteet kokonaisuudessaan.

Epätäydellisesti tapahtuvassa reaktiossa jotakin tai joitakin lähtöaineita jää reagoimatta. Jos esimerkkikokeessa happea tai vetyä on ylimäärin eli enemmän kuin tarvitaan, se jää reagoimatta, kun kaikki toinen aine on kulutettu loppuun.

Harjoittele simuloimalla reaktioita
6. Reaktioyhtälön tasapainottaminen
Kemiassa kemialliset reaktiot kuvataan reaktioyhtälöillä. Harjoitellaan reaktioyhtälön kirjoittamista hapen ja vedyn välisellä reaktiolla.
Kemian reaktioyhtälöt kirjoitetaan seuraavasti: Kirjoitetaan vasemmalle lähtöaine tai -aineet, nuoli ([[$ \rightarrow $]]) väliin ja oikealle tuote tai tuotteet. Jos lähtöaineita tai tuotteita on useampi kuin yksi, niiden väliin laitetaan plus-merkki.
Esimerkki: hapen ja vedyn välisestä reaktiosta syntyy vettä
[[$ \text{vety}+\text{happi}\rightarrow \text{vesi} $]]Sama kemiallisin merkein:
[[$ \text{H}_{2}+\text{O}_{2}\rightarrow \text{H}_{2}\text{O} $]]
Hei, nyt meni jokin vikaan! Reaktioyhtälö ei ole tasapainossa.
Yllä esitetyssä esimerkissä vetyatomeja on kyllä molemmin puolin kaksi, mutta happiatomeja on lähtöaineiden puolella kaksi ja tuotteiden puolella vain yksi. Näin voit tasapainottaa tämän reaktioyhtälön:
[[$ 2\text{ H}_{2}+\text{O}_{2}\rightarrow 2 \text{ H}_{2}\text{O} $]]
Harjoittele simuloimalla
7. Kemiallisen reaktion käynnistyminen
Erilaisia kemiallisia reaktioita on olemassa valtava määrä. Pelkästään ihmisen kehossa niitä tapahtuu noin 400 miljardia. Jotkut reaktiot, kuten vedyn ja hapen välinen reaktio, ovat räjähtävän nopeita. Toiset, kuten raudan ruostuminen, ovat taas hyvin hitaita. Jotta törmäys johtaisi reaktioon, täytyy hiukkasten olla keskenään reagoimiskykyisiä, törmäysten on oltava riittävän voimakkaita ja niiden täytyy tapahtua oikeassa suunnassa.
Törmääminen oikeassa kulmassa – reaktio tapahtuu.
Törmääminen väärässä kulmassa – reaktiota ei tapahdu.
8. Reaktionopeuteen vaikuttavat tekijät, TÄRKEÄ
OPETTELE TUMMENNETUN KOHDAN SELITYKSET
Kemiallisen reaktion reaktionopeuteen vaikuttavat monet tekijät:
- ainepari eli mitkä aineet reagoivat keskenään
- lämpötila
- hienojakoisuus
- väkevyys
- tilavuus
- sekoitus
- olomuoto
- katalyytti.
1. Ainepari
Aineen kemiallinen koostumus ja sen atomirakenne määräävät sen, miten helposti aineet reagoivat keskenään. Yleensä aineet reagoivat keskenään sitä herkemmin, mitä kauempana toisistaan ne sijaitsevat alkuaineiden jaksollisessa järjestelmässä.
Aineen jaksollisesta järjestelmästä opit lisää pääluvussa Aineen rakenne.
2. Lämpötila, LUE TARKASTI
Hiukkasten liike-energia kasvaa, kun lämpötila kohoaa. Silloin myös reaktioon johtavien suotuisten törmäysten määrä aikayksikössä kasvaa. Tämän takia lämpötilan nostaminen yleensä nopeuttaa reaktioita. Vastaavasti reaktiot hidastuvat sitä enemmän, mitä kylmempää on. Lämpötilan kohottamista hyödynnetään ruoanvalmistuksessa ja lämpötilan laskemista ruoka-aineiden säilyttämisessä jääkaapissa. Myös kännykkä toimii kylmässä hitaammin, koska sähköä tuottavien reaktioiden nopeus on pienempi.
Oikeanpuoleisessa dekantterilasissa on korkeampi lämpötila.
3. Hienojakoisuus, LUE TARKASTI
Kemiallisen reaktion todennäköisyys kasvaa sitä suuremmaksi, mitä hienojakoisempaa aine on. Hienojakoisessa aineessa reagoivan aineen pinta-ala on suurempi, joten reaktioon johtavia törmäyksiä tapahtuu useammin. Hienojakoisuutta hyödynnetään esimerkiksi puiden pilkkomisessa. Vaarallisen suureksi pinta-ala kasvaa hienojakoisen pölyn kohdalla sahalla ja leipomossa, jossa aine voi syttyä palamaan räjähdyksenomaisesti.
4. Väkevyys
Aineiden väkevyys vaikuttaa samalla tavoin kuin pinta-alan kasvattaminen. Väkevässä liuoksessa on enemmän hiukkasia tilavuusyksikköä kohden kuin laimeassa liuoksessa, joten reaktioon johtavien suotuisten törmäysten lukumäärä on suurempi.
5. Tilavuus
Tilavuuden kasvaessa reagoivien aineiden pitoisuudet pienenevät ja siten myös reaktionopeus pienenee. Tilavuuden pienentäminen sen sijaan suurentaa reagoivien aineiden pitoisuutta.6. Sekoitus
Sekoittaminen vaikuttaa samalla tavalla kuin pinta-alan kasvattaminen. Sekoittaminen lisää reaktiopinta-alaa ja edistää reagoivien aineiden pääsemistä toistensa kanssa kosketuksiin.
Laboratoriossa sekoittaminen tehdään usein koneellisesti magneettisekoittajalla.
7. Olomuoto
Kemialliset reaktiot ovat mahdollisia kaikissa olomuodoissa. Kaasut ovat herkkäliikkeisempiä kuin nesteet ja nesteet herkkäliikkeisempiä kuin kiinteät aineet. Reaktiot kaasujen välillä tapahtuvat yleensä nopeimmin ja kiinteiden välillä hitaimmin. Nesteiden reaktiot ovat tältä väliltä. Olomuodon lisäksi merkittävästi vaikuttaa aineen kemiallinen koostumus. Esimerkiksi typpi kaasumaisena aineena on hyvin passiivinen, kun taas metallinen rauta reagoi helposti jo ilman hapen kanssa.
8. Katalyytti, LUE TARKASTI
Katalyytti on aine, joka nopeuttaa kemiallista reaktiota, mutta ei itse kulu reaktiossa. Se osallistuu kemialliseen reaktioon, mutta ei ole reaktion alku- tai lopputuote. Inhibiittori on aine, joka hidastaa reaktiota.
9. Energian vapautuminen ja sitoutuminen
 Osa kemiallisista reaktioista tuottaa ympäristöönsä energiaa, toiset taas tarvitsevat energiaa tapahtuakseen. Palava nuotio on hyvä esimerkki energiaa tuottavista reaktiosta. Kun puut ensin saadaan sytytettyä, palaminen jatkuu reaktiossa vapautuvan lämpöenergian ansiosta. Nuotion äärellä on hyvä lämmitellä, sillä puukuitujen kemiallisiin sidoksiin varastoitunut kemiallinen energia vapautuu lämpönä ympäristöön.
Osa kemiallisista reaktioista tuottaa ympäristöönsä energiaa, toiset taas tarvitsevat energiaa tapahtuakseen. Palava nuotio on hyvä esimerkki energiaa tuottavista reaktiosta. Kun puut ensin saadaan sytytettyä, palaminen jatkuu reaktiossa vapautuvan lämpöenergian ansiosta. Nuotion äärellä on hyvä lämmitellä, sillä puukuitujen kemiallisiin sidoksiin varastoitunut kemiallinen energia vapautuu lämpönä ympäristöön.
Tulitikun syttymiseen tarvittava energia otetaan raapaisusta. Kun tulitikku on kerran saatu sytytettyä, palaminen edistyy reaktiossa vapautuvan lämpöenergian ansiosta niin kauan kuin palavaa puuta on jäljellä ja happea saatavilla.

Kemiallisissa reaktioissa muodostuvasta lämmöstä voi olla vaaraa. Vanha kemian sananlasku opettaa "ensin vesi, sitten happo, muuten tulee käteen rakko". Loru on tärkeä, sillä monien happojen liuetessa veteen vapautuu lämpöenergiaa. Sitä voi vapautua niin paljon, että vesi höyrystyy ja polttavan kuumaa happoliuosta lentää ympäristöön.

Osa kemiallisista reaktioista sitoo energiaa ympäristöstään. Tämä havaitaan esimerkiksi liuoksen jäähtymisenä. Esimerkiksi yhteyttäminen on reaktio, joka tarvitsee energiaa tapahtuakseen. Samoin monet ruoanvalmistukseen liittyvät reaktiot ovat sellaisia, jotka vaativat energiaa tapahtuakseen, kuten kasvisten tai lihan kypsyminen.
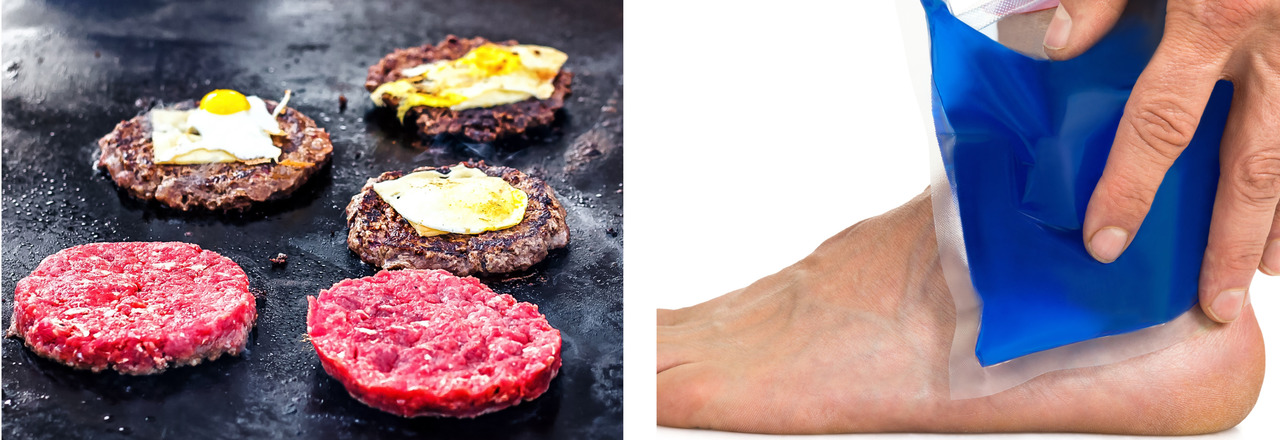
Ruoanvalmistuminen tarvitsee energiaa. Urheiluvammaan annetaan ensiapuna kylmää, joka sitoo energiaa vamma-alueelta ja hidastaa vammaan liittyviä kemiallisia reaktioita.
Tässä videossa nähdään ruokasoodan ja etikan välinen reaktio, jossa sitoutuu energiaa. Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat reaktiot ovat eksotermisiä reaktioita.
Tiivistelmä
- Kemiallisissa reaktioissa lähtöaineista muodostuu uusia aineita uusin ominaisuuksin.
- Kemiallinen yhdiste on kahdesta tai useammasta keskenään reagoineesta alkuaineesta koostuva aine.
- Täydellisesti tapahtuneessa kemiallisessa reaktiossa kaikki lähtöaineet kulutetaan loppuun.
- Epätäydellisessä reaktiossa lähtöaineita jää reagoimatta.
- Kemiallisessa reaktiossa ainetta ei häviä.
- Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat ovat eksotermisiä reaktioita.
- Kemiallisen reaktion reaktionopeuteen vaikuttavat monet tekijät, esim. ainepari, lämpötila, hienojakoisuus, sekoitus ja olomuoto.
- Katalyytti on aine, joka nopeuttaa kemiallista reaktiota, mutta ei itse kulu reaktiossa.
Syvennetään lopuksi vielä aineen rakenteen kokonaiskuvaa. Lisätään luvussa Atomit ja molekyylit tarkasteltuun aineiden luokittelu -kaavioon puhtaiden aineiden alle käsite "yhdiste".


