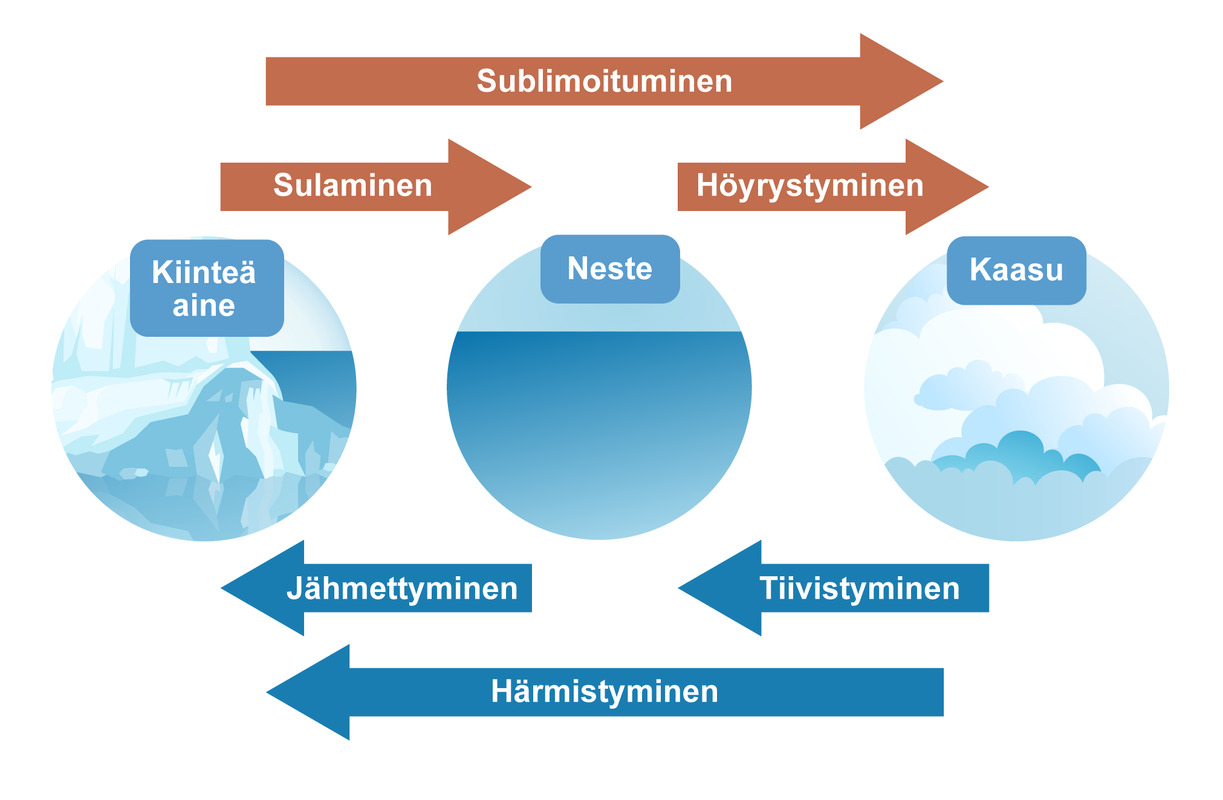
4.2 Aineen olomuodot
Aineen olomuodot ja niiden muutokset
Aineen olomuotoja ovat kiinteä, neste ja kaasu. Kaasumainen aine voi olla joko kaasua tai höyryä. Veden kiinteää olomuotoa kutsutaan jääksi. Jään sulaessa syntyy vettä, joka voi edelleen höyrystyä vesihöyryksi. Aineen olomuodot ja niiden muuntuminen toisikseen on esitetty oheisessa kaaviossa.
Kolmen perusolomuodon lisäksi aine voi esiintyä myös muissa olomuotojen kaltaisissa tiloissa. Tällaisia ovat esimerkiksi amorfinen aine sekä hyvin korkeissa lämpötiloissa esiintyvä plasma.
Aineen rakenne eri olomuodoissa
Aineen olomuodon muutokset selittyvät muutoksilla aineen rakenneosasten välisissä sidoksissa. Alhaisissa lämpötiloissa useimmat aineet ovat kiinteitä. Kiinteän aineen rakenneosat ovat sitoutuneet toisiinsa muodostaen hilarakenteen. Sidosten vahvuus vaihtelee eri aineilla, mikä ilmenee erilaisina sulamislämpötiloina. Aineen sulaessa sidokset hajoavat, mikä vaatii energiaa.
Olomuodon muuttuessa aineen rakenneosien väliset sidokset muuttuvat. Animaatio on muokattu lähteestä The Concord Consortium (http://concord.org).
![]() Avaa sovelluksena (engl.)
Avaa sovelluksena (engl.)
Kaasun molekyylien välillä ei ole juurikaan vuorovaikutuksia. Molekyylit liikkuvat vapaasti törmäillen toisiinsa sekä ympäristön pintoihin. Kaasun lämpötilan noustessa hiukkasten lämpöliike kasvaa, ja ne liikkuvat yhä vauhdikkaammin. Kaasun ominaisuuksia käsiteltiin tarkemmin luvussa "Kaasun tila ja tilanmuutokset".
Kaasun lämpötilan laskiessa sen rakenneosien lämpöliike hidastuu. Kaasumolekyylit sitoutuvat toisiinsa muodostaen nestettä. Sitoutuminen vapauttaa energiaa ympäristöön. Nesteen jäähdyttyä tarpeeksi alkavat rakenneosaset liittyä pysyvästi toisiinsa. Aineen olomuodon muuttuminen nesteestä kiinteäksi vapauttaa energiaa.
Olomuodon muutosten lämpötila
Tutkitaan veden lämmittämistä vedenkeittimessä. Mitataan veden lämpötilaa ajan suhteen sekä veden massaa.
Mittaustulokset:
veden_hoyrystyminen.ods
veden_hoyrystyminen.cmbl
veden_hoyrystyminen.cap
Veden lämpötila nousee, kunnes saavutetaan 100 °C. Tällöin on saavutettu veden kiehumispiste. Vaikka veteen siirtyy edelleen energiaa keittimestä, sen lämpötila ei muutu. Energia kuluu veden höyrystämiseen. Höyrystymisen aikana veteen siirtynyt energia rikkoo vesimolekyylien välisiä sidoksia ja saa vapaasti liikkuvat vesihöyrymolekyylit pakenemaan vesiastiasta. Höyrystyminen havaitaan veden massan pienenemisenä.
Veden sulaminen tapahtuu myös vakiolämpötilassa, joka on noin 0 °C. Veden sulamis- ja höyrystymislämpötilat (normaalipaineessa) ovat perusta lämpötilan Celsius-asteikolle. Tiivistyminen on höyrystymiselle käänteinen olomuodon muutos, ja molemmat tapahtuvat samassa lämpötilassa. Samoin aine jähmettyy samassa lämpötilassa kuin sulaa.
Veden höyrystymisen vaatima energia
Olomuodon muutoksissa aineeseen sitoutuu tai siitä vapautuu energiaa. Eri nesteiden molekyylien välisten sidosten vahvuudet ovat erilaisia, joten niiden höyrystymisen vaatima energia riippuu aineesta. Tarkastellaan veden höyrystymisen vaatimaa energiaa aiemman mittauksen nojalla.
Veden massan muutoksen havaittiin olevan veden höyrystyessä likimäärin tasaista. Jokaisen gramman höyrystymiseen kuluu yhtä suuri aika ja energia.
Kuvaajan kulmakerroin -0,000 881 1 kg/s kuvaa, kuinka monta kilogrammaa vettä höyrystyy sekunnissa. Tämän (itseisarvon) käänteislukuna saadaan yhden kilogramman höyrystymisen vaatima aika.
[[$ \quad \dfrac{1}{0{,}000\,881\,1\text{ kg/s}}=1\,134{,}9\dots\text{s/kg}\approx 1\,135\text{ s/kg}$]]
Mittauksessa käytetyn vedenkeittimen teho oli 2 000 W. Vakioteholla lämmitettäessä voidaan määrittää veteen tietyn ajan kuluessa siirtynyt lämpö:
[[$\quad P=\dfrac{Q}{t} $]], joten [[$ Q = Pt $]].
Yhden kilogramman höyrystymisen vaatima energia voidaan tämän perusteella laskea jouleina:
[[$\quad 1\,135\ \text{ s/kg} \cdot 2\,000\ \text{ W}= 2\,270\,000\ \text{ J/kg}$]]
Kerrannaisyksiköillä ilmaistuna tämä on 2 270 kJ/kg. Tätä veden ominaisuutta kutsutaan ominaishöyrystymislämmöksi. Tarkemmissa tutkimuksissa veden ominaishöyrystymislämmön taulukkoarvoksi on määritetty 2 256 kJ/kg.
Ominaissulamislämpö ja ominaishöyrystymislämpö
Sulamisessa tai höyrystymisessä aineeseen sitoutuu energiaa. Aineen jähmettyessä tai tiivistyessä vapautuu ympäristöön energiaa. Olomuodon muutokseen liittyy aineelle ominainen vakio: ominaissulamislämpö [[$(s)$]] tai ominaishöyrystymislämpö [[$(r)$]]. Nämä ilmaisevat olomuodon muutokseen liittyvän energian massayksikköä kohden.
Aineen sulamiseen vaaditaan energia [[$ Q=sm $]].
Aineen höyrystymiseen vaaditaan energia [[$ Q=rm $]].
- Ominaissulamislämpö [[$(s)$]] ja ominaishöyrystymislämpö [[$(r)$]] ovat aineelle ominaisia vakioita.
- [[$m$]] on aineen massa.
- Aineen jähmettyminen tai tiivistyminen vapauttavat vastaavan määrän energiaa kuin sulaminen tai höyrystyminen vaativat.
Aineeseen siirtyvä energia aiheuttaa joko aineen lämpenemistä tai olomuodon muutoksen. Aine lämpenee, kunnes saavuttaa olomuodon muutoksen vaatiman lämpötilan. Olomuodon muutoksen aikana aineen lämpötila ei muutu. Prosessia voidaan kuvata alla olevalla graafilla.
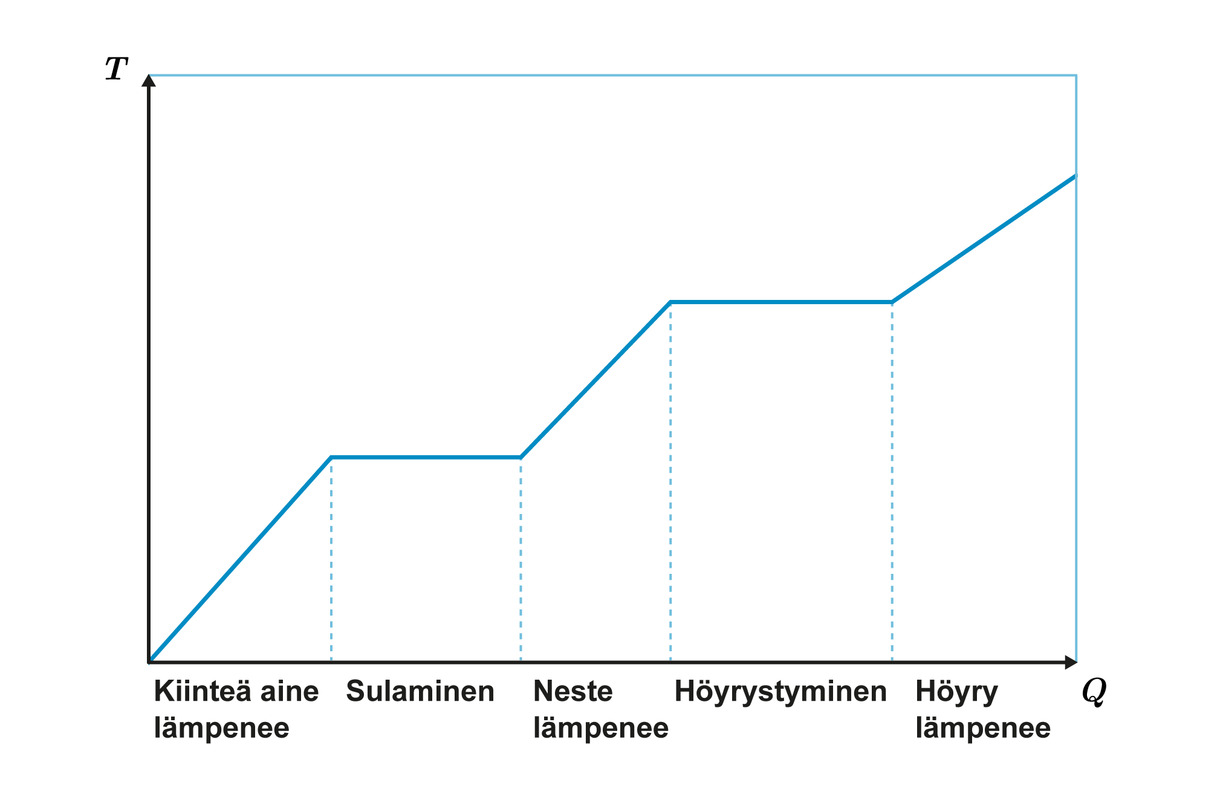
Aineen lämpötilan riippuvuus aineeseen tuodusta lämpöenergiasta. Alussa aine on kiinteää.
Pysähdy pohtimaan
Esimerkit
Esimerkki 1
10-asteisesta vedestä halutaan tehdä 850 g:n verran jääpaloja pakastimessa. Kuinka paljon energiaa vedestä tulee siirtää pois sen jäätymiseksi?
Esimerkki 2
Kiukaan kivien lämpökapasiteetti on 18 kJ/°C ja lämpötila 220 °C. Kiville heitetään 2,5 dl vettä, jonka lämpötila on 35 °C. Kuinka paljon kivien lämpötila muuttuu, kun vesi höyrystyy?
Esimerkki 3
 Uutenavuotena valettava tina on pääosin lyijyä, jonka sulamispiste on 322,7 °C ja ominaissulamislämpö 23 kJ/kg. Valettavan kappaleen massa on 85 g, ja se on sulamispisteessä.
Uutenavuotena valettava tina on pääosin lyijyä, jonka sulamispiste on 322,7 °C ja ominaissulamislämpö 23 kJ/kg. Valettavan kappaleen massa on 85 g, ja se on sulamispisteessä.
- Kuinka paljon energiaa sulatus vaatii?
- Kuinka kauan aikaa sulatus vaatii, jos käytettävän lämmittimen hyötyteho on 350 W?