2. Yhdisteiden muodostuminen ja nimeäminen
1. Virittäytyminen – mikä on kemiallinen sidos?
2. Kovalenttinen sidos
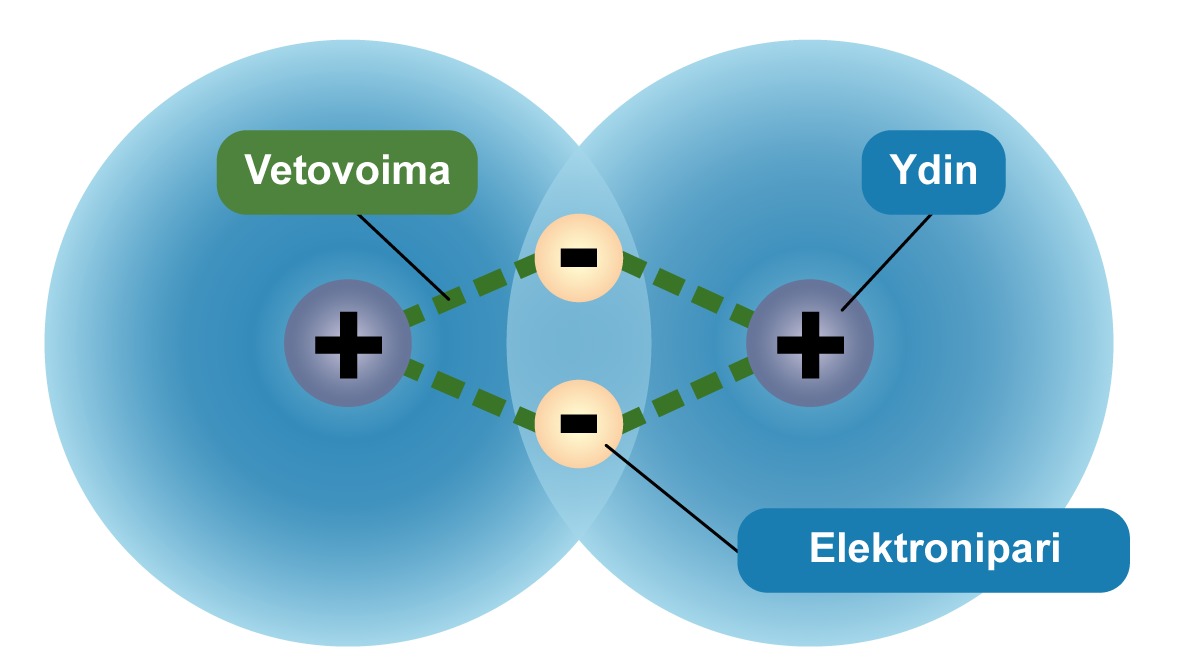
Kahden atomin lähestyessä toisiaan, niiden elektronipilvet ja ytimet vuorovaikuttavat keskenään. Positiivisesti varautuneet atomiymet ja negatiivisesti varautuneet elektronipilvet vetävät toisiaan puoleensa. Näin atomien välille muodostuu sähköinen vetovoima, jota kutsutaan kemialliseksi sidokseksi.
Sitoutuessaan toisiinsa atomit luovuttavat uloimman energiatason elektroninsa yhteiseen käyttöön. Elektronit muodostavat elektroniparin. Kaikkia elektroniparin muodostumiseen perustuvia sidoksia nimitetään kovalenttisiksi sidoksiksi. Kovalenttisella sidoksella muodostuvia yhdisteitä nimitetään molekyyleiksi.
Kuvassa on vetymolekyyli. Kummallakin vetyatomilla on yksi elektroni, jotka muodostavat yhteisen elektroniparin.
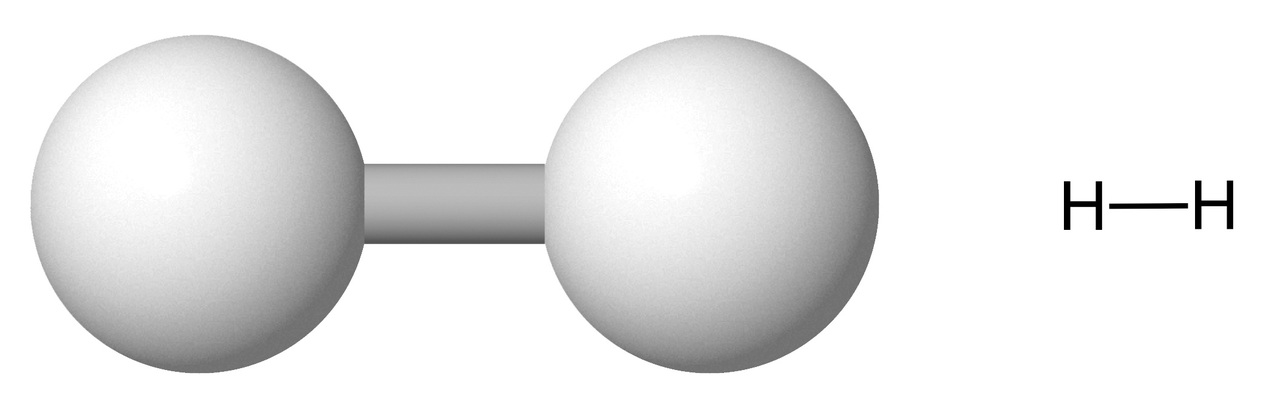
Ydinten välille merkitään sidosviiva, koska elektronit sijaitsevat suurimman osan ajasta niiden välissä.
Tässä animaatiossa on visualisoitu kovalenttisen sidoksen muodostumista elektronipilvien avulla. Aluksi kummallakin atomilla on itsenäinen elektronipilvi. Atomien lähestyessä toisiaan, kovalenttinen sidos muodostuu siinä vaiheessa, kun elektronipilvet alkavat sulautua yhteen. Sidos on vahva, sillä negatiivisesti varautunut elektronitihentymä toimii ikään kuin liimana, joka vetää puoleensa molempia positiivisesti varautuneita ytimiä.
3. Hiilen sidokset
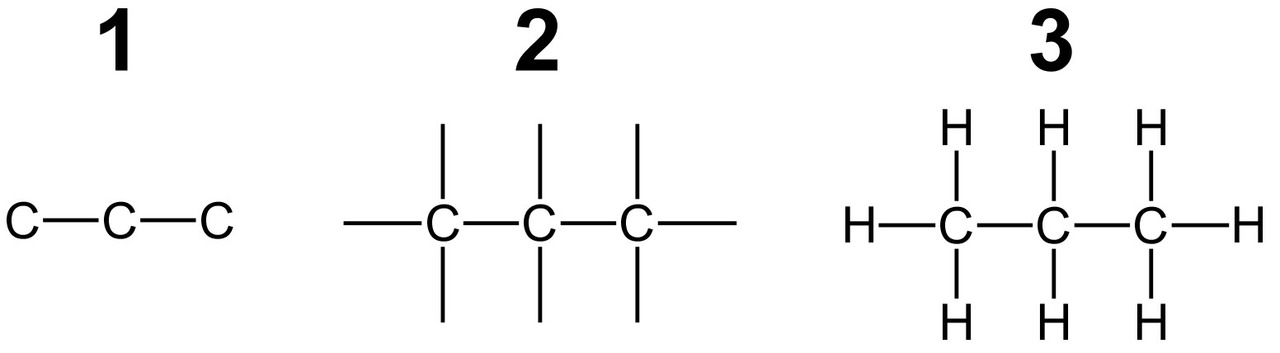
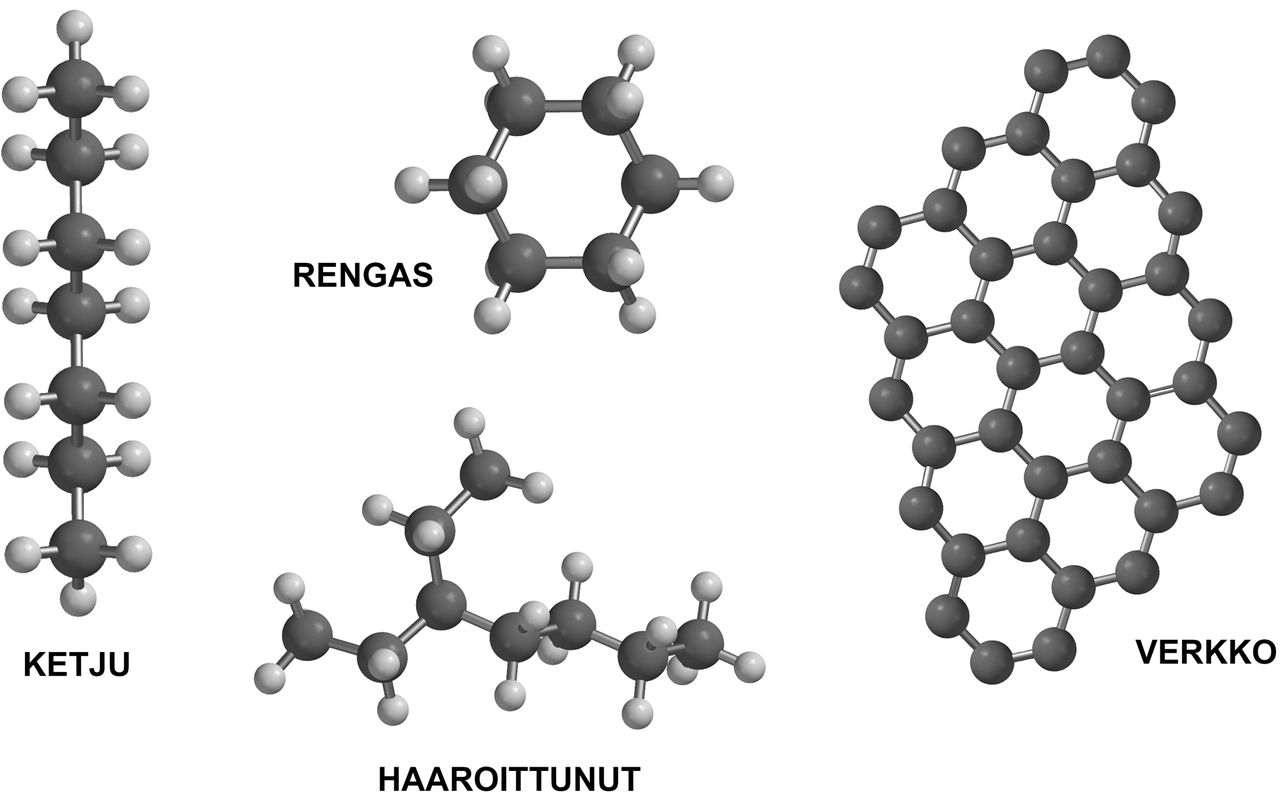
Hiiliatomit voivat ketjuuntua, ja ketjut voivat haarautua, muodostaa renkaita ja liittyä yhteen verkostoiksi.
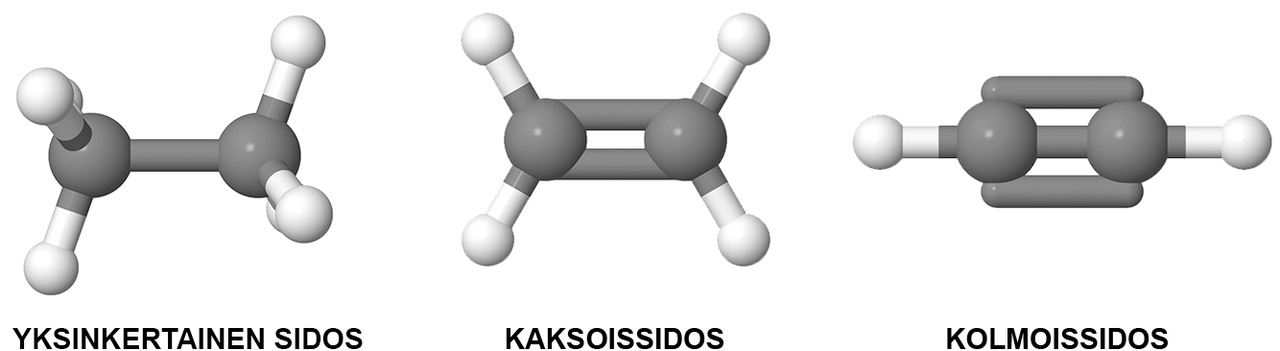
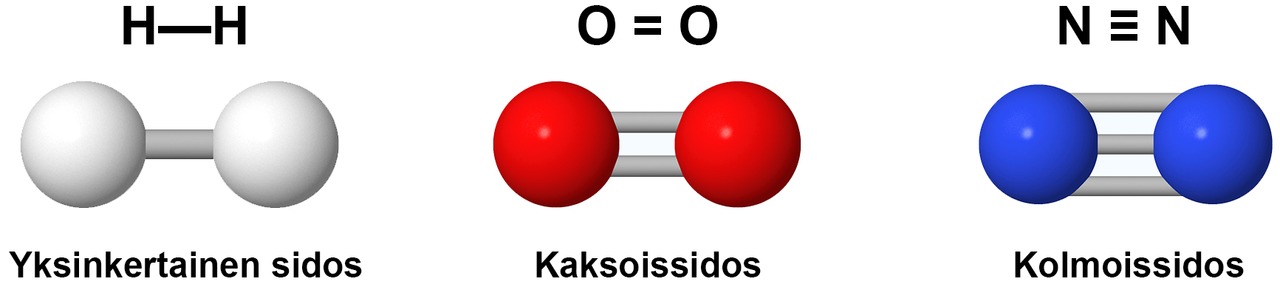
Hiiliatomit voivat muodostaa keskenään yksin-, kaksin-, tai kolminkertaisen sidoksen. Nelinkertainen sidos ei ole mahdollinen.
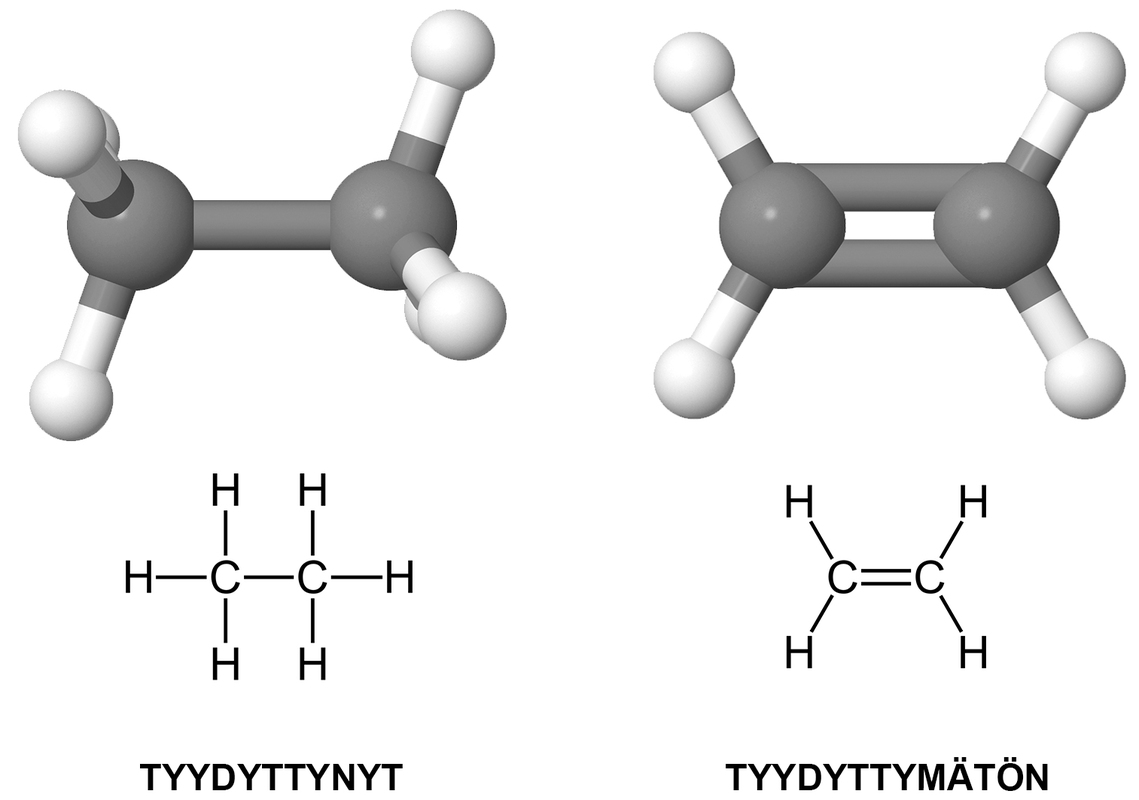
4. Tyydyttynyt ja tyydyttymätön yhdiste
Tyydyttyneessä yhdisteessä hiiliatomien välillä on vain yksinkertaisia sidoksia. Tyydyttymättömässä yhdisteessä on ainakin yksi kaksin- tai kolminkertainen sidos hiiliatomien välillä. Muita sidoksia ei huomioida. Esimerkiksi happiatomi voi liittyä hiileen kaksinkertaisella ja typpi kolminkertaisella sidoksella, mutta tällaisia sidoksia ei huomioida aineen tyydyttyneisyyttä tarkasteltaessa.
5. Molekyylimallinnus
Orgaanisten molekyylien kolmiulotteisia rakenteita voi tarkastella molekyylirakennussarjojen ja tietokoneohjelmistojen avulla. Molekyyleistä saa monipuolisen kuvan käyttämällä useita menetelmiä rinnakkain.
![]() Etaani
Etaani
Ohessa on esimerkkejä siitä, miten muovisilla molekyylisarjoilla mallinnetaan molekyylejä. Molekyylirakennussarjat ovat arvokkaita, joten pidä hyvää huolta atomipalloista ja sidostapeista.
Rakennekaavojen piirtäminen
Molekyylin rakennekaava voidaan havainnollistaa myös piirtämällä rakennekaava. Atomit kuvataan alkuaineiden kemiallisilla merkeillä kirjaimin ja ne yhdistetään toisiinsa sidosviivoilla. Yleisohje yksinkertaiset hiilivedyn piirtämiseen on seuraava:- Piirrä hiiliatomien muodostama runko ja yhdistä ne sidosviivoilla. Atomien lukumäärä selviää yhdisteen nimestä.
- Lisää jokaiseen hiiliatomiin niin monta sidosta, että jokaisesta hiilestä lähtee neljä sidosviivaa.
- Täydennä rakenne lisäämällä vetyatomit tyhjiin paikkoihin.
Hiiliatomi muodostaa aina neljä kovalenttista sidosta. Sidokset voivat olla yksin-, kaksin- tai kolminkertaisia. Vetyatomi voi muodostaa vain yhden sidoksen, joten siitä lähtee aina vain yksi sidosviiva. Hapesta ja rikistä lähtee kaksi sidosviivaa, typestä kolme. Hapen sidokset voivat olla yksin- tai kaksinkertaisia. Typen sidokset voivat olla yksin-, kaksin- tai kolminkertaisia.
6. Molekyylimallit
Käytetyistä malleista on saattanut jäädä mielikuva, että molekyyliin sitoutuneet atomit ovat liikkumatta samoilla paikoillaan. Tämä ei ole totta. Kemialliseen sidokseen osallistuvat atomit loittonevat ja lähentyvät toisiaan hyvin nopeaan tahtiin, toisin sanoen värähtelevät jousen lailla. Lisäksi atomit voivat keinua sidoksen varassa ja yksinkertainen sidos toimii kuin pyörän akseli. Sen päissä olevat ja niihin sitoutuneet atomit muodostavat atomiryhmän, joka pyörii hyrrän lailla.
Tietokoneavusteisessa mallinnuksessa on se hyvä puoli, että ennen kuin molekyylin malli tulostuu tietokoneen ruudulle, ohjelma on laskenut kullekin atomille koko molekyylin kannalta edullisimman ja samalla todennäköisimmän paikan. Kun laskemalla saatuja molekyylien geometrioita on verrattu kokeellisiin tuloksiin, eri menetelmillä saadut tulokset ovat hämmästyttävän lähellä toisiaan. Lisäksi näillä ohjelmilla voidaan mallintaa ja visualisoida edellä mainittuja yksittäisten atomien ja atomiryhmien liikkeitä molekyylissä.
Kemian osa-aluetta, joka pyrkii kehittämään tarkempia laskentamenetelmiä myös sellaisten molekyylien ominaisuuksien selvittämiseksi, joita on kokeellisesti mahdotonta tutkia, kutsutaan laskennalliseksi kemiaksi.
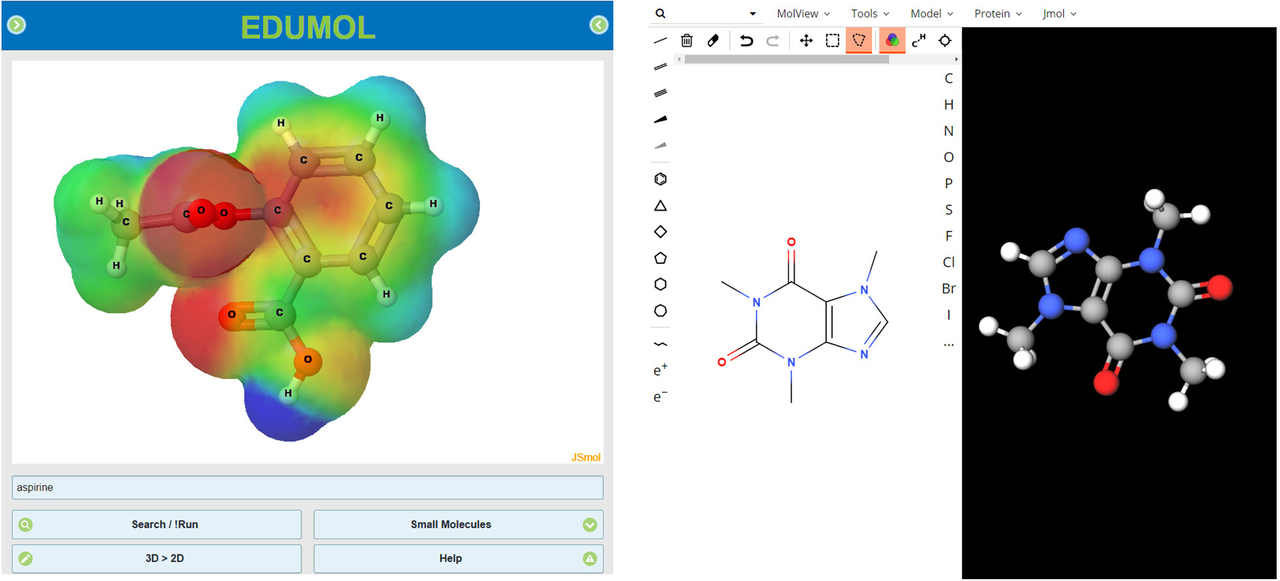
Nykyään kemian opintojen tueksi voi ladata ilmaisia molekyylimallinnusohjelmistoja älypuhelimiin tai käyttää ohjelmistoja suoraan verkossa. Kuvassa on esimerkkejä ilmaisista verkkosovelluksista. Vasemmalla Edumol ja oikealla MolView.
Lääketehtaat säästävät valtavia summia rahaa, kun lääkekemistit pystyvät mallintamaan mahdollisia uusia lääkemolekyylejä. Tietokonemallinnuksella pystyy sulkemaan pois tutkimuksesta sellaiset molekyylit, jotka eivät kemiallisesti sovellu tietyn sairauden hoitoon. Näin säästytään kalliilta laboratoriokokeilta.
7. Minkä atomien välille muodostuu kovalenttisia sidoksia?
Kovalenttinen sidos on kemiallisen sitoutumisen perusmuoto. Kaikki muut sidostyypit ovat kovalenttisen sidoksen muunnelmia. Muut yleisimmät sidostyypit ovat vetysidos, metallisidos ja ionisidos.
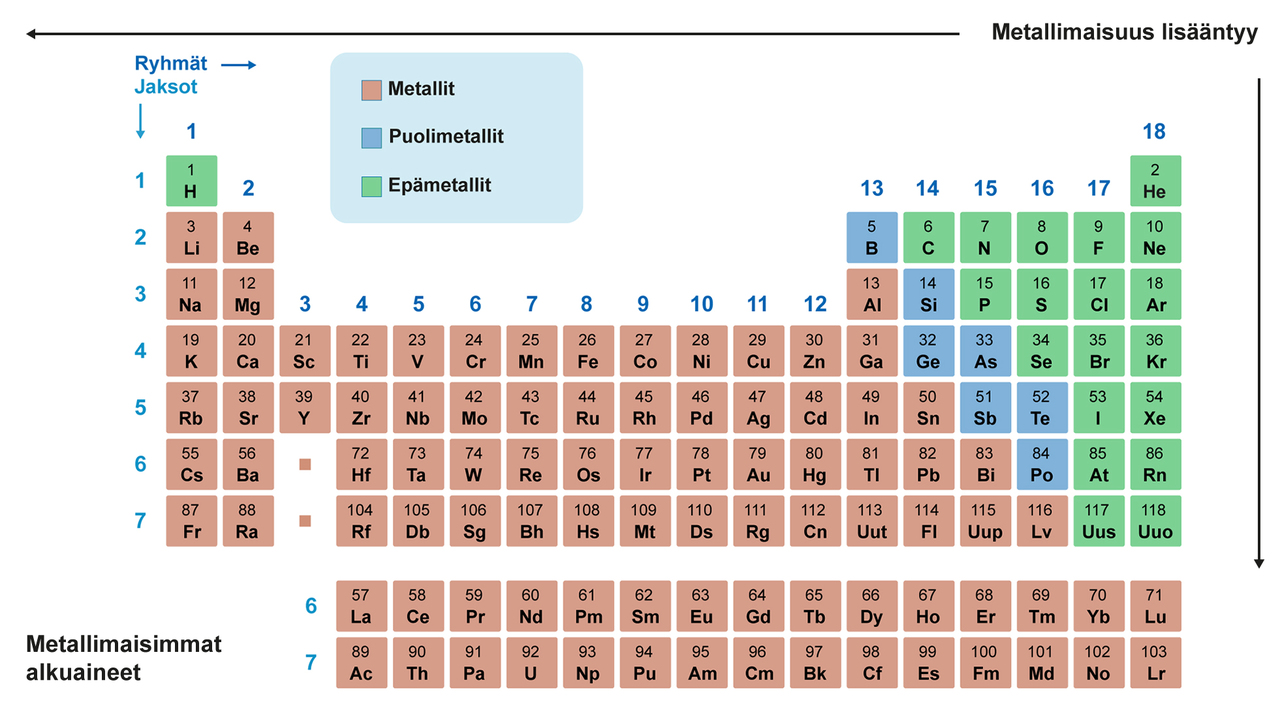
Kovalenttinen sidos on sitä todennäköisempi, mitä lähempänä toisiaan aineet sijaitsevat jaksollisessa järjestelmässä. Epämetallit sitoutuvat pääasiassa kovalenttisella sidoksella. Mitä kauempana aineet toisistaan sijaitsevat, sitä todennäköisempää on ionisidoksellinen sitoutuminen. Metallit liittyvät yhteen metallisidoksella, joka on kovalenttisen sidoksen muunnelma.
8. Hiiliyhdisteiden nimeäminen
Onneksi orgaaniset yhdisteet nimetään rakenteen perusteella. Yhdisteen nimi koostuu etuliitteestä ja loppuosasta.
Yhdisteen nimen etuliite määräytyy hiiliatomien lukumäärän mukaan. Yhdiste, jossa on yksi hiiliatomi, saa etuliitteeksi met-. Yhdiste, jossa on kaksi hiiliatomia, saa etuliitteekseen et-. Kolmesta kuuteen hiilen mittaisilla ketjuilla etuliitteet ovat vastaavasti prop- (3), but- (4), pent- (5) , heks- (6).
Nimen loppuosa määräytyy orgaanisen yhdisteryhmän perusteella. Esimerkiksi vain hiilestä ja vedystä rakentuva hiilivety, jossa hiiliatomien välillä on vain yksinkertaisia sidoksia, saa loppupäätteekseen -aani. Jos hiiliatomien välillä on yksinkin kaksoissidos, loppupääte on -eeni. Näistä opit lisää seuraavissa luvuissa.
| Hiiliatomien lukumäärä | Nimen etuliite | Esimerkkejä orgaanisten molekyylien nimistä |
|---|---|---|
| 1 | met- | metaani, metanoli, metaanihappo |
| 2 | et- | etaani, eteeni, etyyni, etanoli, etaanihappo |
| 3 | prop- | propaani, propeeni, propyyni, propanoli, propaanihappo |
| 4 | but- | butaani, buteeni, butyyni, butanoli, butaanihappo |
| 5 | pent- | pentaani, penteeni, pentyyni, pentanoli, pentaanihappo |
| 6 | heks- | heksaani, hekseeni, heksyyni, heksanoli, heksaanihappo |
| 7 | hept- | heptaani, hepteeni, heptyyni, heptanoli, heptaanihappo |
| 8 | okt- | oktaani, okteeni, oktyyni, oktanoli, oktaanihappo |
| 9 | non- | nonaani, noneeni, nonyyni, nonanoli, nonaanihappo |
| 10 | dek- | dekaani, dekeeni, dekyyni, dekanoli, dekaanihappo |
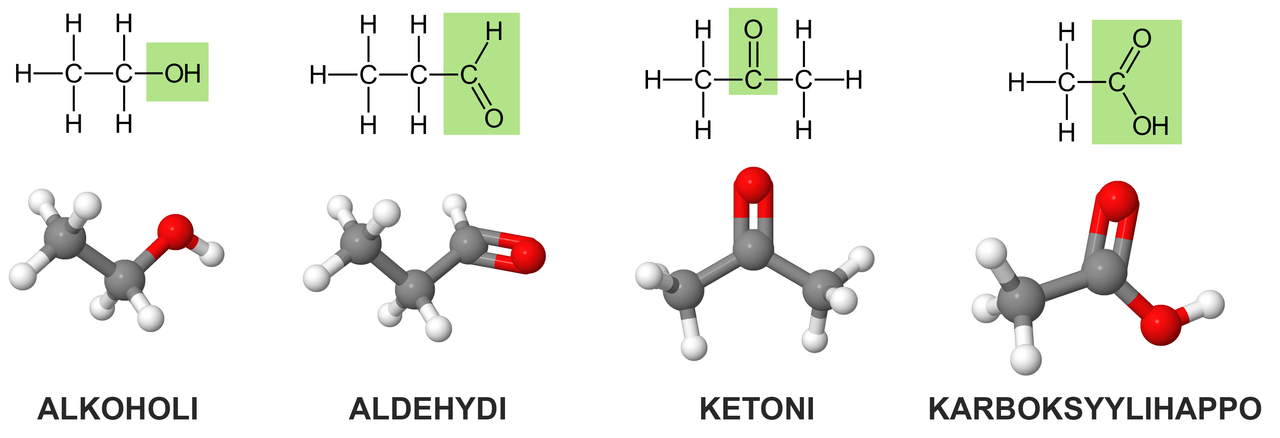
9. Yhdisteiden toiminnalliset kohdat
Orgaanisissa yhdisteissä on kohtia, jotka muuttuvat kemiallisessa reaktiossa muita kohtia helpommin. Tällaisia kohtia nimitetään toiminnallisiksi kohdiksi tai toiminnallisiksi ryhmiksi. Toiminnallisia kohtia ovat hiiliatomien väliset kaksois- ja kolmoissidokset. Toiminnallisia ryhmiä on monia, ja niistä tutuimpia ovat alkoholi- tai karboksyylihapporyhmät.
Tiivistelmä
- Atomien välistä sähköistä vetovoimaa kutsutaan kemialliseksi sidokseksi.
- Kaikkia elektroniparin muodostumiseen perustuvia sidoksia nimitetään kovalenttisiksi sidoksiksi.
- Hiiliatomin uloimmalla energiatasolla on neljä elektronia, joten se muodostaa neljä sidosta.
- Hiiliatomit voivat ketjuuntua, ja ketjut voivat haarautua, muodostaa renkaita ja liittyä yhteen verkostoiksi.
- Atomit ovat jatkuvassa liikkeessä ja molekyylit värähtelevät koko ajan.