2. Kovalenttinen sidos
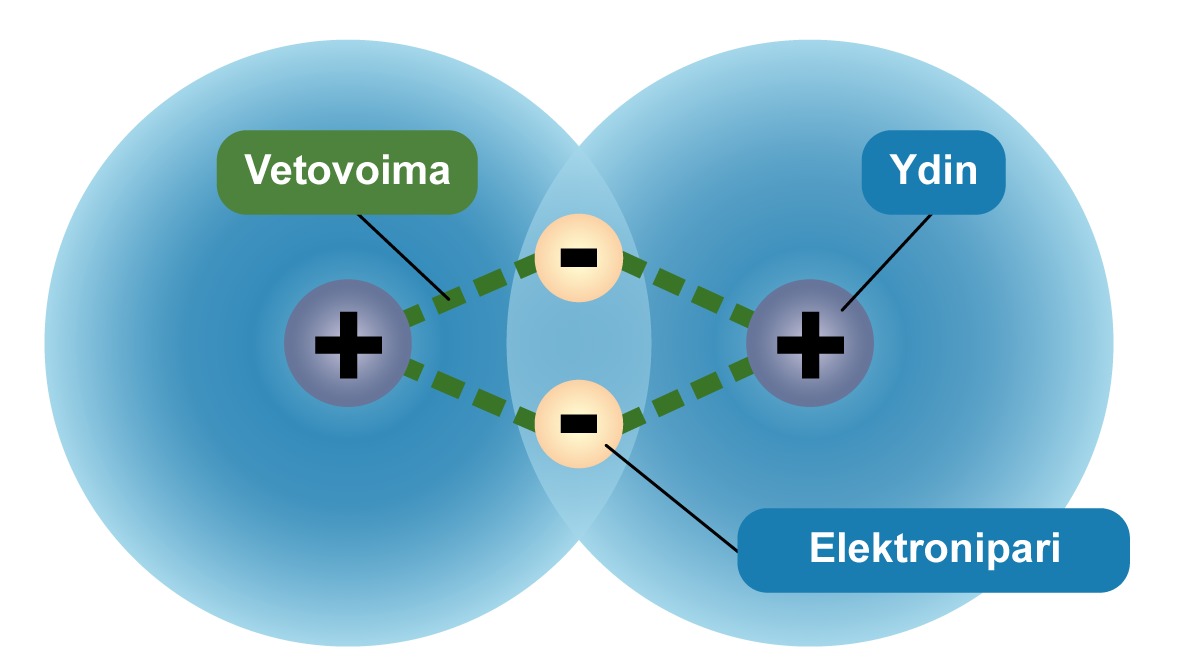
Kahden atomin lähestyessä toisiaan, niiden elektronipilvet ja ytimet vuorovaikuttavat keskenään. Positiivisesti varautuneet atomiymet ja negatiivisesti varautuneet elektronipilvet vetävät toisiaan puoleensa. Näin atomien välille muodostuu sähköinen vetovoima, jota kutsutaan kemialliseksi sidokseksi.
Sitoutuessaan toisiinsa atomit luovuttavat uloimman energiatason elektroninsa yhteiseen käyttöön. Elektronit muodostavat elektroniparin. Kaikkia elektroniparin muodostumiseen perustuvia sidoksia nimitetään kovalenttisiksi sidoksiksi. Kovalenttisella sidoksella muodostuvia yhdisteitä nimitetään molekyyleiksi.
Kuvassa on vetymolekyyli. Kummallakin vetyatomilla on yksi elektroni, jotka muodostavat yhteisen elektroniparin.
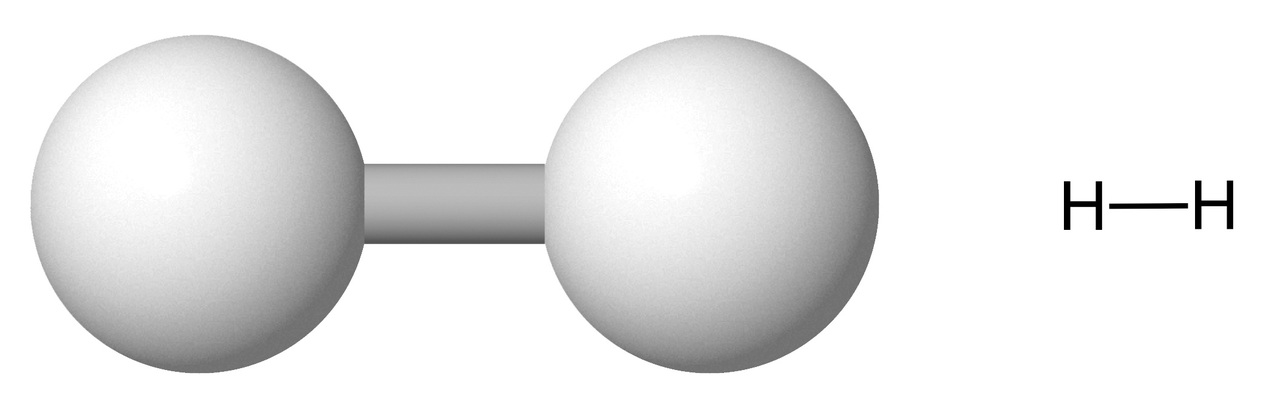
Ydinten välille merkitään sidosviiva, koska elektronit sijaitsevat suurimman osan ajasta niiden välissä.
Tässä animaatiossa on visualisoitu kovalenttisen sidoksen muodostumista elektronipilvien avulla. Aluksi kummallakin atomilla on itsenäinen elektronipilvi. Atomien lähestyessä toisiaan, kovalenttinen sidos muodostuu siinä vaiheessa, kun elektronipilvet alkavat sulautua yhteen. Sidos on vahva, sillä negatiivisesti varautunut elektronitihentymä toimii ikään kuin liimana, joka vetää puoleensa molempia positiivisesti varautuneita ytimiä.