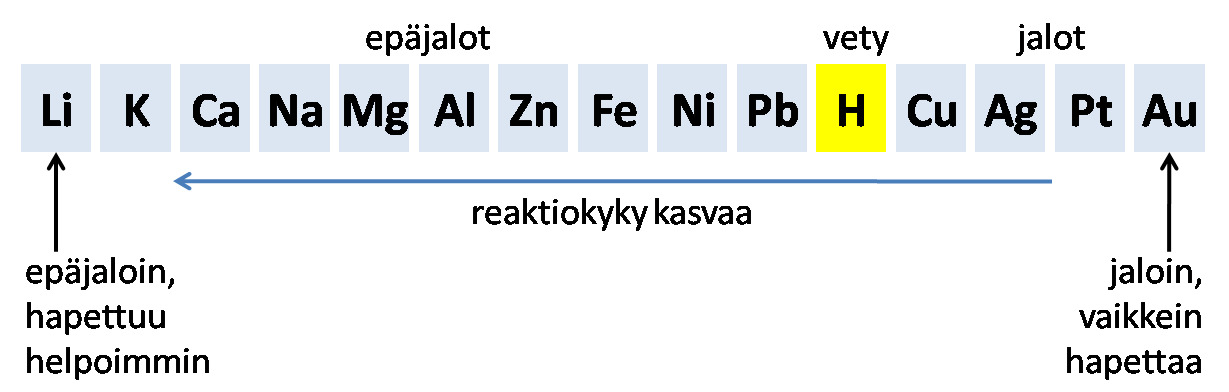
Jännitesarja
Metallien jännitesarja eli reaktiivisuussarja
- Metallien reaktiot ovat pohjimmiltaan sähkökemiallisia.
- Siksi reaktiivisuussarjaa kutsutaan jännitesarjaksi.
- Veden kanssa reagoivat metallit ovat epäjaloja metalleja
- Suolahappo nopeuttaa reaktiota
- Jalometallit eivät reagoi suolahapon luovuttaman vetyionin kanssa
- Silti esim kloori voi syövyttää jopa kultaa
- Jännitesarjassa metallit järjestetään reaktiivisuuden mukaan epäjaloimmasta jaloimpaan
- Vety (epämetalli) sijoitetaan epäjalojen ja jalojen metallien väliin
Hapettumisreaktio
Ⓔ Li → Li+ + e−
Ⓔ Mg → Mg2+ + 2e−
- Metalliatomit luovuttavat reaktioissa ulkoelektroneja ja ionisoituvat
- Tätä sanotaan hapettumiseksi
- Metallin rakenne katoaa ja se liukenee tai muodostaa jonkin yhdisteen
- Mitä epäjalompi metalli, sen helpommin se hapettuu
Pelkistymisreaktio
Ⓔ Li+ + e− → Li
Ⓔ Mg2+ + 2e− → Mg
- Pelkistyminen on hapettumisen vastakohta
- Metalli-ioni ottaa vastaan elektroneja ja muuttuu takaisin atomiksi
- Tuloksena kiinteää puhdasta metallia
- Mitä jalompi metalli, sen helpommin se pelkistyy
Hapettumis-pelkistymisreaktio
Ⓔ Mg + Cu2+ → Mg2+ + Cu
Ⓔ Mg2+ + 2 Li → Mg + 2 Li+
- Kaksi metallia reagoi keskenään
- Epäjalompi metalleista hapettuu, jalompi pelkistyy
- Joten aluksi:
- Jalompi metalleista on ioneina (liuoksena), jotta se voi pelkistyä
- Epäjalompi metalleista on atomeina (kiinteää), jotta se voi hapettua
- Toisin päin reaktio ei voi edetä