Harjoitustehtävät ja työt
5.3 Proteiinit
5.2 Lipidit ja rasvat
12
a)
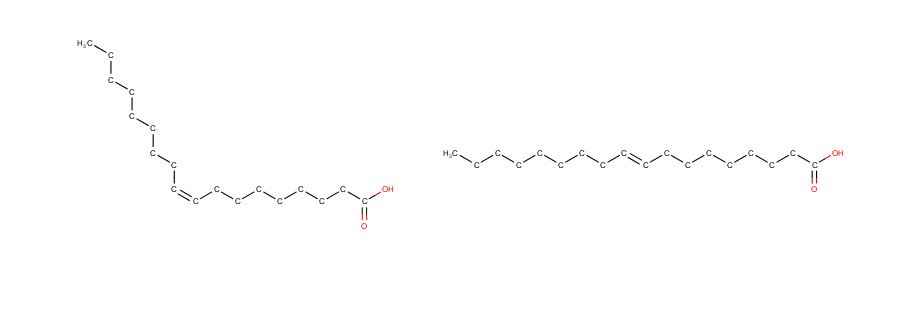
tyydyttyneitä: palmitiinihappo, steariinihappo
monotyydyttymättömiä: öljyhappo
polytyydyttymättömiä: linolihappo, linoleenihappo
b)
systemaattisista nimistä voi päätellä onko se tyydyttynyt
c)
tyydyttymättömillä rasvahapoilla
d)
14
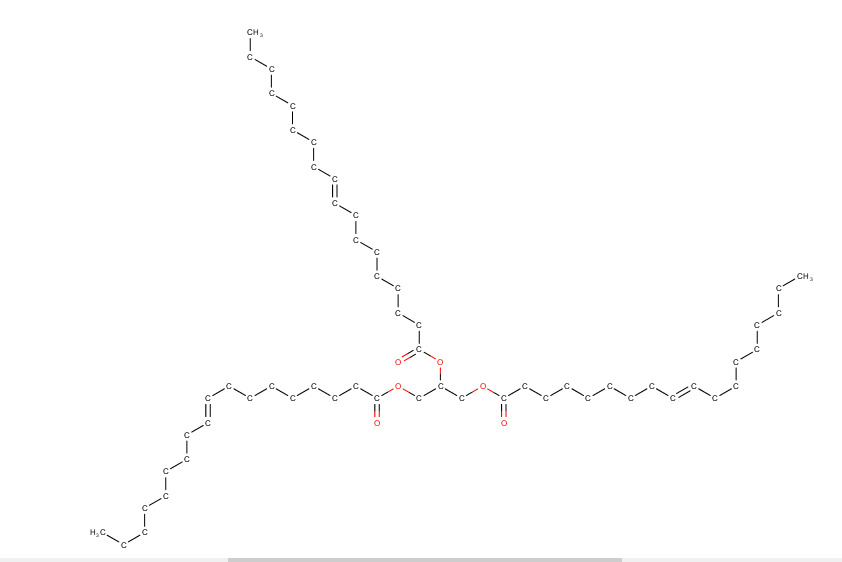
a) 885,453 g/mol
b) dispersiovoimat kasvaa, sulamispiste nousee koska kaksoissidokset poistuu
15



16
a) ketoryhmä
b) estradioli
c) kaikki
d) niillä on suuri pooliton osa
18
a)
seerumi on veren osa josta puuttuu verisolut ja verta hyydyttävät aineet
Se erotetaan verestä antamalla veren hyytyä ja sitten linkoamalla se
b)
kiinnitetään enemmän huomiota ruokavalion terveellisyyteen
c)
Pohjois-Karjala, 6,9mmol/l
d)
Helsinki/Vantaa, 5,2mmol/l
a)
tyydyttyneitä: palmitiinihappo, steariinihappo
monotyydyttymättömiä: öljyhappo
polytyydyttymättömiä: linolihappo, linoleenihappo
b)
systemaattisista nimistä voi päätellä onko se tyydyttynyt
c)
tyydyttymättömillä rasvahapoilla
d)

14

a) 885,453 g/mol
b) dispersiovoimat kasvaa, sulamispiste nousee koska kaksoissidokset poistuu
15
16
a) ketoryhmä
b) estradioli
c) kaikki
d) niillä on suuri pooliton osa
18
a)
seerumi on veren osa josta puuttuu verisolut ja verta hyydyttävät aineet
Se erotetaan verestä antamalla veren hyytyä ja sitten linkoamalla se
b)
kiinnitetään enemmän huomiota ruokavalion terveellisyyteen
c)
Pohjois-Karjala, 6,9mmol/l
d)
Helsinki/Vantaa, 5,2mmol/l
5.1 Hiilihydraatit
2
a monta OH-ryhmää
b aldehydiryhmän sisältävä monosakkaridi
c ketoryhmän sisältävä monosakkaridi, jossa on viisi hiiltä
d
e
f
6
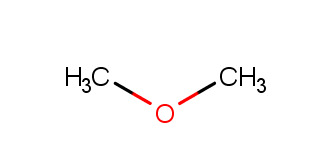
a) moniarvoinen alkoholi, aldehydi
b) eetteriryhmä
c) neljä asymmetristä hiiltä
7
8
a monta OH-ryhmää
b aldehydiryhmän sisältävä monosakkaridi
c ketoryhmän sisältävä monosakkaridi, jossa on viisi hiiltä
d
e
f
6
a) moniarvoinen alkoholi, aldehydi
b) eetteriryhmä
c) neljä asymmetristä hiiltä
7
8
Luku 4 Testaa oppimasi
1
D
2
AC
3
C
4
BC
5
D
6
A
7
CD
8
C
9
B
10
D
D
2
AC
3
C
4
BC
5
D
6
A
7
CD
8
C
9
B
10
D
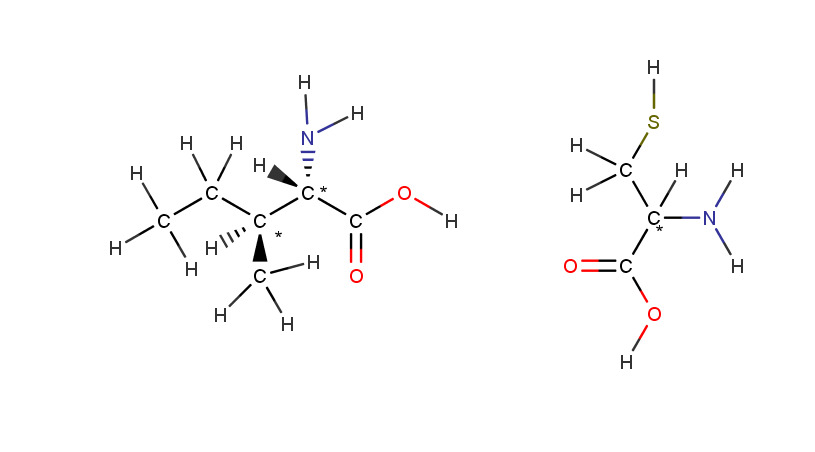
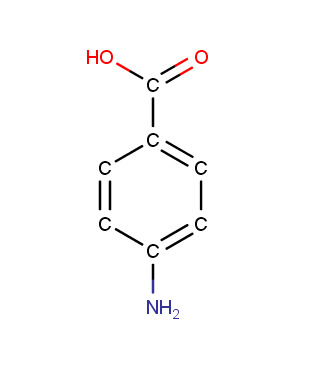
4.3 Stereoisomeerien erilaisia ominaisuuksia
19
21
22
21
22
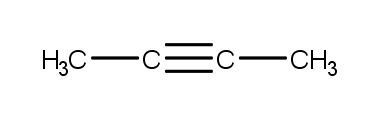
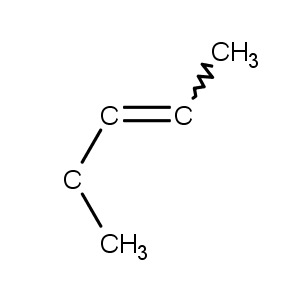
4.2 Orgaanisten yhdisteiden stereoisomeria
7
BD
EG
10
a) cis-2-penteeni
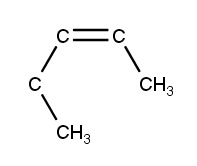
b) trans-1,2-dikloorisyklobutaani

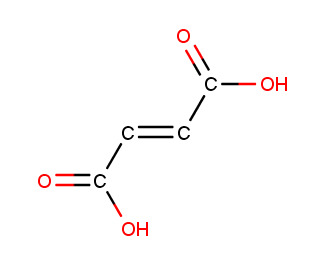
c) trans-buteenidihappo
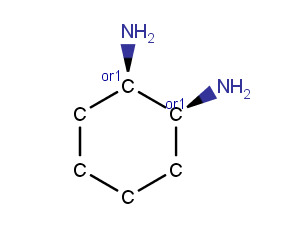
d) cis-1,2-diaminosykloheksaani
11
a) E
b) Z
c) E
d) Z
13
a) yksi asymmetrinen
b) yksi asymmetrinen hiili
c) ei optista isomeriaa
d) kolme asymmetristä hiiltä
e) yksi asymmetrinen hiili
16
a) alkeeni, syklinen
b) ei esiinny, kaksoissidos estää
c) ei esiinny, aina kaksi vetyatomia sidoksen toisella puolella
d) on optisesti aktiivinen
BD
EG
10
a) cis-2-penteeni

b) trans-1,2-dikloorisyklobutaani

c) trans-buteenidihappo

d) cis-1,2-diaminosykloheksaani

11
a) E
b) Z
c) E
d) Z
13
a) yksi asymmetrinen
b) yksi asymmetrinen hiili
c) ei optista isomeriaa
d) kolme asymmetristä hiiltä
e) yksi asymmetrinen hiili
16
a) alkeeni, syklinen
b) ei esiinny, kaksoissidos estää
c) ei esiinny, aina kaksi vetyatomia sidoksen toisella puolella
d) on optisesti aktiivinen
4.1 Sidosten avaruudellinen suuntautuminen ja molekyylin muoto
Luku 3 Testaa oppimasi
1
BC
2
BD
3
B
4
AC
5
D
6
BD
7
BCD
8
BD
9
C
10
B
3.3 Orgaanisten yhdisteiden rakenneisomeria
11
AE
BC
12
a)
etyleenidikloridi, 1,1-dikloorietaani
b)
2-metyylifenoli
3-metyylifenoli
4-metyylifenoli
13
heksaani
2-metyylipentaani
2,3-dimetyylibutaani
2,2-dimetyylibutaani
2-etyylibutaani
runkoisomeria
15
a)
1-butanoli: 117C, OH-ryhmä hiiliketjun päässä, muodostaa helpommin vahvoja sidoksia kuin 2-butanoli
2-butanoli: 100C
dietyylieetteri: 35C
b)
butaanihappo: 167C, happo
etyyliasetaatti: 77C
c)
trimetyyliamiini: hyvä
propyyliamiini: erittäin hyvä
AE
BC
12
a)
etyleenidikloridi, 1,1-dikloorietaani
b)
2-metyylifenoli
3-metyylifenoli
4-metyylifenoli
13
heksaani
2-metyylipentaani
2,3-dimetyylibutaani
2,2-dimetyylibutaani
2-etyylibutaani
runkoisomeria
15
a)
1-butanoli: 117C, OH-ryhmä hiiliketjun päässä, muodostaa helpommin vahvoja sidoksia kuin 2-butanoli
2-butanoli: 100C
dietyylieetteri: 35C
b)
butaanihappo: 167C, happo
etyyliasetaatti: 77C
c)
trimetyyliamiini: hyvä
propyyliamiini: erittäin hyvä
3.1 Suhdekaava ja molekyylikaava ja 3.2 Rakennekaava ja sen mallintaminen
1
_x)
_x)
_x)
_x)
_x)
_x)
3
4
%3Dn%5Cleft(C%5Cright)%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B0%7B%2C%7D228g%7D%7B44%7B%2C%7D01%7D%3D0%7B%2C%7D00518064...mol)
%3Dn%5Cleft(H%5Cright)%3D%5Cfrac%7Bm%7D%7BM%7D%3D2%5Ccdot%5Cfrac%7B0%7B%2C%7D0931g%7D%7B18%7B%2C%7D016%7D%3D0%7B%2C%7D0103352...mol)
6
7
9
10
3
4
6
7
9
10
Luku 2 Testaa oppimasi
1
AC
2
BCD
3
B
4
A
5
BC
6
C
7
C
8
AC
9
D
9 (10)
ABCD
AC
2
BCD
3
B
4
A
5
BC
6
C
7
C
8
AC
9
D
9 (10)
ABCD
2.4 Poolisuuden vaikutus orgaanisen yhdisteen ominaisuuksiin
24
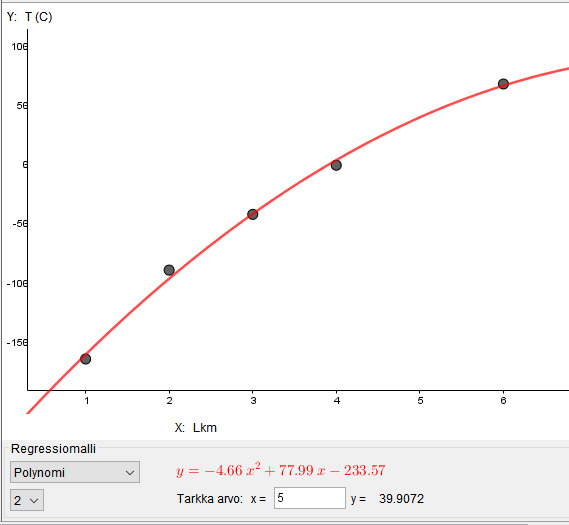
kun hiiliatomeja on 5, kiehumispiste on noin 40 astetta
27
alkaanien kiehumispiste kasvaa enemmän kuin alkoholien, hiiliatomien määrän kasvaessa, mutta alkoholien kiehumispiste on suurempi
28
metanoli - liuotin, pesuneste
etanoli - desinfiointiaine, spriikeitin
glyseroli - kosteudensitoja
glykoli - jäähdytysneste
29
a)
etanoli on poolinen yhdiste, etanolimolekyylien väliset voimat pitävät sen nesteenä korkeammassa lämpötilassa kuin poolittoman etaanin
b)
metanolissa liukenemisen estävä pooliton osa on suhteessa pienempi kuin 1-pentanolissa
33
a)
butanoli on poolisempi, se tekee vetysidoksia
b)
karboksyyliryhmä tekee molekyylistä poolisen
c)
steariinihapossa on suuri pooliton osa
d)
hapen elektronegatiivisuusero vedyn kanssa on suurempi kuin typen

kun hiiliatomeja on 5, kiehumispiste on noin 40 astetta
27
alkaanien kiehumispiste kasvaa enemmän kuin alkoholien, hiiliatomien määrän kasvaessa, mutta alkoholien kiehumispiste on suurempi
28
metanoli - liuotin, pesuneste
etanoli - desinfiointiaine, spriikeitin
glyseroli - kosteudensitoja
glykoli - jäähdytysneste
29
a)
etanoli on poolinen yhdiste, etanolimolekyylien väliset voimat pitävät sen nesteenä korkeammassa lämpötilassa kuin poolittoman etaanin
b)
metanolissa liukenemisen estävä pooliton osa on suhteessa pienempi kuin 1-pentanolissa
33
a)
butanoli on poolisempi, se tekee vetysidoksia
b)
karboksyyliryhmä tekee molekyylistä poolisen
c)
steariinihapossa on suuri pooliton osa
d)
hapen elektronegatiivisuusero vedyn kanssa on suurempi kuin typen
2.3 Funktionaaliset ryhmät ja eri yhdisteryhmät
12
1c
2e
3b
4g
5a
6f
7d
20
a 6 bentsoehappo
b 9 1-buten-2-oli
c 5 2-penteeni
d 8 trimetyyliamiini
e 2 1,4-diklooribentseeni
f 1 etaanidihappo
g 11 metanaali
h 16 etyylietanaattu
i 15 butanaali
j 13 2-heksanoli
21
22
1c
2e
3b
4g
5a
6f
7d
20
a 6 bentsoehappo
b 9 1-buten-2-oli
c 5 2-penteeni
d 8 trimetyyliamiini
e 2 1,4-diklooribentseeni
f 1 etaanidihappo
g 11 metanaali
h 16 etyylietanaattu
i 15 butanaali
j 13 2-heksanoli
21
22
2.2 Kovalenttisen sidoksen muodostuminen - hybridisaatioteoria
8





9
A57
B14
C23
D26
E23
F14
G57
H12
11
a) nikotiini on aromaattinen koska siinä on bentseenirengas
nikotiini on heterosyklinen, koska hiilirenkaissa on myös muita aineita
b) nikotiinissa bentseenirenkaan atomit ovat sp2-hybridisoituneet
c)
%3D162%7B%2C%7D23%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)


9
A57
B14
C23
D26
E23
F14
G57
H12
11
a) nikotiini on aromaattinen koska siinä on bentseenirengas
nikotiini on heterosyklinen, koska hiilirenkaissa on myös muita aineita
b) nikotiinissa bentseenirenkaan atomit ovat sp2-hybridisoituneet
c)
2.1 Kovalenttiset sidokset orgaanisissa molekyyleissä
avoketjuinen hiiliketju - hiiliatomit sitoutuvat toisiin kovalenttisesti, jolloin hiiliketju on suora tai haarautunut
syklinen yhdiste - hiilet muodostavat renkaita
heterosyklinen - renkaassa on muita epämetalliatomeja
tyydyttynyt - yhdisteessä on vain yksinkertaisia sidoksia
tyydyttymätön - vähintään yksi kaksoissidos
aromaattinen - rakenneosana bentseenirengas C6H6
polyaromaattinen - kaksi tai useampia bentseenirenkaita
2
a) c
b) d
c) e
d) f
4
a) b
b) c
c) a
d) e
e) d





5
b) 1,0*10^-12m
c) energiamäärä, jonka sidoksen purkaminen vaatii
d) kolmoissidos on vahvempi kuin yksöissidos
6
7
syklinen yhdiste - hiilet muodostavat renkaita
heterosyklinen - renkaassa on muita epämetalliatomeja
tyydyttynyt - yhdisteessä on vain yksinkertaisia sidoksia
tyydyttymätön - vähintään yksi kaksoissidos
aromaattinen - rakenneosana bentseenirengas C6H6
polyaromaattinen - kaksi tai useampia bentseenirenkaita
2
a) c
b) d
c) e
d) f
4
a) b
b) c
c) a
d) e
e) d
5
| Sidos | Sidospituus (pm) | Sidosenergia (kJ/mol) |
| C-C | 154 | 348 |
| C=C | 134 | 612 |
| C≡C | 120 | 837 |
| bentseeni | 139 | 518 |
c) energiamäärä, jonka sidoksen purkaminen vaatii
d) kolmoissidos on vahvempi kuin yksöissidos
6
7
1.4 Liuosten valmistaminen ja laimentaminen
30

%3D58%7B%2C%7D44%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)




31
a)

%3D6%5Ccdot12%7B%2C%7D01%2B8%5Ccdot1%7B%2C%7D008%2B7%5Ccdot16%7B%2C%7D00%3D192%7B%2C%7D124%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

mitataan tämä ja loppu 100ml mittapullosta täyteen vettä
b)

%3D6%5Ccdot12%7B%2C%7D01%2B6%5Ccdot1%7B%2C%7D008%2B16%7B%2C%7D00%3D94%7B%2C%7D108%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

mitataan tämä ja loppu 250ml mittapullosta täyteen vettä
c)

%3D58%7B%2C%7D69%2B2%5Ccdot35%7B%2C%7D45%2B12%5Ccdot1%7B%2C%7D008%2B6%5Ccdot16%7B%2C%7D00%3D237%7B%2C%7D686%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

33
a)








mittaan 1,461 grammaa natriumkloridia analyysivaa'an avulla ja laitan sen 100ml mittapulloon, jonka täytän sitten tislatulla vedellä merkkiviivaan asti sekoittaen natriumkloridin huolellisesti
31
a)
mitataan tämä ja loppu 100ml mittapullosta täyteen vettä
b)
mitataan tämä ja loppu 250ml mittapullosta täyteen vettä
c)
33
a)
mitataan 50ml täyspipetillä glukoosiliuosta 100ml mittapulloon ja täytetään se sitten 50 millilitralla tislattua vettä
b)
mitataan 50ml täyspipetillä glukoosiliuosta 200ml mittapulloon ja täytetään se sitten 150 millilitralla tislattua vettä
c)




mitataan 1ml mittapipetillä glukoosiliuosta 50ml mittapulloon ja täytetään se sitten 49 millilitralla tislattua vettä
34
_2CO_3%5Cright)%3D2%5Ccdot14%7B%2C%7D01%2B8%5Ccdot1%7B%2C%7D008%2B12%7B%2C%7D01%2B3%5Ccdot16%3D%5Cleft(18%7B%2C%7D042%5Cright)_2%2B60%7B%2C%7D01%3D%5C%2096%7B%2C%7D094%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)



_2CO_3%5Crightarrow%5C%202%5C%20NH_4%2BCO_3)


mitataan 1ml mittapipetillä glukoosiliuosta 50ml mittapulloon ja täytetään se sitten 49 millilitralla tislattua vettä
34
1.3 Liuoksen konsentraatio
20
a) 1,5mol/l
b) 3,7mmol/l
21




_2SO_4%5Crightarrow%5C%202%5C%20NH_4%5E%2B%2BSO_4%5E%7B2-%7D)
%3D2%5Ccdot0%7B%2C%7D4148...%5C%20%5Cfrac%7Bmol%7D%7Bl%7D%3D0%7B%2C%7D8297...%5C%20%5Cfrac%7Bmol%7D%7Bl%7D%5Capprox0%7B%2C%7D8%5C%20%5Cfrac%7Bmol%7D%7Bl%7D)
%3D0%7B%2C%7D4148...%5C%20%5Cfrac%7Bmol%7D%7Bl%7D%5Capprox0%7B%2C%7D4%5C%20%5Cfrac%7Bmol%7D%7Bl%7D)
23
a)


b)


%3D22%7B%2C%7D99%2B35%7B%2C%7D45%3D58%7B%2C%7D44%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)



c)
%3D22%7B%2C%7D99%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

d)


25

%3D39%7B%2C%7D10%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

työ 4, osa 1:




%3D12%5Ccdot12%7B%2C%7D01%2B22%5Ccdot1%7B%2C%7D008%2B11%5Ccdot16%7B%2C%7D00%3D342%7B%2C%7D296%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

osa 2:

27
a)

%3D36%7B%2C%7D46%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)


b)

%3D17%7B%2C%7D03%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)


a) 1,5mol/l
b) 3,7mmol/l
21
23
a)
b)
c)
d)
25
työ 4, osa 1:
osa 2:
27
a)
b)
1.2 Mooli ja ainemäärä
1)
Montako moolia on 26,98 moolia alumiinia (Al)?
alumiinin moolimassa on 26,98g/mol


2)
kuinka monta grammaa on 3 moolia alumiinia
alumiinin moolimassa on 26,98g/mol


3)
kuinka monta moolia on 134,90g alumiinia
alumiinin moolimassa on 26,98g/mol

Laske ainemäärä kun vettä on 1,0kg



Laske ainemäärä kun etanolia on 750g



Laske massa kun natriumhydroksidia NaOH on 54,5 moolia




Metallin ainemäärä on 0,25mol ja massa 6,754g, mistä metallista on kyse?



Montako moolia on 26,98 moolia alumiinia (Al)?
alumiinin moolimassa on 26,98g/mol
2)
kuinka monta grammaa on 3 moolia alumiinia
alumiinin moolimassa on 26,98g/mol
3)
kuinka monta moolia on 134,90g alumiinia
alumiinin moolimassa on 26,98g/mol
Laske ainemäärä kun vettä on 1,0kg
Laske ainemäärä kun etanolia on 750g
Laske massa kun natriumhydroksidia NaOH on 54,5 moolia
Metallin ainemäärä on 0,25mol ja massa 6,754g, mistä metallista on kyse?
moolimassa on lähimpänä alumiinin moolimassaa, 26,982 g/mol
7

d)

8


a)
6,022*10^22
b)
0,1*12=1,2mol
c)
3,61*10^23
10
a)
%3D2%5Ccdot12%7B%2C%7D01%2B6%5Ccdot1%7B%2C%7D008%2B16%7B%2C%7D00%3D46%7B%2C%7D068%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D5%5Ccdot12%7B%2C%7D01%2B12%5Ccdot1%7B%2C%7D008%2B5%5Ccdot16%7B%2C%7D00%3D152%7B%2C%7D146%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D20%5Ccdot12%7B%2C%7D01%2B30%5Ccdot1%7B%2C%7D008%2B16%7B%2C%7D00%3D286%7B%2C%7D44%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D8%5Ccdot12%7B%2C%7D01%2B10%5Ccdot1%7B%2C%7D008%2B2%5Ccdot16%7B%2C%7D00%2B4%5Ccdot14%7B%2C%7D01%3D194%7B%2C%7D2%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D14%5Ccdot12%7B%2C%7D01%2B18%5Ccdot1%7B%2C%7D008%2B5%5Ccdot16%7B%2C%7D00%2B2%5Ccdot14%7B%2C%7D01%3D294%7B%2C%7D304%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
11

%3D%5Cfrac%7B0%7B%2C%7D035g%7D%7B196%7B%2C%7D97%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D1%7B%2C%7D7769...%5Ccdot10%5E%7B-4%7Dmol)
%3D22%7B%2C%7D99%2B14%7B%2C%7D01%2B3%5Ccdot16%7B%2C%7D00%3D85%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7B2%7B%2C%7D5g%7D%7B85%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D029411...mol%5Capprox0%7B%2C%7D03%5C%20mol)
%3D4%7B%2C%7D5%5Ccdot0%7B%2C%7D249g%3D1%7B%2C%7D1205g)
%3D27%5Ccdot12%7B%2C%7D01%2B46%5Ccdot1%7B%2C%7D008%2B16%7B%2C%7D00%3D386.638%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7B1%7B%2C%7D1205g%7D%7B386%7B%2C%7D638%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D2%7B%2C%7D89805...%5Ccdot10%5E%7B-3%7Dmol)
%3D%5Crho%20V%3D1%7B%2C%7D0%5C%20%5Cfrac%7Bg%7D%7Bml%7D%5Ccdot150ml%3D150g)
%3D2%5Ccdot1%7B%2C%7D008%2B16%7B%2C%7D00%3D18%7B%2C%7D016%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7B150%7D%7B18%7B%2C%7D016%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D8%7B%2C%7D3259...mol%5Capprox8%7B%2C%7D3%5C%20mol)
%3D10%5Ccdot0%7B%2C%7D035g%3D0%7B%2C%7D35g)
%3D6%5Ccdot12%7B%2C%7D01%2B8%5Ccdot1%7B%2C%7D008%2B6%5Ccdot16%7B%2C%7D00%3D176%7B%2C%7D124%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
12


%3D2%7B%2C%7D0mol)
%3D26%7B%2C%7D98%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

%3D50%5C%20mol)
%3D2%5Ccdot16%7B%2C%7D00%3D32%7B%2C%7D00%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

%3D0%7B%2C%7D20mol)
%3D2%5Ccdot22%7B%2C%7D99%2B32%7B%2C%7D07%2B4%5Ccdot16%7B%2C%7D00%3D142%7B%2C%7D05%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)


%3D4%5Ccdot1%7B%2C%7D008%2B14%7B%2C%7D01%2B35%7B%2C%7D45%3D53%7B%2C%7D492%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D0%7B%2C%7D03476...g%5Capprox35mg)
%3D2%7B%2C%7D5%5Ccdot10%5E%7B-9%7Dmol)
%3D16%7B%2C%7D00%2B20%5Ccdot12%7B%2C%7D01%2B30%5Ccdot1%7B%2C%7D008%3D286%7B%2C%7D44%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

%3D6%7B%2C%7D4%5Ccdot10%5E%7B-12%7Dmol)
%3D18%5Ccdot12%7B%2C%7D01%2B23%5Ccdot1%7B%2C%7D008%2B2%5Ccdot16%7B%2C%7D00%3D271%7B%2C%7D364%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

16


7
a)

b)

c)
c)
d)
8
a)

b)

c)

9a)
6,022*10^22
b)
0,1*12=1,2mol
c)
3,61*10^23
10
a)
11
12
16
moolimassa on lähimpänä raudan moolimassaa, aine X on siis rautaa
18




18
1.1 Alkuaineen suhteellinen atomimassa
4.
a) 14
b) 28, 29, 30
c) 14, 15, 16
d)
a) 14
b) 28, 29, 30
c) 14, 15, 16
d)
Kertaa oppimaasi
1.
_4CH_3%26%26x%5C%5C%0Ahiilidioksidi%26CO_2%26%26x%0A%5Cend%7Barray%7D)
2.
a neon
b typpi
c koboltti
d kalium
e magnesium
f rikki
g amerikium
h kloori
a) C, järjestysluku
b) kalium
c) esim typpi ja neon
d) amerikiumin
e) magnesium
f) neon
g) koboltti ja amerikium
h) kloori
i) kalium ja magnesium
j) magnesium, typpi
6
O-H
C-H
C-O
C-N
niiden elektronegatiivisuusarvojen ero on 0,5 ja 1,5 välillä
7
a) A
b) EF
c) BC
d)
e) D
f) F
g) E
h) BC
2.
a neon
b typpi
c koboltti
d kalium
e magnesium
f rikki
g amerikium
h kloori
a) C, järjestysluku
b) kalium
c) esim typpi ja neon
d) amerikiumin
e) magnesium
f) neon
g) koboltti ja amerikium
h) kloori
i) kalium ja magnesium
j) magnesium, typpi
6
O-H
C-H
C-O
C-N
niiden elektronegatiivisuusarvojen ero on 0,5 ja 1,5 välillä
7
a) A
b) EF
c) BC
d)
e) D
f) F
g) E
h) BC