2. Hidas ja nopea kemiallinen reaktio
Hidas ja nopea kemiallinen reaktio
Viime kappaleessa puhuimme alkuaineista ja siitä, kuinka niitä esiintyy luonnossa alle sata erilaista. Kuitenkin maailma koostuu lukemattomasta määrästä erilaisia yhdisteitä, jotka rakentuvat alkuaineista.
Yhdisteet ovat muodostuneet kemiallisissa reaktioissa, joissa alkuaineiden atomit järjestäytyvät uusilla tavoilla toisiinsa ja syntyy uudenlaista ainetta. Kemiallisia reaktioita tapahtuu koko ajan ympärillämme: palaminen, hengittäminen, ruoan sulaminen ja puhelimen akun latautuminen ovat esimerkkejä kemiallisista reaktioista. Esimerkiksi veden jäätyminen ei sen sijaan ole kemiallinen reaktio, sillä vesi ([[$H_2O$]]) ja jää ([[$H_2O$]]) ovat samaa ainetta.
Esimerkki kemiallisesta reaktiosta. Natrium [[$Na$]] reagoi veden [[$H_2 O$]] kanssa muodostaen vetykaasua [[$H_2$]] ja natriumhydroksidia [[$NaOH$]]. Natriumhydroksidi on emäs ja värjää veden, jossa on fenoliftaleiinia, pinkiksi.
Reaktioyhtälö
Reaktioyhtälö on tapa kuvata kemiallista reaktiota. Reaktioyhtälön vasemmalla puolella ovat lähtöaineet, jotka reagoivat ja yhtälön oikealla puolella ovat reaktiotuotteet, jotka syntyvät reaktiossa. [[$$ \text{lähtöaineet} \ \rightarrow \ \text{reaktiotuotteet}$$]]
Hidas ja nopea reaktio
Kemialliset reaktiot tapahtuvat eri nopeuksilla: jotkin tapahtuvat räjähdysmäisen nopeasti ja toiset erittäin hitaasti. Esimerkiksi raudan ruostumista ei voi silmin havaita, mutta ilotulite räjähtää silmänräpäyksessä.
Kemiallisen reaktion nopeuteen voi vaikuttaa monen eri tavoin. Raudan ruostumisen nopeuteen vaikuttavat esimerkiksi ympäristön kosteus ja epäpuhtaudet. Kemiallisen reaktion nopeuteen vaikuttavia tekijöitä ovat:
Yhdisteet ovat muodostuneet kemiallisissa reaktioissa, joissa alkuaineiden atomit järjestäytyvät uusilla tavoilla toisiinsa ja syntyy uudenlaista ainetta. Kemiallisia reaktioita tapahtuu koko ajan ympärillämme: palaminen, hengittäminen, ruoan sulaminen ja puhelimen akun latautuminen ovat esimerkkejä kemiallisista reaktioista. Esimerkiksi veden jäätyminen ei sen sijaan ole kemiallinen reaktio, sillä vesi ([[$H_2O$]]) ja jää ([[$H_2O$]]) ovat samaa ainetta.
Esimerkki kemiallisesta reaktiosta. Natrium [[$Na$]] reagoi veden [[$H_2 O$]] kanssa muodostaen vetykaasua [[$H_2$]] ja natriumhydroksidia [[$NaOH$]]. Natriumhydroksidi on emäs ja värjää veden, jossa on fenoliftaleiinia, pinkiksi.
Reaktioyhtälö
Reaktioyhtälö on tapa kuvata kemiallista reaktiota. Reaktioyhtälön vasemmalla puolella ovat lähtöaineet, jotka reagoivat ja yhtälön oikealla puolella ovat reaktiotuotteet, jotka syntyvät reaktiossa. [[$$ \text{lähtöaineet} \ \rightarrow \ \text{reaktiotuotteet}$$]]
| Esimerkki Kun hiili [[$C$]] palaa, niin se reagoi hapen [[$O_2$]] kanssa. Reaktiotuotteena syntyy hiilidioksidia [[$CO_2$]]. 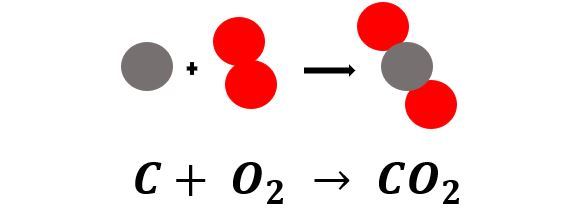 |
Hidas ja nopea reaktio
Kemialliset reaktiot tapahtuvat eri nopeuksilla: jotkin tapahtuvat räjähdysmäisen nopeasti ja toiset erittäin hitaasti. Esimerkiksi raudan ruostumista ei voi silmin havaita, mutta ilotulite räjähtää silmänräpäyksessä.
Kemiallisen reaktion nopeuteen voi vaikuttaa monen eri tavoin. Raudan ruostumisen nopeuteen vaikuttavat esimerkiksi ympäristön kosteus ja epäpuhtaudet. Kemiallisen reaktion nopeuteen vaikuttavia tekijöitä ovat:
- reagoivat aineet: eri aineet reagoivat keskenään eri nopeuksilla. Esimerkiksi litium reagoi veden kanssa hitaammin kuin natrium.
- lämpötila: lämpötilan nostaminen nopeuttaa kemiallista reaktiota. Suuremmassa lämpötilassa hiukkaset liikkuvat nopeammin ja ne törmäilevät useammin, jolloin reaktio nopeutuu.
- sekoittaminen: sekoittaminen toimii hieman lämpötilan nostamisen tavoin. Sekoittaminen lisää hiukkasten liikettä ja törmäyksiä, jolloin reaktionopeus kasvaa.
- liuoksen väkevyys: Mitä väkevämpi liuos on kyseessä, niin sitä nopeammin aineet reagoivat. Esimerkiksi magnesium reagoi nopeammin 10% suolahappoliuoksen kuin 5% suolahappoliuoksen kanssa.
- hienojakoisuus: aineen hienojakoisuus lisää reaktionopeutta. Mitä pienempinä paloina reagoivat aineet ovat, niin sitä nopeammin ne reagoivat.
- katalyytti (ja inhibiitti): katalyytti on aine, joka nopeuttaa kemiallista reaktiota, mutta joka ei itse reagoi. Inhibiitti on aine, joka hidastaa kemiallista reaktiota.