1. Atomi
Atomi
Alkuaine ja atomi
7. luokalla opimme, että kaikki aine koostuu atomeista, pienimmistä mahdollisista rakennuspalikoista. Erilaisia atomeja on yhtä monta kuin eri alkuaineita, sillä kaikilla alkuaineilla on omanlaisensa atomi.
Atomit puolestaan koostuvat ytimestä ja sitä kiertävistä energiatasoista. Atomin ydin koostuu protoneista ja neutroneista, joita elektronit kiertävät energiatasoillaan. Atomin voi kuvitella olevan ikäään kuin Aurinkokunta, jossa suurin osa aineesta on keskittynyt ytimeen (Aurinko) ja jota kevyemmät kappaleet (planeetat) kiertävät.
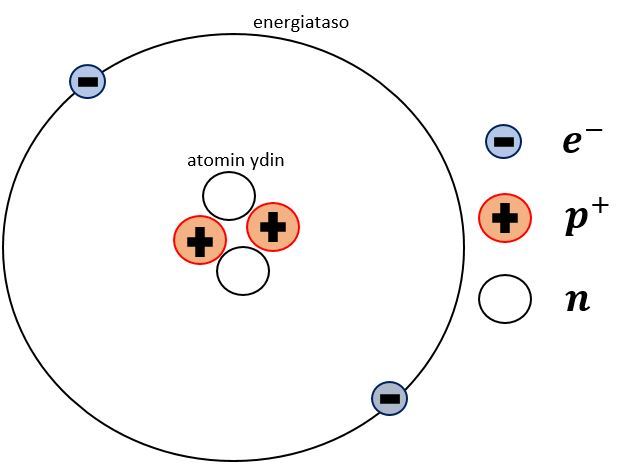 Atomin osat, ydin ja energiatasot, sekä hiukkaset lyhenteineen. Protonilla on positiivinen ja elektronilla negatiivinen sähkövaraus. Neutronilla ei ole sähkövarausta lainkaan. Huomaa, että atomin perustilassa hiukkasia on kutakin yhtä monta (paitsi vetyatomilla, jolla on vain yksi protoni ja yksi elektroni).
Atomin osat, ydin ja energiatasot, sekä hiukkaset lyhenteineen. Protonilla on positiivinen ja elektronilla negatiivinen sähkövaraus. Neutronilla ei ole sähkövarausta lainkaan. Huomaa, että atomin perustilassa hiukkasia on kutakin yhtä monta (paitsi vetyatomilla, jolla on vain yksi protoni ja yksi elektroni).
Jokaisella alkuaineella on omanlaisensa atomi. Protonien lukumäärä kertoo mikä alkuaine on kyseessä. Esimerkiksi yläpuolella olevan kuvan atomilla on kaksi protonia, joten kyseessä on järjestykseltään toinen alkuaine eli helium. Protonien lukumäärä on samalla alkuaineen järjestysluku.
Atomin elektronien ja neutronien lukumäärä voi vaihdella alkuaineen pysyessä samana.
Atomin energiatasoilta voi poistua tai sinne voi tulla lisää elektroneja atomin reagoidessa muiden atomien kanssa. Tällöin atomin kokonaisvaraus ei ole nolla, sillä positiivisia protoneja (plussia) on eri määrä kuin negatiivisia elektroneja (miinuksia).
Protonit ja neutronit ovat huomattavasti raskaampia kuin elektronit ja muodostavat leijonanosan atomin massasta. Tästä syystä atomin ytimessä olevien hiukkasten yhteenlaskettua lukumäärää kutsutaan atomin massaluvuksi.
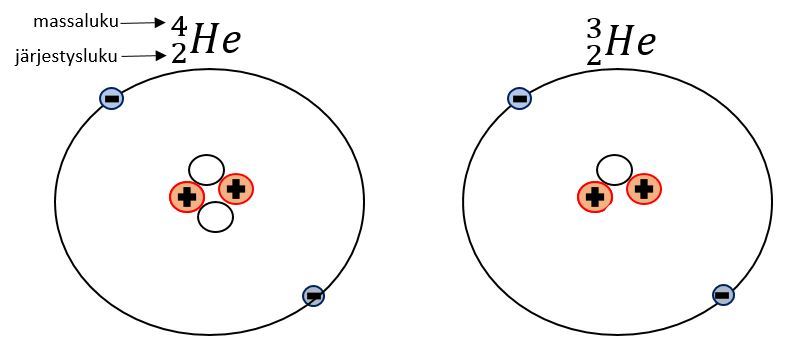 Kuvassa on kaksi heliumatomia. Vasen atomi on "normaali" heliumatomi, koska sillä on jokaista hiukkasta yhtä monta. Oikean puoleisella atomilla on yksi neutroni vähemmän, joten sillä on yhtä pienempi massaluku.
Kuvassa on kaksi heliumatomia. Vasen atomi on "normaali" heliumatomi, koska sillä on jokaista hiukkasta yhtä monta. Oikean puoleisella atomilla on yksi neutroni vähemmän, joten sillä on yhtä pienempi massaluku.
Bohrin atomimalli
Vaikka ajatus atomien olemassaolosta periytyy yli 2000 vuoden takaiseen antiikin Kreikkaan, niin selitys atomin tarkemmasta rakenteesta on varsin nuori. Vuonna 1904 Joseph Thomson esitti rusinapullamallinsa, jossa positiivinen varaus levittäytyi tasaisesti koko atomin alueelle ja negatiiviset elektronit hajaantuivat atomiin kuin rusinat pullataikinaan.
Vuonna 1911 Ernest Rutherford esitti tarkemman mallin, jossa atomilla on pieni ydin ja sitä ympäröi elektronien muodostama pilvi. Pilven ja verhon välissä on suhteessa ytimen pieneen kokoon suuri välimatka.
Vuonna 1913 Niels Bohr tarkensi Rutherfordin mallia esittämällä, että elektronit eivät sijaitse sattumanvaraisesti elektronipilvessä, vaan tarkoin määritellyillä elektroniradoilla eli energiatasoilla. Mitä enemmän atomilla on elektroneja, niin sitä enemmän sillä on energiatasoja, koska energiatasoille mahtuu vain tietty määrä elektroneja.
Taulukko esittää ensimmäiselle neljälle tasolle mahtuvat elektronit.
Jos atomi luovuttaa tai vastaanottaa elektroneja, niin muutokset tapahtuvat aina uloimmalla energiatasolla. Uloimmalle energiatasolle mahtuu aina korkeintaan kahdeksan elektronia.
Jos atomin uloin energiataso on täynnä, eli sillä on kahdeksan ulkoelektronia, niin atomilla on oktetti, johon kaikki atomit aina pyrkivät! (Tärkeä asia!)
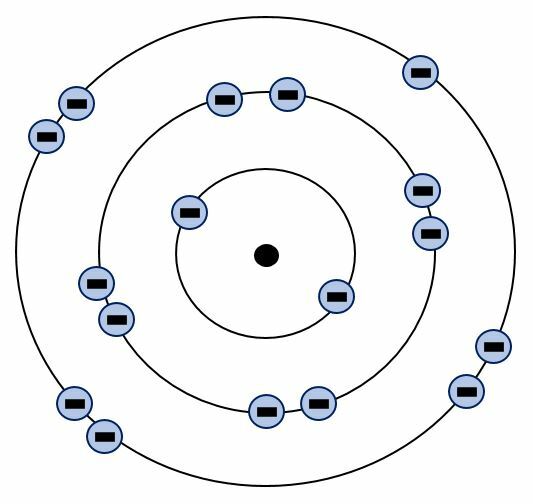 Kloori on järjestyksessä 17. alkuaine, joten sillä on perustilassaan 17 elektronia. Kuvasta näkyy kuinka elektronit ovat sijoittuneet tasoille enimmäismäärien mukaisesti. Jos kloori saisi uloimmalle tasolleen vielä yhden elektronin, niin se saisi itselleen oktetin.
Kloori on järjestyksessä 17. alkuaine, joten sillä on perustilassaan 17 elektronia. Kuvasta näkyy kuinka elektronit ovat sijoittuneet tasoille enimmäismäärien mukaisesti. Jos kloori saisi uloimmalle tasolleen vielä yhden elektronin, niin se saisi itselleen oktetin.
7. luokalla opimme, että kaikki aine koostuu atomeista, pienimmistä mahdollisista rakennuspalikoista. Erilaisia atomeja on yhtä monta kuin eri alkuaineita, sillä kaikilla alkuaineilla on omanlaisensa atomi.
Atomit puolestaan koostuvat ytimestä ja sitä kiertävistä energiatasoista. Atomin ydin koostuu protoneista ja neutroneista, joita elektronit kiertävät energiatasoillaan. Atomin voi kuvitella olevan ikäään kuin Aurinkokunta, jossa suurin osa aineesta on keskittynyt ytimeen (Aurinko) ja jota kevyemmät kappaleet (planeetat) kiertävät.
 Atomin osat, ydin ja energiatasot, sekä hiukkaset lyhenteineen. Protonilla on positiivinen ja elektronilla negatiivinen sähkövaraus. Neutronilla ei ole sähkövarausta lainkaan. Huomaa, että atomin perustilassa hiukkasia on kutakin yhtä monta (paitsi vetyatomilla, jolla on vain yksi protoni ja yksi elektroni).
Atomin osat, ydin ja energiatasot, sekä hiukkaset lyhenteineen. Protonilla on positiivinen ja elektronilla negatiivinen sähkövaraus. Neutronilla ei ole sähkövarausta lainkaan. Huomaa, että atomin perustilassa hiukkasia on kutakin yhtä monta (paitsi vetyatomilla, jolla on vain yksi protoni ja yksi elektroni).Jokaisella alkuaineella on omanlaisensa atomi. Protonien lukumäärä kertoo mikä alkuaine on kyseessä. Esimerkiksi yläpuolella olevan kuvan atomilla on kaksi protonia, joten kyseessä on järjestykseltään toinen alkuaine eli helium. Protonien lukumäärä on samalla alkuaineen järjestysluku.
Atomin elektronien ja neutronien lukumäärä voi vaihdella alkuaineen pysyessä samana.
Atomin energiatasoilta voi poistua tai sinne voi tulla lisää elektroneja atomin reagoidessa muiden atomien kanssa. Tällöin atomin kokonaisvaraus ei ole nolla, sillä positiivisia protoneja (plussia) on eri määrä kuin negatiivisia elektroneja (miinuksia).
Protonit ja neutronit ovat huomattavasti raskaampia kuin elektronit ja muodostavat leijonanosan atomin massasta. Tästä syystä atomin ytimessä olevien hiukkasten yhteenlaskettua lukumäärää kutsutaan atomin massaluvuksi.
 Kuvassa on kaksi heliumatomia. Vasen atomi on "normaali" heliumatomi, koska sillä on jokaista hiukkasta yhtä monta. Oikean puoleisella atomilla on yksi neutroni vähemmän, joten sillä on yhtä pienempi massaluku.
Kuvassa on kaksi heliumatomia. Vasen atomi on "normaali" heliumatomi, koska sillä on jokaista hiukkasta yhtä monta. Oikean puoleisella atomilla on yksi neutroni vähemmän, joten sillä on yhtä pienempi massaluku.Bohrin atomimalli
Vaikka ajatus atomien olemassaolosta periytyy yli 2000 vuoden takaiseen antiikin Kreikkaan, niin selitys atomin tarkemmasta rakenteesta on varsin nuori. Vuonna 1904 Joseph Thomson esitti rusinapullamallinsa, jossa positiivinen varaus levittäytyi tasaisesti koko atomin alueelle ja negatiiviset elektronit hajaantuivat atomiin kuin rusinat pullataikinaan.
Vuonna 1911 Ernest Rutherford esitti tarkemman mallin, jossa atomilla on pieni ydin ja sitä ympäröi elektronien muodostama pilvi. Pilven ja verhon välissä on suhteessa ytimen pieneen kokoon suuri välimatka.
Vuonna 1913 Niels Bohr tarkensi Rutherfordin mallia esittämällä, että elektronit eivät sijaitse sattumanvaraisesti elektronipilvessä, vaan tarkoin määritellyillä elektroniradoilla eli energiatasoilla. Mitä enemmän atomilla on elektroneja, niin sitä enemmän sillä on energiatasoja, koska energiatasoille mahtuu vain tietty määrä elektroneja.
| Energiataso ytimestä poispäin lukien |
Elektronien enimmäismäärä tasolla |
| 1. taso | 2 |
| 2. taso | 8 |
| 3. taso | 18 |
| 4. taso | 32 |
Jos atomi luovuttaa tai vastaanottaa elektroneja, niin muutokset tapahtuvat aina uloimmalla energiatasolla. Uloimmalle energiatasolle mahtuu aina korkeintaan kahdeksan elektronia.
Jos atomin uloin energiataso on täynnä, eli sillä on kahdeksan ulkoelektronia, niin atomilla on oktetti, johon kaikki atomit aina pyrkivät! (Tärkeä asia!)
 Kloori on järjestyksessä 17. alkuaine, joten sillä on perustilassaan 17 elektronia. Kuvasta näkyy kuinka elektronit ovat sijoittuneet tasoille enimmäismäärien mukaisesti. Jos kloori saisi uloimmalle tasolleen vielä yhden elektronin, niin se saisi itselleen oktetin.
Kloori on järjestyksessä 17. alkuaine, joten sillä on perustilassaan 17 elektronia. Kuvasta näkyy kuinka elektronit ovat sijoittuneet tasoille enimmäismäärien mukaisesti. Jos kloori saisi uloimmalle tasolleen vielä yhden elektronin, niin se saisi itselleen oktetin.