2 Orgaanisten yhdisteiden rakenne ja ominaisuudet
Linkit
2.1 Kovalenttiset sidokset yhdisteissä
Alkuaine hiili, C, Z = 6, 1s22s22p2, ulkokuorella on neljä elektronia.
Hiili voi muodostaa neljä kovalenttista sidosta muiden epämetallien kanssa.
Hiiliatomien välille voi muodostua yksinkertaisia sidoksia, kaksoisidoksia tai kolmoissidoksia.
Tyydyttyneissä yhdisteissä on C-atomien välillä yksinkertaisiasidoksia.
Tyydyttymättömissä yhdisteissä C-atomien välillä kaksois- tai kolmoissidoksia.
Hiiliatomit voivat muodostaa avoketjuisia (asyklisiä) tai syklisiä yhdisteitä.
Heterosyklisessä yhdisteessä C-atomien renkaassa on myös jokin muu epämetalliatomi.
Aromaattinen yhdiste sisältää bentseenirenkaan, C6H6.
 lähde Wikipedia
lähde Wikipedia
Esimerkkejä aromaattisista yhdidsteistä.

Hiiliatomien sitoutuminen orgaanisissa yhdisteissä:
katso taulukko 2, oppikirjan sivulta 53.
Hiili voi muodostaa neljä kovalenttista sidosta muiden epämetallien kanssa.
Hiiliatomien välille voi muodostua yksinkertaisia sidoksia, kaksoisidoksia tai kolmoissidoksia.
Tyydyttyneissä yhdisteissä on C-atomien välillä yksinkertaisiasidoksia.
Tyydyttymättömissä yhdisteissä C-atomien välillä kaksois- tai kolmoissidoksia.
Hiiliatomit voivat muodostaa avoketjuisia (asyklisiä) tai syklisiä yhdisteitä.
Heterosyklisessä yhdisteessä C-atomien renkaassa on myös jokin muu epämetalliatomi.
Aromaattinen yhdiste sisältää bentseenirenkaan, C6H6.
 lähde Wikipedia
lähde WikipediaEsimerkkejä aromaattisista yhdidsteistä.
Hiiliatomien sitoutuminen orgaanisissa yhdisteissä:
katso taulukko 2, oppikirjan sivulta 53.
2.2 Kovalenttisen sidoksen muodostuminen - HYBRIDISAATIOTEORIA
Kvanttimekaanisen atomimallin mukaan elektronit sijaitsevat atomiorbitaaleilla.
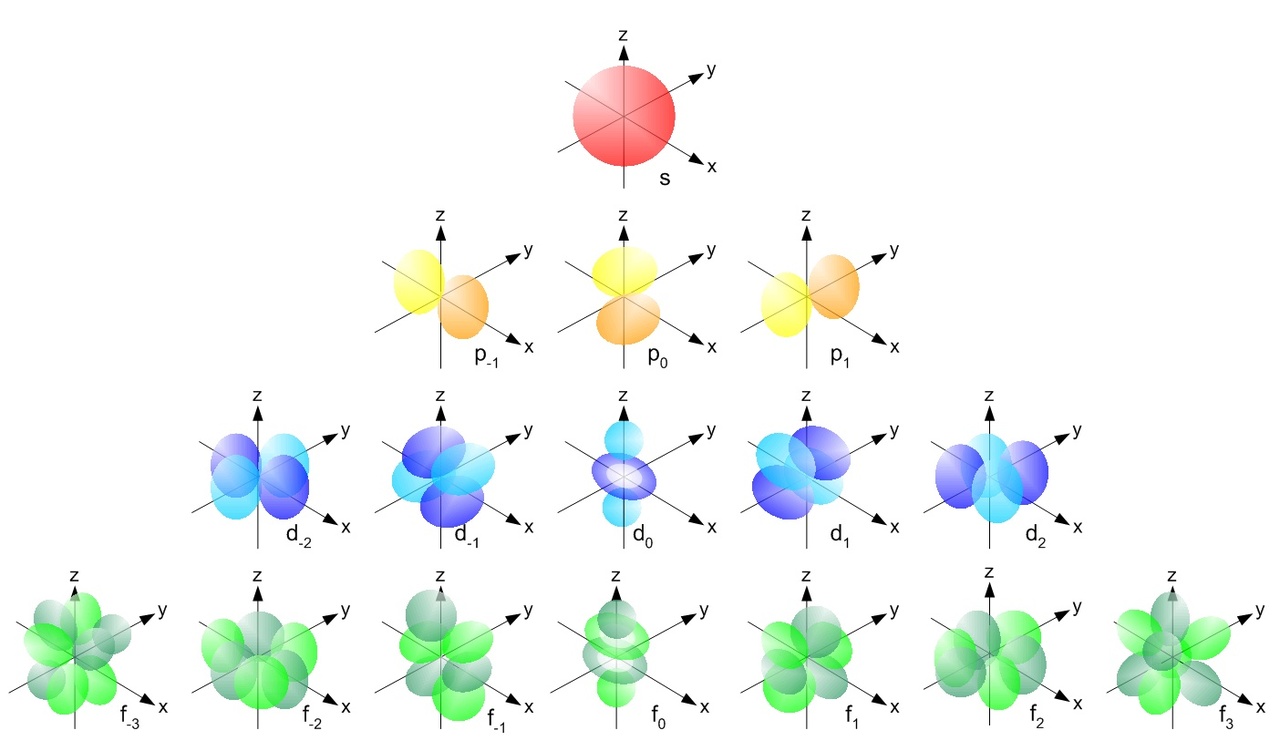
Orbitaaleja kuvataan rajapintakuvaajila, elektronit löytyvät todennäköisimmin näiltä alueilta.
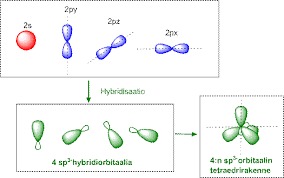
Hiilen ulkokuoren elektronit muodostavat neljä samanlasta sidosta esim. CH4-molekyylissä.
Hiili muodostaa neljä sp3-hybridiorbitaalia, muodostuu neljä sigma sidosta.

Hybridisaatio on atomiorbitaalien uudelleenjärjestyminen, jolloin muodostuu uusia avaruudellisesti eritavoin suuntautuneita orbitaaleja. sp3-hybridisaatiossa molekyylin muoto on TETRAEDRI.
Hiiliatomien välille muodostuu kaksoisidos - sp2-hybridisaatio.
Kolme sigmasidosta ja yksi piisidos.
Molekyylin muoto on TASOMAINEN.
Hiiliatomien välille muodostuu kolmoisidos - sp-hybridisaatio.
Kaksi sigmasidosta ja kaksi piisidosta.
Molekyylin muoto on LINEAARINEN.
Katso oppikirjan taulukko sivulta 61, siinä on yhteenveto hybridisaatiosta.

Orbitaaleja kuvataan rajapintakuvaajila, elektronit löytyvät todennäköisimmin näiltä alueilta.
Hiilen ulkokuoren elektronit muodostavat neljä samanlasta sidosta esim. CH4-molekyylissä.
Hiili muodostaa neljä sp3-hybridiorbitaalia, muodostuu neljä sigma sidosta.

Hybridisaatio on atomiorbitaalien uudelleenjärjestyminen, jolloin muodostuu uusia avaruudellisesti eritavoin suuntautuneita orbitaaleja. sp3-hybridisaatiossa molekyylin muoto on TETRAEDRI.

Hiiliatomien välille muodostuu kaksoisidos - sp2-hybridisaatio.
Kolme sigmasidosta ja yksi piisidos.
Molekyylin muoto on TASOMAINEN.
Hiiliatomien välille muodostuu kolmoisidos - sp-hybridisaatio.
Kaksi sigmasidosta ja kaksi piisidosta.
Molekyylin muoto on LINEAARINEN.
Katso oppikirjan taulukko sivulta 61, siinä on yhteenveto hybridisaatiosta.
2.3 Funktionaaliset ryhmät ja eri yhdisteryhmät
Hiiliyhdisteiden luokittelu perustuu yhdisteen toiminnalliseen ryhmään (FUNKTIONAALINEN RYHMÄ).
Kunkin ryhmän ominaisuudet ja kemialliset reaktiot ovat samanlaisia.
Yhdisteen nimi ilmaisee funktionaalisen ryhmän.
Oppikirjan sivut 64, 65.
Orgaanisilla yhdisteillä on systemaattinen nimi (IUPAC), joka perustuu hiiliatomien lukumäärään, molekyylin muotoon ja funktionaaliseen ryhmän nimeen.
Nimeäminen alkaa oppikirjan sivulta 67.
Kunkin ryhmän ominaisuudet ja kemialliset reaktiot ovat samanlaisia.
Yhdisteen nimi ilmaisee funktionaalisen ryhmän.
Oppikirjan sivut 64, 65.
Orgaanisilla yhdisteillä on systemaattinen nimi (IUPAC), joka perustuu hiiliatomien lukumäärään, molekyylin muotoon ja funktionaaliseen ryhmän nimeen.
Nimeäminen alkaa oppikirjan sivulta 67.
2.4 Poolisuuden vaikutus orgaanisen yhdisteen ominaisuuksiin
Hiilivedyt ovat poolittomia yhdisteitä, elektronegatiivisuuserot pienä ja molekyylin muoto on symmetrinen (tetraedri) - DISPERSIOVOIMIA.
Liukenee poolittomiin liuottimiin..
Alhaiset sulamis- ja kiehumispisteet
Kun orgaaninen yhdiste sisältää hydroksyyliryhmän (O-H-ryhmän) esim. alkoholit, molekyyli (molekyylin osa) on poolinen (V-muoto) ja molekyylie välille muodostuu VETYSIDOKSIA.
Korkeammat sulamis- ja kiehumispisteet kuin poolittomilla samankokoisilla yhdisteillä.
Orgaanisten yhdisteiden ominaisuuksiin vaikuttavat molekyylin
Liukenee poolittomiin liuottimiin..
Alhaiset sulamis- ja kiehumispisteet
Kun orgaaninen yhdiste sisältää hydroksyyliryhmän (O-H-ryhmän) esim. alkoholit, molekyyli (molekyylin osa) on poolinen (V-muoto) ja molekyylie välille muodostuu VETYSIDOKSIA.
Korkeammat sulamis- ja kiehumispisteet kuin poolittomilla samankokoisilla yhdisteillä.
Molekyylit, jotka sisältävät karbonyyliryhmän (C=O) tai happisillan (-O-) ovat poolisia. Molekyylien välille muodostuu DIPOLI-DIPOLISIDOKSIA.
Orgaaniset yhdisteetvoivat sisältää N-atomin - amiinit. Amiinit ovat poolisia ja molekyylien välille voi muodostua (prim. ja sek.) VETYSIDOKSIA.
Orgaaniset yhdisteetvoivat sisältää N-atomin - amiinit. Amiinit ovat poolisia ja molekyylien välille voi muodostua (prim. ja sek.) VETYSIDOKSIA.
Orgaanisten yhdisteiden ominaisuuksiin vaikuttavat molekyylin
- muoto
- koko
- poolisuus
- funktionaalinen ryhmä ja niiden määrä