Kemia 7
Kokeen rakenne
Osassa I on automaattisesti korjattavia tehtäviä, esimerkiksi väittämä-, monivalinta- tai yhdistelytehtäviä sekä avoimen vastauskentän sisältäviä perustehtäviä. Tehtävät voidaan luokitella pääosin mieleenpalauttamisen ja ymmärtämisen tasoille, mutta myös muita ajattelun tasoja esiintyy. Kaikki osan I tehtävät ovat pakollisia.
Osassa II tehtävät ovat esimerkiksi vertailu-, arviointi- tai sovellustehtäviä. Tehtävät voidaan luokitella pääosin ymmärtämisen, soveltamisen ja analysoimisen tasoille, mutta myös muita ajattelun tasoja esiintyy. Osassa II on valinnaisia tehtäviä.
Osassa III tehtävät ovat esimerkiksi analysointi-, muunnos- tai kehittämistehtäviä. Tehtävät voidaan luokitella pääosin analysoimisen, arvioimisen ja luomisen tasoille, mutta myös muita ajattelun tasoja esiintyy. Tehtävässä annettu aineisto voi olla merkittävässä roolissa. Osassa III on valinnaisia tehtäviä.
Kemian digitaalisessa ylioppilaskokeessa tarvitaan vastaavaa osaamista kuin paperisessa kemian ylioppilaskokeessa. Tekstin ja kuvien lisäksi tarkasteltavana materiaalina voidaan käyttää esimerkiksi videoita, ääntä ja simulaatioita. Mittausaineistot voivat olla aiempaa laajempia. Mittausaineistoa voidaan antaa osana tehtävänantoa tai erillisinä tiedostoina eri formaateissa. Molekyylimalleja voidaan tarkastella esimerkiksi kuvien, videoiden tai kokeeseen upotetun interaktiivisen mallin (esim. Jsmol) avulla. Taulukkotietoja on käytettävissä ohjelmana, tietokantana tai tiedostoina. Digitaalisessa ylioppilaskokeessa kokelaalla on käytössään koejärjestelmän taulukko- ja kaava-aineistoja, MAOL-digitaulukot (Otava) ja erilaisia laskinohjelmia. Ylioppilastutkinnon kokeissa on mahdollista käyttää erillistä laskinta ja painettua taulukkoaineistoa syksyn 2020 kokeeseen saakka (syksy 2020 mukaan lukien). Tavoitteena on saada taulukko- ja kaava-aineistoja sekä osa MAOLdigitaulukoista (Otava) myös Abitti-järjestelmään.
Kokelailta edellytetään jatkossakin kemiallisesti täsmällistä ilmaisua. Vastaukselta edellytetään kemian luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei vaadita. Rakennekaavojen eri esitystavat hyväksytään. Epäorgaanisten yhdisteiden reaktioyhtälöitä voi laatia esimerkiksi koejärjestelmän matematiikkaeditorilla tai LibreOfficella. Orgaanisten yhdisteiden rakennekaavoja ja reaktioyhtälöitä voi laatia esimerkiksi MarvinSketch-ohjelmalla. Essee- ja selittävissä vastauksissa kirjoitettua tekstiä yleensä täydennetään reaktioyhtälöillä, kaavoilla tai kuvioilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja 3 symbolisella tasolla. Vastauksesta ilmenee tehtävään liittyvän aineiston hyödyntäminen, soveltaminen, analysointi ja arvioiminen tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen. Monivalintatehtävissä valitaan paras vastaus tarjolla olevista vaihtoehdoista. Vastauksen valitsemisessa voi hyödyntää kaikkia tarjolla olevia materiaaleja ja ohjelmia. Tehtävän pisteitys ilmenee tehtävänannosta. Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Käytössä on esimerkiksi Geogebra, wxMaxima, Casion ClassPad Manager ja TI-Nspire. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen, ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora tai käyrä esimerkiksi jonkin sovitefunktion avulla. Jos mittauspisteet ovat lähellä toisiaan, varsinaista sovitefunktiota ei tarvitse lisätä. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten ekvivalenttikohta titrauskäyrässä tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Esimerkit 1
1. Selitä miksi
a) kalium reagoi veden kanssa kiivaammin kuin litium
b) magnesiumioni on pienempi kuin kuin magnesiumatomi
c) bromiatomi on pienempi kuin kaliumatomi
d) rubidiumin ensimmäinen ionisoitumisenergia on pienempi kuin kaliumin
e) strontium muodostaa +2 arvoisen ionin, mutta rikki -2 ionin.
2. Tarkastele oheiseen jaksolliseen järjestelmään kirjaimilla a - h merkittyjä alkuaineita.
a) Mitkä näistä eivät muodosta kemiallisia yhdisteitä?
b) Mitkä näistä esiintyvät yhdisteissään kationina, jonka varaus on 2+?
c) Valitse jokin näistä alkuaineista, jonka oksidi on hapan. Laadi tämän oksidin ja veden välisen reaktion yhtälö.
d) Valitse jokin näistä alkuaineista, jonka oksidi on emäksinen. Laadi tämän oksidin ja veden välisen reaktion yhtälö.
e) Mikä alkuaineista on voimakkain hapetin? Perustele. (s1999-4)
Kemialliset sidokset
Selvitä millainen aine on kyseessä ja millaisia sidoksia hilarakenteessa esiintyy, kun aine
a) sulaa hyvin helposti, liukenee huonosti veteen, mutta hyvin bensiiniin, ei johda sähköä kiinteänä
b) ei liukene veteen eikä bensiiniin, johtaa kiinteänä sähköä
c) liukenee veteen, mutta vesiliuos ei johda sähköä
Stoikiometriaa
Esim. Vetykaasua valmistettiin lisäämällä sinkkirakeitten (16,35g) päälle suolahappoa (50 cm3, c = 5,9 M). Syntynyt kaasu kerättiin tyhjään ilmapalloon jonka massa kasvoi 0,1944 g.
- Kirjoita tasapainotettu reaktioyhtälö.
- Kuinka suuri tilavuus vetykaasua voi syntyä jos lämpötila on 21,2 °C ja paine 102 kPa?
- Vetykaasua saatiin 0,1944 g. Mikä oli saantoprosentti?
Esim. S03/2
Kun rikkihappoa sisältävä näyte neutraloitiin, kului 12,3 ml NaOH-liuosta, joka oli valmistettu liuottamalla 2,40 g natriumhydroksidia veteen ja laimentamalla tilavuuteen 150 ml. Kuinka monta grammaa rikkihappoa näyte sisälsi?
Kevät 96/2
Claus-prosessissa vetysulfidissa oleva rikki muutetaan alkuainerikiksi (S8) käyttäen hyväksi seuraavia reaktioita:
H2S(g) + O2(g) → SO2(g) + H2O(l)
H2S(g) + SO2(g) → S8(s) + H2O(l)
Määritä reaktioyhtälöiden kertoimet. Kuinka suuri tilavuus (NTP) happea kuluu, kun rikkiä saadaan 3,87 g?
Syksy 02/2
Lannoite sisältää ammoniumsulfaattia ja kaliumsulfaattia. Lannoitteen koostumuksen määrittämiseksi 0,228 g näytteeseen lisättiin natriumhydroksidia ja seosta kuumennettiin, jolloin siitä vapautui ammoniakkikaasua.
a) Laadi kaasunmuodostukseen liittyvä reaktioyhtälö.
b) Reaktiossa syntynyt ammoniakki johdettiin veteen. Liuos neutraloitiin 0,100 M vetykloridihapolla, jota kului 16,1 ml. Kuinka monta massaprosenttia ammoniumsulfaattia lannoite sisälsi?
Kevät 03/3
Puutarhan kalkitukseen voidaan käyttää dolomiittikalkkia, joka on kalsiumkarbonaatin ja magnesiumkarbonaatin seos. Kuumennuksessa kumpikin karbonaatti hajoaa vastaavaksi oksidiksi. a) Laadi reaktioyhtälöt. b) Kun 0,876 g dolomiittikalkkia kuumennettiin, saatiin jäännös, jonka massa oli 0,477 g. Kuinka monta massaprosenttia magnesiumkarbonaattia dolomiittikalkki sisälsi?
Kemiallisen reaktion nopeus
Tehtävä
Selitä kemialliselta kannalta
- Miksi ruoka pilaantuu nopeammin lämpimässä huoneessa kuin jääkaapissa.
- Miksi teräsvilla palaa paremmin hapessa kuin ilmassa
- Miksi sinkkijauhe reagoi saman väkevyisen suolahapon kanssa kiivaammin kuin sinkkirakeet
- Miksi klooriyhdisteet nopeuttavat otsonikatoa.
Tehtävä
Dityppipentaoksidi hajoaa seuraavasti:
2 N2O5(g) ® 4 NO(g) + 3 O2(g)
Hajoamisreaktion nopeutta seurattiin 45 °C:ssa mittaamalla dityppipentaoksidin konsentraatio eri aikoina, jolloin saatiin seuraavat mittaustulokset:
|
c(N2O5) (mol/l) |
aika (s) |
|
1,00 |
0 |
|
0,88 |
200 |
|
0,78 |
400 |
|
0,69 |
600 |
|
0,60 |
800 |
|
0,54 |
1000 |
|
0,43 |
1400 |
|
0,30 |
2000 |
- a) Esitä dityppipentaoksidin konsentraatio ajan funktiona.
- b) Laske reaktion keskimääräinen nopeus aikavälillä 200 s – 400 s.
- c) Määritä reaktionopeus ajanhetkellä 1400 s.
- d) Mitä eroa on reaktionopeuksissa ja mistä ero johtuu?
Kokeellista kemiaa
S02/7
Naftaleeni ja 4-kloorianiliini liukenevat kumpikin eetteriin. Näiden seoksesta yhdisteet päätettiin erottaa uuttamalla erotussuppiloa (kuva) käyttäen. Tiedetään, että uutto onnistuu, kun toisesta komponentista tehdään suolahapon avulla vesiliukoinen orgaaninen suola.
a) Kummasta yhdisteestä muodostuu orgaaninen suola? Esitä tämä suolanmuodostusreaktio.
b) Miten uutto tehdään, kun käytettävissä on dietyylieetteriä ja vettä, johon on lisätty hieman suolahappoa?
K99/2
Polttoanalyysissä näytettä kuumennetaan uunissa, jonka läpi johdetaan happivirta. Tällöin aineen palaessa muodostunut vesihöyry absorboituu tetrafosforidekaoksidia sisältävään astiaan (A ) ja muodostunut hiilidioksidi absorboituu natriumhydroksidia sisältävään astiaan (B). Kaasujen määrät saadaan selville punnitsemalla keräilyastiat A ja B ennen analyysiä ja sen jälkeen.
a) Kun 125,0 mg erästä hiiltä, vetyä ja happea sisältävää yhdistettä poltettiin, saatiin 219,9 mg CO2 ja 104,8 mg H2O. Mikä on yhdisteen empiirinen kaava (suhdekaava)?
b) Mitä kemiallisia reaktioita astioissa A ja B tapahtuu?
Energian muutokset
Syksy 2001
3.
Oheinen kaavio liittyy reaktioon, jossa eräs suola liukenee veteen.
- a) Vapautuuko vai sitoutuuko reaktiossa energiaa?
b) Lämpeneekö vai jäähtyykö liuos reaktion aikana?
c) Liukeneeko kyseinen suola runsaammin kuumaan vai kylmään veteen?
d) Voidaanko reaktiolämpöjen avulla tehdä yleisiä päätelmiä reaktioiden nopeudesta. Perustele vastauksesi
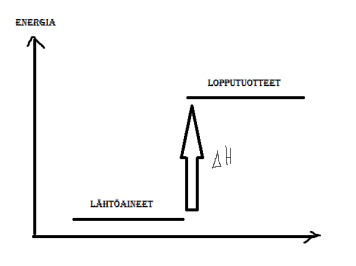
Esim. tekn.2005.
Muodostumisreaktioiden, joissa yhdisteet syntyvät alkuaineistaan, reaktioentalpioilla on keskeinen merkitys laskettaessa reaktiolämpöä termodynaamisten taulukoiden avulla. Vakiopaineessa reaktiolämpö on sama kuin reaktioentalpia. Tutkitaan seuraavaa metaanin muodostumisreaktiota ja siihen liittyvää reaktioentalpiaa:
C(s, graafiitti) + 2 H2(g) -> CH4(g)
Mikä on tämän reaktion moolinen reaktioentalpia (siis reaktiolämpö ∆H, kun metaania syntyy 1 mol) 101 kPa paineessa ja 25 °C lämpötilassa, kun tunnetaan näissä olosuhteissa seuraavat reaktioentalpiat?- C(s, grafiitti) + O2(g) –> CO2(g) ∆H=-394 kJ/mol
- H2(g) + ½ O2(g) -> H2O (l) ∆H=-286 kJ/mol
- CH4(g) + 2 O2(g) -> CO2(g) + 2 H2O(l) ∆H=-890 kJ/mol
Esim. Laske sidosenergioiden avulla reaktioentalpia, kun yksi mooli bioetanolia palaa auton moottorissa. Biomassasta alkoholikäymisen avulla valmistettua etanolia, bioetanolia, käytetään monissa maissa polttoaineena bensiiniin sekoitettuna. Uusiutuvana energianlähteenä bioetanoli ei lisää ilmakehän hiilidioksidin määrää. Onko tämän kuitenkin vain pelkkää poliittista sanahelinää vai oikeasti ympäristöystävällinen ja ”vihreä” valinta? Pohdi biologian ja maantiedon tietoja käyttäen bioetanolin raaka-aineiden viljelyn vaikutuksia monipuolisesti.
Sähkökemiaa
Kevät 03/6
Selvitä reaktioyhtälön avulla tai sanallisesti, mitä tapahtuu, kun
|
a) |
ruokasuola liukenee veteen, |
|
b) |
pieni natriumpala pannaan veteen, |
|
c) |
sinkkijauhetta lisätään suolahappoliuokseen, |
|
d) |
hopeanitraattia lisätään rauta(II)nitraatin vesiliuokseen, |
|
e) |
hopealanka upotetaan kuparisulfaatin vesiliuokseen, |
|
f) |
natriumkloridia ja natriumjodidia sisältävään vesiliuokseen lisätään nestemäistä bromia. |
Syksy 00/7
Käytettävissäsi on hopealankaa, kuparilankaa, sinkkilevy ja lyijylevy. Lisäksi saatavilla ovat seuraavien yhdisteiden 1,0 M vesiliuokset: Cu(NO3)2, Zn(NO3)2, AgNO3 ja Pb(NO3)2. Mitä näistä aineista käytät, kun tarkoituksesi on rakentaa mahdollisimman tehokas (suurin jännite) galvaaninen sähkökenno? Perustele. Laadi tässä kennossa tapahtuvien kemiallisten reaktioiden yhtälöt ja esitä piirroksen avulla kennon rakenne.
Kevät 99/3
Kuparia valmistetaan kuparikiisusta, CuFeS2, pasuttamalla malmi ensin oksidiksi ja pelkistämällä oksidi sitten metalliksi. Kokonaisreaktio on seuraava:
CuFeS2(s) + O2(g) → Cu(s) + FeS(s) + SO2(g)
Prosessissa vapautuvaa rikkidioksidia ei voida sellaisenaan päästää ympäristöön.
a) Pohdi, miten rikkidioksidi voidaan saattaa vaarattomaan muotoon ja miten sitä käytetään hyväksi kemian teollisuudessa.
b) Saatu kupari puhdistetaan elektrolyyttisesti käyttämällä epäpuhtaasta kuparista tehtyä anodia ja puhtaasta kuparista tehtyä katodia. Elektrolyysin aikana anodi liukenee ja puhdas kupari saostuu katodille. Kirjoita elektrodeilla tapahtuvat reaktiot. Kuinka paljon kuparia saadaan, kun liuoksen läpi johdetaan 1 500 A:n tasavirta 1,0 tunnin ajan? Miten kuparisulfaattiliuoksen sininen väri muuttuu elektrolyysin aikana.

Spektroskopian esimerkit Mooli 2 - kirjasta
Tasapainoreaktiot
Syksy 1998/6.
Metanolia voidaan valmistaa hiilimonoksidin ja vedyn välisen tasapainoreaktion avulla:
a) Perustele, miksi tässä reaktiossa on edullista käyttää katalyyttiä, matalaa lämpötilaa ja suurta painetta.
b) Kun 10,0 litran astiaan suljettiin 2,0 moolia hiilimonoksidia ja 1,0 moolia vetykaasua lämpötilassa 500 °C, muodostui astiaan tasapainotilan asetuttua 0,18 moolia metanolia. laske reaktion tasapainovakion arvo.
pH laskuja
S95/6
Makeutusaineena usein käytettävä sakkariini (kuva) on heikko happoa (Ka = 2,0 · 10–12 mol/l). Juomiin sakkariini lisätään tavallisesti natriumsuolana. Mikä on sellaisen liuoksen pH, joka on valmistettu liuottamalla 29 mg sakkariinin natriumsuolaa 1,0 litraan vettä?

K96/6
a) Kuinka monta grammaa pyridiiniä (kuva) tarvitaan valmistettaessa 0,10 litraa vesiliuosta, jonka pH lämpötilassa 25 °C on 8,70? b) Kun pyridiini reagoi typpihapon kanssa, muodostuu pyridiniumnitraattia pyH+NO3–. Päättele, onko tämän suolan vesiliuos hapan, neutraali vai emäksinen. Pyridiini on heikko emäs, jonka emäsvakion arvo on Kb = 1,5 · 10–9 mol/l.

S 06/5
0,50 litrassa liuosta on 1,0 millimoolia suolahappoa (vetykloridia) lämpötilassa 25 °C.
|
a) |
Mikä on liuoksen pH? (1 p.) |
|
b) |
Mihin tilavuuteen liuos on laimennettava, jotta sen pH olisi 3,00? (2 p.) |
|
c) |
Kuinka suuri tilavuus 0,10 M NaOH-liuosta on lisättävä alkuperäiseen suolahappoliuokseen, jotta muodostuvan liuoksen pH olisi 12,00? (3 p.) |
Kaasujen osapaineet
Liuosten valmistus
Biologian tunnilla tutkittiin osmoosia ja työhön käytettiin fysiologista suolaliuosta, jonka
osmoottinen vahvuus on yhtä vahva kuin veren. Fysiologisen suolaliuoksen
natriumkloridikonsentraatio on 0,15 mol/l. Kuinka valmistat 500 millilitraa tätä liuosta? Esitä
tarvittavat laskut, käytettävät välineet ja liuoksen valmistuksen eri työvaiheet. Laske mikä on
valmiin liuoksen suolapitoisuus massaprosentteina.
Titrauskäyrä ja sen tulkinta
Kevät 1996 3.
Ilokaasuna tunnettua dityppimonoksidia voidaan valmistaa hajottamalla ammoniumnitraattia 250 °C:n lämpötilassa:
NH4NO3(s) → N2O(g) + 2 H2O(g)
a) Ammoniumnitraatti on ionirakenteinen yhdiste, jossa typpi esiintyy kahdella eri hapetusasteella. Mitkä nämä hapetusasteet ovat? Mitkä atomit hapettuvat ja mitkä pelkistyvät reaktion aikana? b) Dityppimonoksidi on polaarinen ja lineaarinen molekyyli. Onko atomien järjestys molekyylissä NNO vai NON? Perustele vastauksesi. c) Laske kaasumaisen dityppimonoksidin tiheys normaaliolosuhteissa (NTP). Päättele, onko kaasu raskaampaa vai kevyempää kuin ilma.
Teksti
a) Kirjoita tinan ja tina(II)-ionin elektronikonfiguraatiot edeltävästä jalokaasusta lähtien.
b) Selitä, miksi atomisäde pienenee kuljettaessa jaksossa vasemmalta oikealle?
c) Selitä, miksi seuraavilla isoelektronisilla (niissä on yhtä monta elektronia) ioneilla ionisäde pienenee järjestysluvun kasvaessa.
-
ioni
ionisäde/pm
O2-
140
F-
136
Na+
95
Mg2+
65
Al3+
50
Teksti
a) Miksi ionirakenteinen yhdiste liukenee paremmin veteen kuin bensiiniin?
b) Mitä sidoksia purkautuu ja mitä muodostuu, kun suola liukenee veteen?
c) Miten amorfisen aineen rakenne eroaa kiteisen aineen rakenteesta?
d) Päättele, millä seuraavista fluoria sisältävistä aineista on korkein kiehumispiste, F2, NaF, HF.









