Kemia 3 (Mikko)
Reaktiot ja energia
Reaktioyhtälö
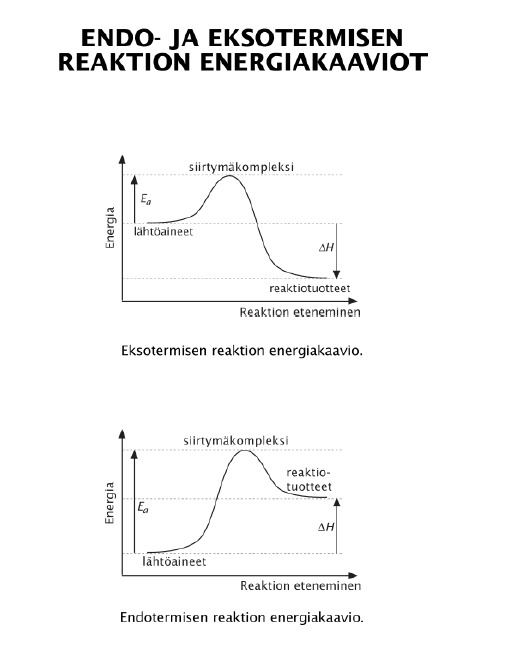
Reaktioenergialla tarkoitetaan reaktion entalpiamuutosta ΔH = H(tuotteet) - H(lähtöaineet)
Esim. Syksy 2001 3. Oheinen kaavio liittyy reaktioon, jossa eräs suola liukenee veteen.
|
a) Vapautuuko vai sitoutuuko reaktiossa energiaa? |
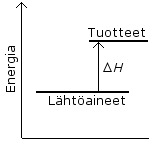
Kemiallista reaktiota voidaan mallintaa reaktioyhtälöllä
lähtöaineet -> lopputuotteet
Olomuodon symbolit:
s (solid) kiinteä
l (liquid) neste
g (gas) kaasu
aq vesiliuos (aquatic solution)
Esim. NH3 (g) + HCl (g) -> NH4Cl (s)
Esim. Etanoli palaa
CH3CH2OH (l) + 3 O2 (g) -> 2 CO2 (g) + 3 H2O (g)
Huom! Ainetta ei häviä reaktiossa. Pidä huoli että molemmin puolin sama määrä atomeja.
Esimerkit 1.9, 1.12
Harjoitukset 1.4, 1.9, 1.13, 1.15, 1.16
Reaktioiden luokittelua

Molekyyliyhdisteiden osalta hapetusluvut ovat kuvitteellisia varauksia, jotka yhdisteen atomeilla olisi, mikäli sidoksen jaetut elektronit olisi jaettu tasan identtisten atomien kesken tai jos kaikki jaetut elektronit olisivat sillä atomilla, joka vetää niitä enemmän puoleensa (jolla on suurempi elektronegatiivisuus). Ioniyhdisteessä olevan yksiatomisen ionin hapetusluku on sen varaus. Hapetusluku ilmaistaan yleensä roomalaisin numeroin, kuten +I tai -IV.
Esimerkiksi vesimolekyylin tapauksessa voidaan ajatella, että kaikki elektronit ovat hapella, jolloin sillä on kaksi ylimääräistä elektronia (sen hapetusluku on -II), ja vedyillä ei ole yhtään elektronia (niiden kummankin hapetusluku on +I). Natriumkloridin tapauksessa voidaan helposti todeta, että natriumin hapetusluku on +I ja kloorin hapetusluku on -I.
Hapetuslukujen laskemiseksi on muutamia yksinkertaisia sääntöjä, jotka soveltuvat useimpien yhdisteiden atomien hapetuslukujen määrittämiseen:
Alkuaineen perustilan hapetusluku on nolla. Esimerkiksi jokaisen Na(s), Ar(g) tai Hg(l) -atomin hapetusluku on 0. Myös jokaisen esimerkiksi N2- tai O3-molekyylissä olevan atomin hapetusluku on 0.
Yksiatomisen ionin hapetusluku on sama kuin sen varaus. Esimerkiksi Na+ -ionin hapetusluku on +I ja O2- -ionin hapetusluku on -II.
Fluorin hapetusluku on yhdisteissä aina -I.
Hapen hapetusluku on yhdisteissä tavallisesti -II. Esim. CO:ssa ja SO3:ssa se on -II. Mutta: Peroksideissa jokaisen hapen hapetusluku on -I. Yhdisteessä OF2 hapen hapetusluku on +II.
Kovalenttisissa epämetalliyhdisteissään vedyn hapetusluku on +I. Esim. HCl, NH3, H2O ja CH4 -yhdisteissä vedyn hapetusluku on +I. Mutta: Metallihydrideissä, kuten LiH:ssa, vedyn hapetusluku on -I,
Sähköisesti varauksettoman yhdisteen atomien hapetuslukujen summan on oltava nolla. Esimerkiksi vesimolekyylin vetyatomien ja happiatomin hapetuslukujen summan on oltava nolla. Moniatomiselle ionille hapetuslukujen summan on oltava ionin varaus. Esimerkiksi karbonaatti-ionissa CO32- on atomien hapetuslukujen summan oltava -II.
Yleensä alkalimetallien, kuten Li, Na tai K, hapetusluku on +I, ja maa-alkalimetallien, kuten Mg tai Ca, hapetusluku on +II.
Alkuaineiden hapetusluvut löytyvät monista taulukkokirjoista. Monilla alkuaineilla, kuten useimmilla siirtymämetalleilla, on useita hapetuslukuja. Tällaisten alkuaineiden atomien elektronirakenne on sellainen, että atomit voivat luovuttaa tai ottaa vastaan eri määriä elektroneja. Eri yhdisteissä näillä atomeilla voi siis olla erilaiset hapetusluvut.
Hapettumis-pelkistymisreaktiot voidaan kuvata puolireaktiolla.
Al + Cu2+ -> Al3+ + Cu
Osareaktiot: Al -> Al3+ + 3e- (luovuttaa kolme) *2
Cu2+ 2e- -> Cu (vastaanottaa kaksi) *3
Kokonaisreaktio: 2 Al + 3 Cu2+ -> 2 Al3+ + 3 Cu
Jalompi metalli pelkistyy ja epäjalompi hapettuu kun jalomman metallin hapettunut muoto on yhteydessä epäjalomman metallin kanssa.
Termiittireaktio
Kokeessa on tarkoitus havainnollistaa, eksotermisessä reaktiossa voi vapautua runsaastikin energiaa. Tässä tapauksessa vapautuva lämpö riittää sulattamaan reaktiossa muodostuvan raudan nesteeksi.
Välineet:
alumiinijauhetta Al(s)
rauta(iii)oksidia Fe2O3(s)
100 ml:n dekantterilasi
rautalevy tai tiiliskivi
magnesiumnauhaa
kaasupoltin
TEE TYÖ VETOKAAPISSA!
Työn suoritus
Punnitse noin 3g alumiinijauhetta ja noin 9 g rautaoksidia 100 ml:n dekantterilasissa ja sekoita huolellisesti.
Kaada seos tiiliskiven tai rautalevyn päälle vetokaapissa.
Aseta seokseen noin 5 cm:n pätkä magnesiumnauhaa pystyyn.
Sytytä magnesiumnauha palamaan kaasupolttimella ja sulje vetokaapin ovi.
2 Al(s) + Fe2O3(s) → Al2O3(s) + 2 Fe(l)
Mitkä aineet hapettuvat reaktiossa ja mitkä pelkistyvät? Arvioi reaktiossa vapautuvan lämmönmäärää muodostumisentalpioiden avulla ja vertaa tulosta vaikkapa bensiinin palamiseen.
Harjoitukset 2.3, 2.4, 2.6, 2.7
Protoninsiirtoreaktiot
Happo on aine joka luovuttaa protonin (H+), emäs on aine joka vastaanottaa protonin. Tapahtuu protolyysireaktio protolyyttien välillä.
Amfolyytti on aine joka voi toimia happona tai emäksenä. esim vesi tai aminohapot.
Vahvat hapot protolysoituvat vedessä täysin, heikkojen happojen molekyyleistä vain osa luovuttaa protonin.
Moniarvoiset hapot voivat luovuttaa useita protoneita.
Neutraloitumisreaktiossa vesiliuoksen oksonium- ja hydroksidi ionit reagoivat muodostaen vettä. Samalla syntyy suolaa.
Esim.
Harjoituksia 2.8, 2.9, 2.10, 2.11
Raportit tähän
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Reaktioiden luokittelua
Saostusreaktiot ovat tyypillisiä suoloille.
Esim. 2.14
Hajoamisreaktiossa yhdestä lähtöaineesta syntyy useampia reaktiotuotteita kuten vaikkapa räjähdysreaktioissa.
Esim. 2.19
Palamisreaktio tarkoittaa aineen reaktiota hapen kanssa.
Esim. Etanoli palaa
Hiiltä, vetyä ja happea sisältävien tuotteiden palaessa syntyy hiilidioksidia ja vettä. Jos happea ei ole riittävästi syntyy lisäksi vaarallista hiilimonoksidia.
Harjoituksia 2.16, 2.17, 2.18, 2.20
Rajoittava tekijä kemiallisissa reaktioissa
Useita lähtöaineita kuluttavissa reaktioissa jokin lähtöaineista voi loppua muita ennen ja pysäyttää näin reaktion.
Esim 3.3
Esim. 3.5
Harjoituksia 3.2, 3.4, 3.6
Kaasulaskut
Yleinen kaasujen tilanyhtälö
pV=nRT
p = paine (bar)
V = tilavuus (dm3)
n = kaasujen ainemäärä (mol)
R = kaasuvakio (0,0831451 bar*dm^3*mol^-1*K^-1=8,314 J*mol^-1*K^-1)
T = lämpötila K
NTP-olosuhteet:
T = 20°C
p = 1,01325 bar
Tällöin yksi mooli ideaalikaasua tarvitsee tilaa 24,055 dm3. Joten NTP-olosuhteissa kaasuille pätee
Vm = 24,055 dm3/mol
Esim.
48,11 l happikaasua on 2 mol.
3 mol typpeä on V = 3 mol ·24,055 l/mol = 72,165 l
Esim. 3.13
Esim. 3.16
Harjoituksia 3.9, 3.15, 3.17
Orgaaniset reaktiot
Orgaanisessa kemiassa hapettumisessa yhdisteen hapen määrä lisääntyy tai vedyn määrä vähenee. Pelkistymisessä päinvastoin.
Alkoholit voidaan luokitella primäärisiin, sekundäärisiin ja tertiäärisiin alkoholeihin.
prim.alk->aldehydi->karb.happo
sek.alk.->ketoni
tert.alk. ei hapetu
Esim 4.1.
Substituutioreaktiot ovat tyypillisiä alkaaneille ja bentseenille.
Esim. 4.7.
Additioreaktiot ovat tyypillisiä tyydyttymättömille yhdisteille. Eliminaatioreaktiota voidaan pitää tämän käänteisreaktiona, tyypillisesti molekyylistä lohkeaa vettä, tyypillinen alkoholeille.
Esim. 4.13
Esim. 4.15
Kondensaatio ja hydrolyysireaktiot ovat toistensa käänteisreaktioita.
Esim. 4.24 a)
Esim. 4.21 a)
Aminohapot sisältävät sekä amino- että karboksyyliryhmän ja esiintyvät kahtaisioneina missä happoryhmän protoni on siirtyneenä aminoryhmälle. Proteiinit eli valkuisaineet muodostuvat aminohaposista amidisidoksella (peptidisidos, polypeptidiketju).
Rasvat ovat kemialliselta rakenteeltaan glyserolin estereitä.
Esim. 4.26 a)
Harjoituksia 4.4, 4.8, 4.18, 4.21 b), 4.24 b), 4.26 b)
Energian muutokset reaktiossa
Kemialliseen yhdisteeseen on sitoutunut energiaa
Kineettisenä energiana (rakenneosien liike)
Potentiaalienergiana (kemialliset sidokset)
Kemiallinen reaktio on sidosten katkeamista ja uusien muodostumista. Kun sidos katkeaa, se vaatii energiaa, kun sidos muodostuu, energiaa vapautuu.
Entalpia H tarkoittaa yhdisteeseen sitoutunutta energiaa.
Entalpiamuutos ∆H = H(lopputuotteet) – H(lähtöaineet)
Esim. 1 mooli metaania palaa CH4(g) + 2 O2 (g) -> CO2 (g)+ 2 H2O (g) ∆H < 0

Hessin laki
Hessin laki: Energia ei häviä kemiallisessa reaktiossa eli entalpiamuutos on sama riippumatta välivaiheista.
Esim. 5.18
Huom! Vesiliuoksissa reaktioentalpia on
∆H =- cm∆T
c = veden ominaislämpökapasiteetti
m = veden massa
∆T = lämpötilan muutos
Harjoituksia 5.7, 5.9, 5.11
Reaktiolämmön kokeellinen määrittäminen
Työ 13 Hessin lain soveltaminen
Reaktiolämmön laskeminen
Erilaisia entalpiamuutoksia
- Muodostumislämpö: entalpiamuutos kun yhdiste syntyy alkuaineistaan
- Palamislämpö: entalpiamuutos kun aine reagoi hapen kanssa
- Liukenemislämpö: entalpiamuutos kun aine liukenee (veteen)
Jos muodostumisentalpioita ei ole käytettävissä voidaan reaktioentalpiaa yrittää arvioida sidosenergioiden avulla. (Menetelmän heikkous on sidosenergioiden ollessa keskimääräisiä arvoja kullekin sidostyypille vrt H - CH3ja H – CH2OH)
Esim. Metaanin palaminen CH4(g) + 2 O2 (g) -> CO2 (g)+ 2 H2O (g)
Lähtöaineiden sidoksia hajoaa (energiaa sitoutuu)
4 moolia C-H sidoksia 4 mol * 412 kJ/mol = 1648 kJ
2 mol O=O sidoksia 2 mol * 496 kJ/mol = 992 kJ
yht. 2640 kJ
Tuotteissa sidoksia syntyy eli energiaa vapautuu
2 mol C=O sidoksia 2*mol-743kJ/mol = -1486 kJ
4 mol O-H sidoksia 4 mol * -463 kJ/mol = -1852 kJ
yht. -3338 kJ
joten ∆H = 2640 kJ + (-3338 kJ) = -698 kJ
Harjoituksia 5.12, 5.14, 5.17
Entropia ja reaktion spontaanisuuden ennustaminen
Entropia S on suure joka kuvaa systeemin epäjärjestyksen määrää. Eristetyssä systeemissä entropia kasvaa (termodynamiikan 2. pääsääntö).
dS = S(tuotteet) – S(lähtöaineet)
Esim.
Vesi höyrystyy H2O(l) -> H20(g) dS>0
Vesi tiivistyy H20(l) -> H20(s) dS=-22 J/K< 0.
Huom! Koska jälkimmäinen on eksoterminen reaktio, kasvaa ympäristön entropia ja samalla kokonaisentropia dS(kok) = dS(ymp) + dS(syst) eikä tapahtuma ole termodynamiikan 2.pääsäännön vastainen.
Reaktion spontaanisuus voidaan ennustaa Gibbsin enegiamuutoksen dG avulla.
dG = dH - TdS
Reaktio tapahtuu spontaanisti jos dG<0.
Esim. Veden jäätymisessä vapautuva energia dH=-6010 J.
Jolloin lämpötilassa -10C = 263K
dG=-6010 kJ – 263K*(-22 J/K) = -224 J
Ja lämpötilassa 25C = 298 K
dG =-6010 – 298K*(-22 J/K) = 546 J
Harj. 1.2. ja 1.3 s.22





