6.1 Biologisten reaktioiden perusteet
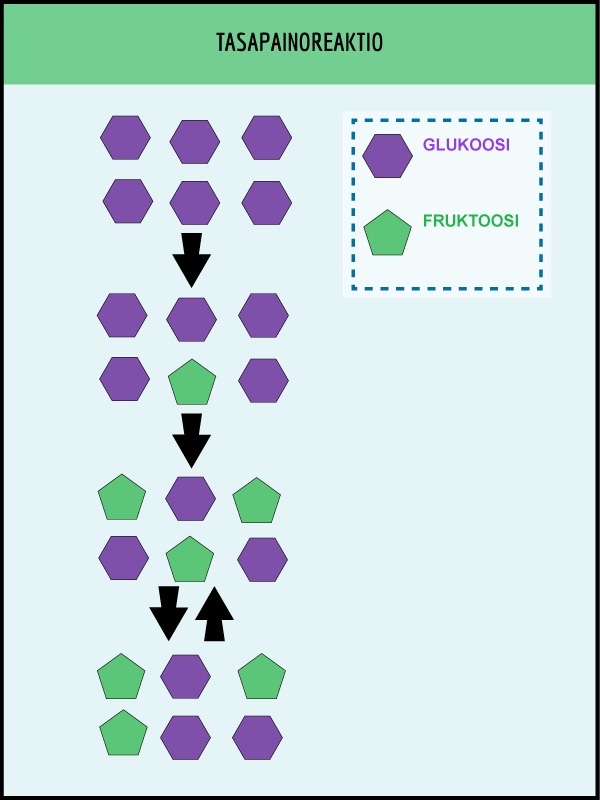 Monet biologiset reaktiot ovat tasapainoreaktioita. Sillä tarkoitetaan yksinkertaistettuna sitä, että reaktion loppuessa myös lähtöainetta on jäljellä. Esimerkiksi jos reaktioastiaan laitetaan aluksi pelkkää fruktoosia (hedelmäsokeri), se muuttuu hitaaksi osittain glukoosiksi (rypälesokeri). Lopulta reaktio saavuttaa kyllästyspisteen, jossa glukoosin ja fruktoosin määrät eivät enää muutu. Tällöin reaktio on tasapainossa: glukoosi muuttuu yhtä nopeasti fruktoosiksi kuin fruktoosi glukoosiksi.
Monet biologiset reaktiot ovat tasapainoreaktioita. Sillä tarkoitetaan yksinkertaistettuna sitä, että reaktion loppuessa myös lähtöainetta on jäljellä. Esimerkiksi jos reaktioastiaan laitetaan aluksi pelkkää fruktoosia (hedelmäsokeri), se muuttuu hitaaksi osittain glukoosiksi (rypälesokeri). Lopulta reaktio saavuttaa kyllästyspisteen, jossa glukoosin ja fruktoosin määrät eivät enää muutu. Tällöin reaktio on tasapainossa: glukoosi muuttuu yhtä nopeasti fruktoosiksi kuin fruktoosi glukoosiksi.
Biologisten reaktioiden ongelmana on usein niiden hitaus. Jos astiaan laitetaan glukoosia, sen muuttuminen vedeksi ja hiilidioksidiksi itsestään kestää tuhansia vuosia. Sen sijaan solussa sama reaktio tapahtuu sekunnin murto-osassa!
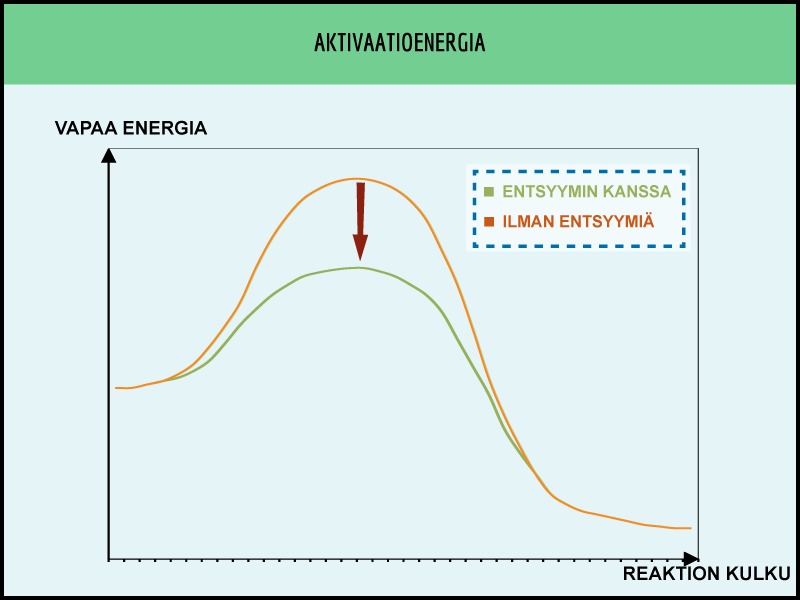 Reaktion hitaus johtuu sen korkeasta aktivaatioenergiasta. Vaikka reaktio vapauttaisi paljon energiaa (esimerkiksi puun palaminen), se ei välttämättä tapahdu ilman riittävää alkuenergiaa. Esimerkiksi puu ei syty metsässä itsestään palamaan. Sen sijaan salaman puuhun tuoma suuri energiamäärä saa sen syttymään. Tällöin puuhun sitoutunut kemiallinen energia vapautuu lämpöenergiaksi.
Reaktion hitaus johtuu sen korkeasta aktivaatioenergiasta. Vaikka reaktio vapauttaisi paljon energiaa (esimerkiksi puun palaminen), se ei välttämättä tapahdu ilman riittävää alkuenergiaa. Esimerkiksi puu ei syty metsässä itsestään palamaan. Sen sijaan salaman puuhun tuoma suuri energiamäärä saa sen syttymään. Tällöin puuhun sitoutunut kemiallinen energia vapautuu lämpöenergiaksi.
Aktivaatioenergiaa pienentäviä yhdisteitä sanotaan katalyyteiksi. Ne katalysoivat eli nopeuttavat kemiallisia reaktioita. Ne eivät kuitenkaan pysty kääntämään reaktion suuntaa. Katalyyttejä käyttämällä vedestä ja hiilidioksidista ei saada rakentumaan puuta. Sen sijaan puun palamista voidaan nopeuttaa katalyyteillä. Katalyytit eivät myöskään kulu reaktioissa.
Biologisia katalyyttejä kutsutaan entsyymeiksi. Entsyymit voivat olla hyvin monimutkaisia molekyylejä. Ne ovatkin useimmiten suurikokoisia molekyylejä. Useimmat entsyymit ovat proteiineja, mutta kaikki proteiinit eivät ole entsyymejä.