Ionisidos ja ioniyhdiste
Lisätietoa - ionisoitumisen reaktioyhtälöt
(Tämä esitystapa käydään huolellisemmin metallien kemiassa)
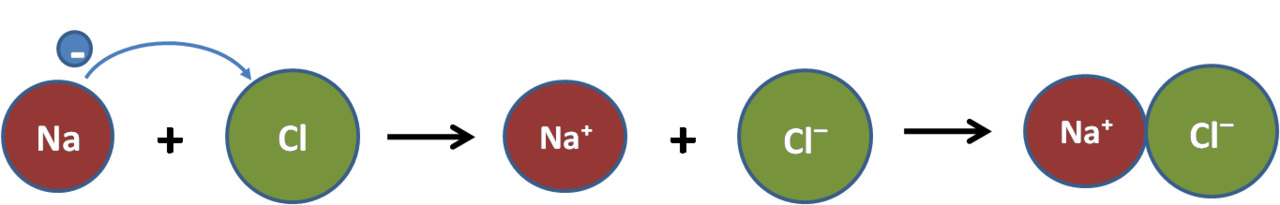
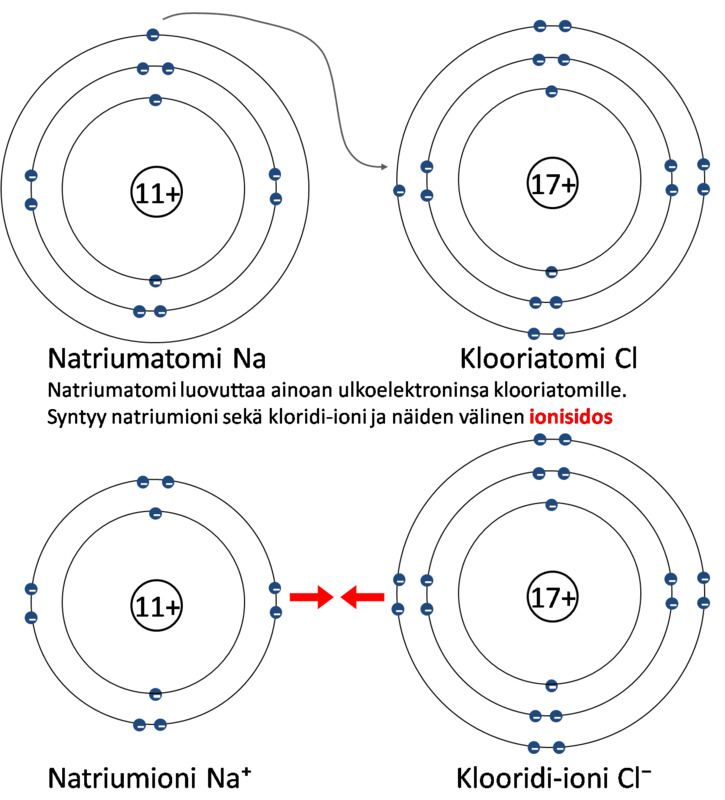
Natriumatomi luovuttaa elektronin ja muuttuu natriumioniksi:
Na → Na+ + e−

Klooriatomi vastaanottaa elektronin ja muuttuu kloridi-ioniksi:
Cl + e− → Cl−
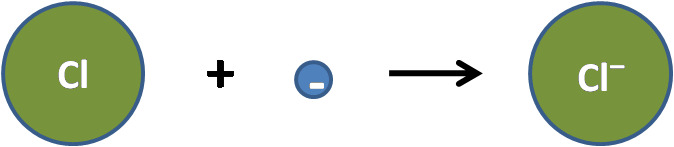
Yhdistelmä: kloori vastaanottaa elektronin natriumilta ja molemmat ionisoituvat
muodostaen natriumkloridia eli ruokasuolaa
Na + Cl → Na+ + Cl− → NaCl
Ioniyhdisteet ja niiden ominaisuudet
- ioniyhdistettä sitoo ionisidos
- se on positiivisen ja negatiivisen ionin välinen vuorovaikutus
- ioniyhdisteitä sanotaan suoloiksi
- muodostuvat metallista Ⓔ natrium ja epämetallista Ⓔ kloori
- kiinteinä kovia mutta hauraita, eivät johda sähköä
- sulatettuina tai vesiliuoksessa sähköä johtavia
- korkea sulamispiste
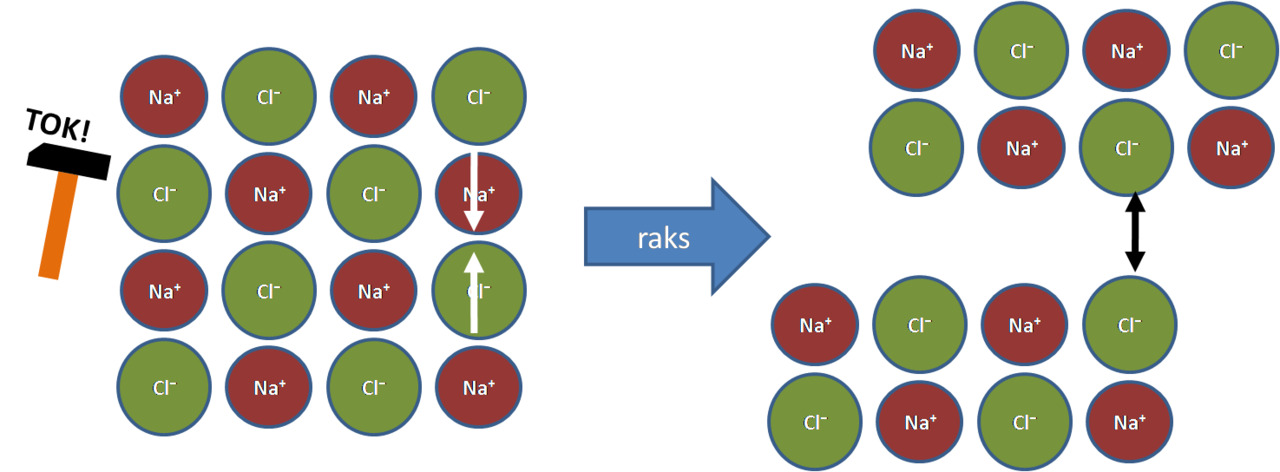
Kuva:
Vasen: Kide on kovaa, koska ionien paikat on tarkasti määrätty (puoleensa vetävä sähköinen vuorovaikutus)
Oikea: Kide on hauras. Kopautus liikauttaa samanmerkkiset ionit vierekkäin ja kide hajoaa (hylkivä sähköinen vuorovaikutus)
Nimeäminen ja kaava
- Metalli ennen epämetallia, epämetallissa di-pääte.
Ⓔ Natriumkloridi, NaCl - Ionien varaukset, + tai -, eivät näy kaavasta
- Ionien lukumäärä näkyy tarvittaessa alaindeksissä
Ⓔ Kalsiumkloridi, CaCl2
yhtä kalsiumionia kohden on kaksi kloridi-ionia
SYY:
Kalsiumionin varaus on +2 ja kloridi-ionin -1
Sähkövarausten pitää silti mennä tasan:
Ca2+ + 2 Cl− → CaCl2
SEURAUS:
Kalsiumkloridin pienin rakenneyksikkö sisältää yhden kalsiumionin ja kaksi kloridi-ionia

Moniatomiset ionit
Joitain moniatomisia ioneita on syytä tietää ja tunnistaa, koska niitä esiintyy usein käyttämissämme suolaliuoksissa.
- Nitraatti-ioni, NO3− ionin varaus -1 tärkeä
- Sulfaatti-ioni, SO42− ionin varaus -2 tärkeä
- Fosfaatti-ioni, PO43− ionin varaus -3 ei kovin tärkeä
- Ammoniumioni, NH4+ ionin varaus +1 tärkeähkö
Moniatomisten suoloja:
Ⓔ Ammoniumkloridi, NH4Cl - salmiakki
Ⓔ Kuparisulfaatti, CuSO4 - sininen suola ja liuos
Ⓔ Kuparinitraatti, Cu(NO3)2 - näin merkitään, että yhtä kupari-ionia kohden on kaksi nitraatti-ionia
Kahden suolan välinen reaktio
Kaksi suolaa eli ioniyhdistettä voidaan sekoittaa toisiinsa liuoksina
Suola + suola → kaksi uutta suolaa
Ⓔ natriumkloridi + hopeanitraatti → natriumnitraatti + hopeakloridi
NaCl + AgNO3 → NaNO3 + AgCl
Kuva: suolojen sekoituksessa kaikki neljä suolaa. Hopeakloridi kuitenkin saostuu pohjalle ja liuoksen veden kanssa muodostaa natriumnitraatti. Katso liukoisuustaulukkoa alempana.

Ioniyhdisteiden liukoisuustaulukko:

Ⓔ * Muodosta ja tasapainota kaliumfluoridin ja magnesiumkloridin reaktio ja tarkista sakka. Ratkaisu
Ⓔ *** Muodosta ja tasapainota kuparisulfaatin ja natriumnitraatin rektio ja tarkista sakka. Ratkaisu