Muut Tehtävät
5,2 Tehtävät S.149
T.17
Laatikossa on ilmakehässä esiintyviä kaasuja.
a) Kirjoita kunkin kaasun kemiallinen merkki tai kaava
Typen oksidit NOx
Argon Ar
Rikkidioksidi SO2
Helium He
Happi O
Hiilidioksidi CO2
Otsoni O3
Metaani CH4
Vesihöyry H2O(g)
Vety H
Typpi N
b) Mitkä ovat kolme ilmakehässä eniten esiintyvää kaasua?
Typpi 78,2%
Happi 20,9%
Argon 0,93%
c) Mikä kaasuista estää haitallinen UV-säteilyn pääsyn maapallolle?
Otsoni
d) Mikä ilman kaasuista reagoi herkimmin?
Happi
e) Mitkä kaasut ovat fossiilisten polttoaineiden päästöjä?
Rikkidioksidi ja hiilidioksidi
f) Mitkä kaasut joutuvat ilmakehään pääasiassa liikenteen päästöinä?
Typen oksidit
T.19
Elokuussa 2014 kello 12.00 Helsingissä mannerheimintiellä otsonipitoisuus oli . Käytä hyväksi talukkokirjasta löytyvää ilman tiheyttä ja ilmoita otsonipitoisuus ppm-arvona.
. Käytä hyväksi talukkokirjasta löytyvää ilman tiheyttä ja ilmoita otsonipitoisuus ppm-arvona.
T.20
Ympäristökeskuksen mittauksen mukaan ilman otsonipitoisuus Kuopion keskustassa oli eräänä iltana 0,040 ppm. Käyttäen hyväksi taulukkokirjassa ilmoitettua ilman tiheyttä, ilmoita otsonipitoisuus yksikössä mg/m3.
T.21
Metaanikaasua (CH4(g)) syntyy eloperäisen jätteen hajotesa hapettomissa olosuhteissa. Metaania syntyy siten esimerkiksi kaatopaikoilla , luonnon kosteikoilla, soilla ja vesistöjen pohjakerrksissa. Se on ihmisen tuottamista kasvihuonekaasuista toiseksi merkittävin ilmaston lämpenemistä lisäävä kaasu hiilidioksidin jälkeen. Ilman metaanipitoisuus oli 1800 ppb vuonna 2010, jonka jälkeen pitoisuus on pysynyt lähes muuttumattomana. Laske, kuinka monta millilitraa metaania yksi kuutiometri ilmaa sisältää.
T.22
Tulkitse oheista kuvaajaa.
a) Minkä vuoden arvoihin ilmaston lämpötilaa verrataan?
b) Minä vuonna hiilidioksidipitoisuuden seuranta on aloitettu?
c) Miten lämpötilan muutos aikavälillä 1960-1980 eroaa aikavälin 1980-2000 muutoksesta?
d) Arvioi kuvaajan avulla, kuinka paljon (ppm) hiilidioksidipitoisuus kasvoi vuodessa aikavälillä 1920-1960 ja 1960-2000.
Laatikossa on ilmakehässä esiintyviä kaasuja.
a) Kirjoita kunkin kaasun kemiallinen merkki tai kaava
Typen oksidit NOx
Argon Ar
Rikkidioksidi SO2
Helium He
Happi O
Hiilidioksidi CO2
Otsoni O3
Metaani CH4
Vesihöyry H2O(g)
Vety H
Typpi N
b) Mitkä ovat kolme ilmakehässä eniten esiintyvää kaasua?
Typpi 78,2%
Happi 20,9%
Argon 0,93%
c) Mikä kaasuista estää haitallinen UV-säteilyn pääsyn maapallolle?
Otsoni
d) Mikä ilman kaasuista reagoi herkimmin?
Happi
e) Mitkä kaasut ovat fossiilisten polttoaineiden päästöjä?
Rikkidioksidi ja hiilidioksidi
f) Mitkä kaasut joutuvat ilmakehään pääasiassa liikenteen päästöinä?
Typen oksidit
T.19
Elokuussa 2014 kello 12.00 Helsingissä mannerheimintiellä otsonipitoisuus oli
T.20
Ympäristökeskuksen mittauksen mukaan ilman otsonipitoisuus Kuopion keskustassa oli eräänä iltana 0,040 ppm. Käyttäen hyväksi taulukkokirjassa ilmoitettua ilman tiheyttä, ilmoita otsonipitoisuus yksikössä mg/m3.
T.21
Metaanikaasua (CH4(g)) syntyy eloperäisen jätteen hajotesa hapettomissa olosuhteissa. Metaania syntyy siten esimerkiksi kaatopaikoilla , luonnon kosteikoilla, soilla ja vesistöjen pohjakerrksissa. Se on ihmisen tuottamista kasvihuonekaasuista toiseksi merkittävin ilmaston lämpenemistä lisäävä kaasu hiilidioksidin jälkeen. Ilman metaanipitoisuus oli 1800 ppb vuonna 2010, jonka jälkeen pitoisuus on pysynyt lähes muuttumattomana. Laske, kuinka monta millilitraa metaania yksi kuutiometri ilmaa sisältää.
T.22
Tulkitse oheista kuvaajaa.
a) Minkä vuoden arvoihin ilmaston lämpötilaa verrataan?
b) Minä vuonna hiilidioksidipitoisuuden seuranta on aloitettu?
c) Miten lämpötilan muutos aikavälillä 1960-1980 eroaa aikavälin 1980-2000 muutoksesta?
d) Arvioi kuvaajan avulla, kuinka paljon (ppm) hiilidioksidipitoisuus kasvoi vuodessa aikavälillä 1920-1960 ja 1960-2000.
Tehtävät 5,1 S.140
T.1
Merkitse oheiseen piirrokseen oikeaan kohtaan
a) Poolinen kovalenttinen sidos
- Vedyn ja hapen välisen sidos on poolinen kovalenttinen sidos.
b) Negatiivinen osittaisvaraus
- Happi
c) Positiivinen osittaisvaraus
- Vety
d) Vetysidokset
- Vesi molekyylien välissä.
T.2
Vasemmassa mittalasissa on 50 ml vettä ja oikeassa 50 ml etanolia. Kun nesteet yhdistetään, loputilavuus on alle 100 ml. Miten selität kokeen havainnot?
- Kokonaisuus pienenee, sillä etanolimolekyylit muodostavat vesimolekyylien kanssa vetysidoksia.
- Etanolilla on yksi ylimääräinen OH molekyyli, joka sitoutuu vesi molekyylin OH osan tilalle veteen liuottaessa.
T.3
Selitä,
a) Mitä tapahtuu sidostasolla veden höyrystyessä?
- Veden kiehuessa vesimolekyylien välisiä vetysidoksia katekeaa ja muodostuu vesihöyryä.
b) Miksi vesi laajenee jäätyessään?
- Kun vesi jäätyy, vesi molekyylien väliin jää enemmän tilaa kuin nestemäisessä vedessä.
c) Miksi vesi on poolinen aine?
- Koska vedyllä ja hapella on elektroninegatiivisuus ero.
d) Mitä tarkoittaa ioni-dipolisidos?
- Esimerkiksi kun suola liukenee veteen, vesi molekyyli katkee suolan aikaisemmat sidokset, ja lähtee itse ottamaan kloorin ja natriumin atomit vastaan.
- Se onnitstuu, kun vedellä olevat vety atomit ovat positiivisesti varautuneet, ne ottavat negatiivisen kloori atomin vastaan.
- Ja negatiivinen happi atomi ottaa natrium atomia vastaan.
e) Miksi veden kiehumispiste on korkeampi kuin hapen?
- Koska vesi molekyyli välisien sidokset ovat vahvempia kuin hapen.
T.5
Selitä, mitä tahtumia oheiset yhtälöt kuvaavat. Mitä kemiallisia sidoksia tapahtumissa katkeaa ja mitä muodostuu.
a) H2O(l) --> H2O(g)
- Vesi höyrystyy
b) KI (s) --> K+(aq) + I-(aq)
- Kloori liukenee veteen
c) CH3OH(I) --> CH3OH(aq)
- Metanoli liukenee veteen
T.6
Perustele, miksi CO2(g) ja N2(g) liukenevat veteen paljon huonnommin kuin NH3(g) ja HCl(g).
- Hiilidioksidi ja typpi ovat koostuneet poolittomista molekyyleista eli ne ovat poolittomi ja aineita.
- Poolittomien aineiden liukoisuus veteen on huonno.
T.8
Mineraalisuola sisältää muun muassa kaliumjodidia (KI)
a) Selitä, mitä tapahtuu (mitkä sidokset katkeavt, mitä sidoksia muodostuu), kun kaliumjodidi liukenee veteen.
- Kaliumjodidin ionihilaa koossapitävät ionisidokset katkeavat.
- Myös vesi molekyylin vetysidos katkeaa.
- Vesimolekyylit ympyröivät ionihilasta irronneet ionit ioni-dipolisidoksilla, jolloin muodostuu akvaioneja.
b) Mallinna piirroksella kaliumjodidin liukeneminen veteen.
c) Mitä tarkoitetaan k+- ja I-- ionien hydratoitumisella.
- Eli niiden muuttuminen akvaioneksi.
d) Mallinna muodostuvia akvaioneja siten, että kumpaakin ionia ympäröi neljä vesimolekyyliä.
e) Kirjoita Kl(s):n liukenemistapahtumaa kuvaava yhtälö.
Kl(s)--> K+(aq)+I-(aq)
T.10.
Selitä
a) Miksi lämmin kivennäisvesi kuplii enemmän kuin kylmä
- Kivenäisvesi sisältää veteen liuennutta hiilidioksidia. Kaasujen liukoisuus pienenee, kun lämpötila nousee. Hiilidioksidia liukenee siten lämpimään juomaan vähemmän kuin kylmään. Siksi kivennäisveden lämmetessä vapautuu kaasua, mikä näkyy kuplimisena.
b) Miksi täysinäistä virvoitusjuomapulloa ei kannata säilyttää pitkään aurinkopaisteessa
- Hiilidioksidin liukoisuus pienenee, kun juoma on lämpiää. pulloon näin muodostuva paine voi rikkoa pullon.
c) Miksi mehua pakastettaessa pulloja ei kannata täyttää aivan täyteen
- Vesi laajenee jäätyessään. ja mehua tilavuus kasvaa. Mikäli pullo on täytetty aivan täyteen, laajeneva mehu voi rikkoa pullon.
Merkitse oheiseen piirrokseen oikeaan kohtaan
a) Poolinen kovalenttinen sidos
- Vedyn ja hapen välisen sidos on poolinen kovalenttinen sidos.
b) Negatiivinen osittaisvaraus
- Happi
c) Positiivinen osittaisvaraus
- Vety
d) Vetysidokset
- Vesi molekyylien välissä.
T.2
Vasemmassa mittalasissa on 50 ml vettä ja oikeassa 50 ml etanolia. Kun nesteet yhdistetään, loputilavuus on alle 100 ml. Miten selität kokeen havainnot?
- Kokonaisuus pienenee, sillä etanolimolekyylit muodostavat vesimolekyylien kanssa vetysidoksia.
- Etanolilla on yksi ylimääräinen OH molekyyli, joka sitoutuu vesi molekyylin OH osan tilalle veteen liuottaessa.
T.3
Selitä,
a) Mitä tapahtuu sidostasolla veden höyrystyessä?
- Veden kiehuessa vesimolekyylien välisiä vetysidoksia katekeaa ja muodostuu vesihöyryä.
b) Miksi vesi laajenee jäätyessään?
- Kun vesi jäätyy, vesi molekyylien väliin jää enemmän tilaa kuin nestemäisessä vedessä.
c) Miksi vesi on poolinen aine?
- Koska vedyllä ja hapella on elektroninegatiivisuus ero.
d) Mitä tarkoittaa ioni-dipolisidos?
- Esimerkiksi kun suola liukenee veteen, vesi molekyyli katkee suolan aikaisemmat sidokset, ja lähtee itse ottamaan kloorin ja natriumin atomit vastaan.
- Se onnitstuu, kun vedellä olevat vety atomit ovat positiivisesti varautuneet, ne ottavat negatiivisen kloori atomin vastaan.
- Ja negatiivinen happi atomi ottaa natrium atomia vastaan.
e) Miksi veden kiehumispiste on korkeampi kuin hapen?
- Koska vesi molekyyli välisien sidokset ovat vahvempia kuin hapen.
T.5
Selitä, mitä tahtumia oheiset yhtälöt kuvaavat. Mitä kemiallisia sidoksia tapahtumissa katkeaa ja mitä muodostuu.
a) H2O(l) --> H2O(g)
- Vesi höyrystyy
b) KI (s) --> K+(aq) + I-(aq)
- Kloori liukenee veteen
c) CH3OH(I) --> CH3OH(aq)
- Metanoli liukenee veteen
T.6
Perustele, miksi CO2(g) ja N2(g) liukenevat veteen paljon huonnommin kuin NH3(g) ja HCl(g).
- Hiilidioksidi ja typpi ovat koostuneet poolittomista molekyyleista eli ne ovat poolittomi ja aineita.
- Poolittomien aineiden liukoisuus veteen on huonno.
T.8
Mineraalisuola sisältää muun muassa kaliumjodidia (KI)
a) Selitä, mitä tapahtuu (mitkä sidokset katkeavt, mitä sidoksia muodostuu), kun kaliumjodidi liukenee veteen.
- Kaliumjodidin ionihilaa koossapitävät ionisidokset katkeavat.
- Myös vesi molekyylin vetysidos katkeaa.
- Vesimolekyylit ympyröivät ionihilasta irronneet ionit ioni-dipolisidoksilla, jolloin muodostuu akvaioneja.
b) Mallinna piirroksella kaliumjodidin liukeneminen veteen.
c) Mitä tarkoitetaan k+- ja I-- ionien hydratoitumisella.
- Eli niiden muuttuminen akvaioneksi.
d) Mallinna muodostuvia akvaioneja siten, että kumpaakin ionia ympäröi neljä vesimolekyyliä.
e) Kirjoita Kl(s):n liukenemistapahtumaa kuvaava yhtälö.
Kl(s)--> K+(aq)+I-(aq)
T.10.
Selitä
a) Miksi lämmin kivennäisvesi kuplii enemmän kuin kylmä
- Kivenäisvesi sisältää veteen liuennutta hiilidioksidia. Kaasujen liukoisuus pienenee, kun lämpötila nousee. Hiilidioksidia liukenee siten lämpimään juomaan vähemmän kuin kylmään. Siksi kivennäisveden lämmetessä vapautuu kaasua, mikä näkyy kuplimisena.
b) Miksi täysinäistä virvoitusjuomapulloa ei kannata säilyttää pitkään aurinkopaisteessa
- Hiilidioksidin liukoisuus pienenee, kun juoma on lämpiää. pulloon näin muodostuva paine voi rikkoa pullon.
c) Miksi mehua pakastettaessa pulloja ei kannata täyttää aivan täyteen
- Vesi laajenee jäätyessään. ja mehua tilavuus kasvaa. Mikäli pullo on täytetty aivan täyteen, laajeneva mehu voi rikkoa pullon.
Tehtävät 4,3 S.122
T.29
Hae taulukkokirjasta fluorin, kloorin, bromin ja jodin sulamispisteet. Piirrä kuvaaja, jossa on esitetty halogeenin sulamispiste sen järjestys luvun funktiona.
a) Määritä kuvaajalta, mikä olisi astatiinin sulamispiste.
- Fluori: -219,6°C
- Kloori: -101°C
- Bromi: -7,2°C
- Jodi: 114°C
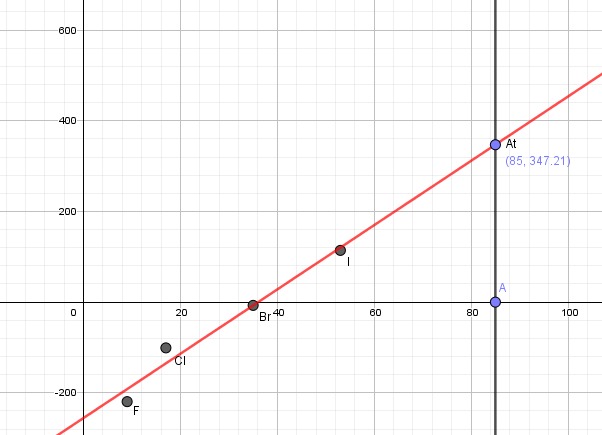
b)Selitä, miksi halogeenin sulamispiste kasvaa ryhmäsäässä alaspäin mentäessä.
- Sulamispiste kasvaa, koska molekyylien koko kasvaa. Suurempien poolittomien halogeenimolekyylien välille muodostuu enemmän dispersiovoimia, sillä hetkellisten dipolien määrä on suurempi moolekyyleissä, jossa on enemmän elektroneja.
T.30
Otsonin kiehumispiste on noin -112°C ja happikaasun alhaisempi, noin -183°C. Miksi kiehumispisteet eroavat toisistaan.
Molemmat hapen allotrooppiset muodot koostuvat poolittomista molekyyleistä. Otsonimolekyylissä on kolme happiatomia kun taas happiatomissa vain kaksi. Otsonimolekyyli on siten suurempi kuin happimolekyyli, joten otsonimolekyylien välille muodostuu enemmän dispersiovoiia kuin happimolekyylien välille.
T.32
Merkitse rastilla, mitä molekyylien välisiä sidoksia taulukon aineissa esiintyy.
T.33
Järjestä sidokset heikommasta vahvimpaan. Mitkä sidoksista muodostuvat atomien välille, mitkä molekyylien välille.
Dispersiovoima < Dipoli-dipolisidos < Vetysidos < Kovalenttinen sidos
T.34
Mitä atomien välisiä ja molekyylien välisiä sidoksia esiintyy suljetussa astiassa, jossa on
a) Happimolekyylejä
- Happiatomien välill on pooliton kovalenttinen kaksoissidos. Molekyylien välillä esiintyy dispersiovoimia.
b) Vertykloridimolekyylejä
- Verty ja klooriatomin välillä on yksinkertainen, poolinen kovalenttinen sidos. Molekyylien välillä esiintyy dipoli-dipolisidoksia.
c) Vesimolekyylejä?
- Vety ja happiatomin väliset sidokset ovat yksinkertaisia, poolisia, kovalenttisia sidoksia. Vesimolekyylien välillä esiintyy vertysidoksia.
T.36
Mallinna piirroksella seuraava tilannetta. Merkitse kuvaan osittaisvaraukset.
a) Vertyjodidimolekyylit sitoutuvat toisiinsa dipoli-dipolisidoksilla.
b) Ammoniakkimolekyylit sitoutuvat toisiinsa vertysidoksilla.
T.43
Tarkastele metaania (CH4), ammoniakkia (NH3) ja vettä (H2O). Selvitä kunkin aineen
a) Atomien väliset sidokset
- Kaikissa molekyyleissä atomien välilä on yksinkertaisia, poolisia, kovalenttisia sidoksia
b) Molekyylihilan rakenne
- Metaanin molekyylihila on koostunut poolittomista metaanimolekyyleistä. Ammoniakin ja veden molekyylihilat puolestaan rakentuvat poolisia dipolimolekyyleistä.
c) Molekyylihilaa koossapitävät sidokset
- Metaanin molekyylihilaa pitävät koossa metaanimolekyylien välille syntyvät dispersiovoimat. Ammoniakin ja veden molekyylihiloissa molekyylien välillä vaikuttavat sekä disperisovoimat että vetysidokset
Hae taulukkokirjasta fluorin, kloorin, bromin ja jodin sulamispisteet. Piirrä kuvaaja, jossa on esitetty halogeenin sulamispiste sen järjestys luvun funktiona.
a) Määritä kuvaajalta, mikä olisi astatiinin sulamispiste.
- Fluori: -219,6°C
- Kloori: -101°C
- Bromi: -7,2°C
- Jodi: 114°C

b)Selitä, miksi halogeenin sulamispiste kasvaa ryhmäsäässä alaspäin mentäessä.
- Sulamispiste kasvaa, koska molekyylien koko kasvaa. Suurempien poolittomien halogeenimolekyylien välille muodostuu enemmän dispersiovoimia, sillä hetkellisten dipolien määrä on suurempi moolekyyleissä, jossa on enemmän elektroneja.
T.30
Otsonin kiehumispiste on noin -112°C ja happikaasun alhaisempi, noin -183°C. Miksi kiehumispisteet eroavat toisistaan.
Molemmat hapen allotrooppiset muodot koostuvat poolittomista molekyyleistä. Otsonimolekyylissä on kolme happiatomia kun taas happiatomissa vain kaksi. Otsonimolekyyli on siten suurempi kuin happimolekyyli, joten otsonimolekyylien välille muodostuu enemmän dispersiovoiia kuin happimolekyylien välille.
T.32
Merkitse rastilla, mitä molekyylien välisiä sidoksia taulukon aineissa esiintyy.
| Molekyyli | Dipoli-dipolisidos | Vetysidos | Dispersiovoima |
| Vesi (H2O) | x | x | |
| Jodi (I2) | x | ||
| Vetykloridi (HCl) | x | x | |
| Ammoniakki (NH3) | x | x | |
| Typpi (N2) | x | ||
| Otsoni (O3) | x | ||
| Divetysulfidi (H2S) | x | x |
T.33
Järjestä sidokset heikommasta vahvimpaan. Mitkä sidoksista muodostuvat atomien välille, mitkä molekyylien välille.
Dispersiovoima < Dipoli-dipolisidos < Vetysidos < Kovalenttinen sidos
T.34
Mitä atomien välisiä ja molekyylien välisiä sidoksia esiintyy suljetussa astiassa, jossa on
a) Happimolekyylejä
- Happiatomien välill on pooliton kovalenttinen kaksoissidos. Molekyylien välillä esiintyy dispersiovoimia.
b) Vertykloridimolekyylejä
- Verty ja klooriatomin välillä on yksinkertainen, poolinen kovalenttinen sidos. Molekyylien välillä esiintyy dipoli-dipolisidoksia.
c) Vesimolekyylejä?
- Vety ja happiatomin väliset sidokset ovat yksinkertaisia, poolisia, kovalenttisia sidoksia. Vesimolekyylien välillä esiintyy vertysidoksia.
T.36
Mallinna piirroksella seuraava tilannetta. Merkitse kuvaan osittaisvaraukset.
a) Vertyjodidimolekyylit sitoutuvat toisiinsa dipoli-dipolisidoksilla.
b) Ammoniakkimolekyylit sitoutuvat toisiinsa vertysidoksilla.
T.43
Tarkastele metaania (CH4), ammoniakkia (NH3) ja vettä (H2O). Selvitä kunkin aineen
a) Atomien väliset sidokset
- Kaikissa molekyyleissä atomien välilä on yksinkertaisia, poolisia, kovalenttisia sidoksia
b) Molekyylihilan rakenne
- Metaanin molekyylihila on koostunut poolittomista metaanimolekyyleistä. Ammoniakin ja veden molekyylihilat puolestaan rakentuvat poolisia dipolimolekyyleistä.
c) Molekyylihilaa koossapitävät sidokset
- Metaanin molekyylihilaa pitävät koossa metaanimolekyylien välille syntyvät dispersiovoimat. Ammoniakin ja veden molekyylihiloissa molekyylien välillä vaikuttavat sekä disperisovoimat että vetysidokset
Tehtävät 4,2 S.114
T.9
Selvitä, millainen ioni muodostuu, kun seuraava atomi saa jalokaasun elektronirakenteen.
a) Litium: Li+
b) Typpi: N3-
c) Strontium: Sr2+
d) Alumiini: Al3+
e) Happi: O2-
f) Fluori: F-
Muodosta ioneista kuusi eri yhdistettä.
LiF, AlN, SrO, Al2O3, Li3N
T.10
X ja Y ovat alkuaineita, jotka järjestysluvut ovat 9 ja 19
a) Tunnista alkuaineet taulukkokirjan avulla.
K (Järjestysluku 19)
F (Järjestysluku 9)
b) Hae taulukkokirjasta näistä alkuaineista muodostuvien ionien kaavat ja kirjoita ionien muodostaman yhdisteen kaava.
K+ + F- -->KF
c) Mitkä seuraavista ominaisuuksista kuvaavat tätä yhdistettä
- Vesiliukoinen
- Hyvä sähköjohtokyky kiinteänä
- Korkea sulamispiste
- Helposti muokattava
- Hyvä lämmöjohtokyky
T.13
Selvitä seuraavien ilmiöiden syy.
a) Kipsistä (CaSO4) valmistetusta koristeesineestä lohkeaa helposti palasia, kun se putoaa lattialle.
- Kipsi on kaksiumsulfaattia, joka on kovaa mutta haurasta ioniyhdistettä. Lattialle putoaminen saa aikaan sen, että sähköisesti samoin varautuneita ioneja joutuu vierekkäin ja näiden hylkimisvoima rikkoo hilarakenteen.
b) Alkaliparistot sisältävät kaliumhydroksidin vesiliuostaa (KOH(aq)).
- Kaliumhydroksidi on ioniyhdise, jonka vesiliuos on elektrolyytti eli se johtaa sähköä.
c) Marmonia (CaSO3) voidaan muotoilla patsaaksi taltalla ja vasaralla.
- Marmori on kalsiumkarbonaattia, joka on kovaa mutta haurasta ioniyhdistettä eli sitä voi muotoilla taltalla ja vasaralla.
T.17
Nimeä seuraavat ioniyhdisteet.
a) NaBr= Natriumbromidi
b) MgCl2= Magnesiumkloridi
c) Al(NO3)3= Alumiininitraatti
d) (NH4)2SO4= Ammoniumsulfaatti
e) NH4CH3COO= Ammoniumasetaatti
f) CaC2O4= Kalsiumoksalaatti
g) Fe2O3= Rauta(III)oksidi
h) FeO= Rauta(II)oksidi
i) AuCl3= Kulta(III)kloridi
T.18
Kirjoita kaava seuraaville ioniyhdisteille.
a) Natriumnitraatti: NaNO3
b) Kalsiumkarbonaatti: CaCO3
c) Kalsiumsulfatti: CaSO4
d) Tina(IV)kloridi: SnCl4
e) Vanadiini(V)oksidi: V2O5
f) Kaliumpermanganaatti: KMnO4
g) Ammoniumfosfaatti: (NH4)3PO4
T.20
Järjestä alkuaineet elektronegatiivisuuden perusteella siten, että elektronegatiivisin on viimeisenä.
Typpi 3,0
Seleeni 2,4
Indium 1,7
Strontium 1,0
Hopea 1,9
Bromi 2,8
Jodi 2,5
Typpi, Bromi, Jodi, Seleeni, Hopea, Indium, Strontium
T.21
Tutki, missä kohdassa jaksollista järjestelmää seuraavat alkuaineet sijaitsevat. Päättele sen perusteella, kumpi alkuaineista on elektronegatiivisempi. Tarkista ennustuksesi taulukkokirjan elektronegatiivisuusarvojen avulla.
a) Bromi ja platina
- Bromi
b) Kalium ja kalsium
- Kalsium
c) Fosfori ja fluori
- Fluori
d) Tina ja titaani
- Tina
T.22
Päättelee, mitkä seuraavista sidoksista ovat poolisia.
C=O
C-H
O-H
H-H
N-H
Poolisia sidoksia ovat kaikki muut paitsi H-H-sidos, koska muissa sidoksissa alkuaineiden välillä on elektronegatiivisuusero.
T.23
Lisää oheisiin molekyyleihin elektronegatiivisuusarvojen perusteella merkinnät ja
ja 
a) Br-Br
b)
C: 4
H:
c) O=C=O
C: 2
O:
d) H-Cl
Cl:
T.25
Tutki seuraavien molekyylien muotoja joko molekyylimallinnusohjelmalla tai taulukkokirjan avulla. Päättele onko molekyyli poolinen vai pooliton. Perustele vastauksesi.
a) Vertyfluori HF
H: 2,1
F: 4,0
v: Poolinen, koska niiden negatiivisuus arvo on eri.
b) Tetrakloorimetaani CCl4 (vertaa metraanimolekyyliin)
C: 2,5
Cl: 3,0
v: Poolinen, koska niiden negatiivisuus arvo on eri.
c) Trikloorimetaani CHCl3
C: 2,5
H: 2,1
Cl: 3,0
v: Poolinen, koska niiden negatiivisuus arvo on eri.
d) Hiilidioksidi CO2
C: 2,5
O: 3,5
v: Poolinen, koska niiden negatiivisuus arvo on eri.
T.27
Nimeä seuraavat molekyyliyhdisteet
a) NO typpioksidi
b) NO2 typpidioksidi
c) SO3 rikkitrioksidi
d) CCl4 tetrakloorimetaani
e) HBr Vetybromidi
f) PCl5 fosforipentakloridi
Selvitä, millainen ioni muodostuu, kun seuraava atomi saa jalokaasun elektronirakenteen.
a) Litium: Li+
b) Typpi: N3-
c) Strontium: Sr2+
d) Alumiini: Al3+
e) Happi: O2-
f) Fluori: F-
Muodosta ioneista kuusi eri yhdistettä.
LiF, AlN, SrO, Al2O3, Li3N
T.10
X ja Y ovat alkuaineita, jotka järjestysluvut ovat 9 ja 19
a) Tunnista alkuaineet taulukkokirjan avulla.
K (Järjestysluku 19)
F (Järjestysluku 9)
b) Hae taulukkokirjasta näistä alkuaineista muodostuvien ionien kaavat ja kirjoita ionien muodostaman yhdisteen kaava.
K+ + F- -->KF
c) Mitkä seuraavista ominaisuuksista kuvaavat tätä yhdistettä
- Vesiliukoinen
- Hyvä sähköjohtokyky kiinteänä
- Korkea sulamispiste
- Helposti muokattava
- Hyvä lämmöjohtokyky
T.13
Selvitä seuraavien ilmiöiden syy.
a) Kipsistä (CaSO4) valmistetusta koristeesineestä lohkeaa helposti palasia, kun se putoaa lattialle.
- Kipsi on kaksiumsulfaattia, joka on kovaa mutta haurasta ioniyhdistettä. Lattialle putoaminen saa aikaan sen, että sähköisesti samoin varautuneita ioneja joutuu vierekkäin ja näiden hylkimisvoima rikkoo hilarakenteen.
b) Alkaliparistot sisältävät kaliumhydroksidin vesiliuostaa (KOH(aq)).
- Kaliumhydroksidi on ioniyhdise, jonka vesiliuos on elektrolyytti eli se johtaa sähköä.
c) Marmonia (CaSO3) voidaan muotoilla patsaaksi taltalla ja vasaralla.
- Marmori on kalsiumkarbonaattia, joka on kovaa mutta haurasta ioniyhdistettä eli sitä voi muotoilla taltalla ja vasaralla.
T.17
Nimeä seuraavat ioniyhdisteet.
a) NaBr= Natriumbromidi
b) MgCl2= Magnesiumkloridi
c) Al(NO3)3= Alumiininitraatti
d) (NH4)2SO4= Ammoniumsulfaatti
e) NH4CH3COO= Ammoniumasetaatti
f) CaC2O4= Kalsiumoksalaatti
g) Fe2O3= Rauta(III)oksidi
h) FeO= Rauta(II)oksidi
i) AuCl3= Kulta(III)kloridi
T.18
Kirjoita kaava seuraaville ioniyhdisteille.
a) Natriumnitraatti: NaNO3
b) Kalsiumkarbonaatti: CaCO3
c) Kalsiumsulfatti: CaSO4
d) Tina(IV)kloridi: SnCl4
e) Vanadiini(V)oksidi: V2O5
f) Kaliumpermanganaatti: KMnO4
g) Ammoniumfosfaatti: (NH4)3PO4
T.20
Järjestä alkuaineet elektronegatiivisuuden perusteella siten, että elektronegatiivisin on viimeisenä.
Typpi 3,0
Seleeni 2,4
Indium 1,7
Strontium 1,0
Hopea 1,9
Bromi 2,8
Jodi 2,5
Typpi, Bromi, Jodi, Seleeni, Hopea, Indium, Strontium
T.21
Tutki, missä kohdassa jaksollista järjestelmää seuraavat alkuaineet sijaitsevat. Päättele sen perusteella, kumpi alkuaineista on elektronegatiivisempi. Tarkista ennustuksesi taulukkokirjan elektronegatiivisuusarvojen avulla.
a) Bromi ja platina
- Bromi
b) Kalium ja kalsium
- Kalsium
c) Fosfori ja fluori
- Fluori
d) Tina ja titaani
- Tina
T.22
Päättelee, mitkä seuraavista sidoksista ovat poolisia.
C=O
C-H
O-H
H-H
N-H
Poolisia sidoksia ovat kaikki muut paitsi H-H-sidos, koska muissa sidoksissa alkuaineiden välillä on elektronegatiivisuusero.
T.23
Lisää oheisiin molekyyleihin elektronegatiivisuusarvojen perusteella merkinnät
a) Br-Br
b)

C: 4
H:
c) O=C=O
C: 2
O:
d) H-Cl
Cl:
T.25
Tutki seuraavien molekyylien muotoja joko molekyylimallinnusohjelmalla tai taulukkokirjan avulla. Päättele onko molekyyli poolinen vai pooliton. Perustele vastauksesi.
a) Vertyfluori HF
H: 2,1
F: 4,0
v: Poolinen, koska niiden negatiivisuus arvo on eri.
b) Tetrakloorimetaani CCl4 (vertaa metraanimolekyyliin)
C: 2,5
Cl: 3,0
v: Poolinen, koska niiden negatiivisuus arvo on eri.
c) Trikloorimetaani CHCl3
C: 2,5
H: 2,1
Cl: 3,0
v: Poolinen, koska niiden negatiivisuus arvo on eri.
d) Hiilidioksidi CO2
C: 2,5
O: 3,5
v: Poolinen, koska niiden negatiivisuus arvo on eri.
T.27
Nimeä seuraavat molekyyliyhdisteet
a) NO typpioksidi
b) NO2 typpidioksidi
c) SO3 rikkitrioksidi
d) CCl4 tetrakloorimetaani
e) HBr Vetybromidi
f) PCl5 fosforipentakloridi
Tehtävät 4,1 S.104
T.1
Seuraavassa on luetelt aumiiin ominaisuuksia. Yhdistä ominaisuus yhteen sopivaankäyttökohteeseen.
Lentokoneiden rakenteet: Kevyt, luja, muokattava, edullinen
Virvotusjuomatölkit: Myrkytön, kierrätettävä, tiivis, hajuton
Lamput: Hejastaa valoa
Lämpöpatterit: Johtaa lämpöä
Kattilat: Johtaa lämpöä, kevyt
Saunan eristeet: Heijastaa lämpösäteilyä, palamaton, lämmöneriste
Alumiinifolio: Tiivis, hajuton, ei läpäisee makuja
Lääkkeiden pakkaukset: Tiivis, hajuton, ei läpäise makuja
Pakastusrasiat: Myrkytön, hajuton, kevyt, ei läpäise makuja
Veneden ja laivojen rakenteet: Kevyt, luja, muokattava, edullinen
Ilma- ja maakapelit: Johtaa sählöä, kevyt, edullinen.
T.2
Alumiini on tärkeä käyttömetalli, jota saadaan luonnossa esiintyvistä alumiiniyhdisteistä ja kierrätettävästä alumiiniromusta. Rakennusteollisuus käyttää alumiinia sen keveyden ja kestävyyden vuoksi. Alumiinia käytetään kuparin sijasta sähkölaitteissa ja johtimissa, koska se on halvempaa kuin kupari. Kotitalouksissa alumiini on tuttu muun muassa juomatölkeistä, foliokalvoista ja paistovuoista.
a) Kuvaa piirroksen avula, miten alumiinin metallihila on rakentunut.
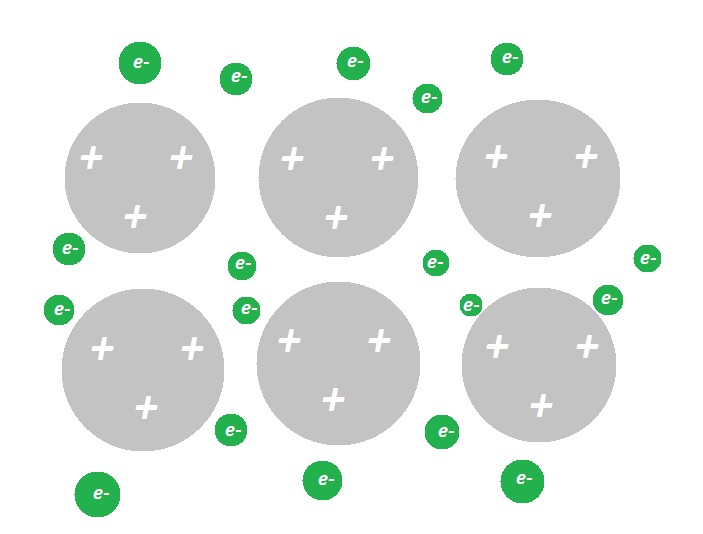
b) Selitä, mikä tekee alumiinimetallista niin kestävää, että sitä käytetään esimerkiksi lentokoneiden siivissä.
- Kun metallihila muodostu, jokainen alumiiniatomi luovuttaa kolme ulkoelektronia. Hilassa on siten runsaasti vapaita elektroneja ja pieniä, positiivisia alumiini-ioeja Al3+. Näiden ionien ja vapaiden elektronien välille muodostuu vahvoja sähköisiä vetovoimia, jotka selittävät alumiinin kestävyyden.
c) Selitä, miksi alumiini soveltuu sähkönjohteeksi.
- Metallin hilarakenteen vapaasti liikkuvat elektronit toimivat sähkön kuljettajina.
d) Selitä, miksi alumiini soveltuu muokata ohueksi alumiinifolioksi.
- Metallihilassa oleva vapaiden elektronien ''meri'' estää positiivisia alumiini-ioneja joutumasta kohdakkain, mistä syystä hilarakenne ei murru.
e) Selitä, miksi alumiini on hyvä paistovuoan materiaali.
- Lämpövärähtely siirtyy hyvin alumiinin metallihilassa, kun vapaat elektronit törmäilevät toisiinsa ja positiivinen metalli-ioneihin.
T.4
Piirrä kuvaaja, josta näkyy miten 1. ja 2. ryhmän metallien sulamispiste muuttuu järjestysluvun kasvaessa. Käytä hyväksi taulukkokirjasta löytyviä arvoja.
a) Mitä voit päätellä kuvaajasta? Miten selität sulamispisteiden muutokset?
- Metallien sulamispiste pienenee kummassalom ryhmässä, kun alkuaineen järjestysluku kasvaa. Poikkeus tästä on magnesium, jonka sulamispiste on alhaisempi kuin kuvajalta voisi olettaa. Sulamispisteen pieneneminen selittyy sillä, että ryhmässä alaspäin mentäessä metallihilan rakenneosana olevan positiivisen ionin koko kasvaa. Suurten ionien eli sähköinen vetovima metalli-ionien ja ulkoelektronien välillä on heikompi.
- Toinen ryhmän metalleilla on huomattavasti korkeammat sulamispisteet kuin esimmäisen tyhmän alkalimetalleilla. Tämä selittyy sillä, että toisen tyhmän metallien metallihila muodostuu positiivista ionesta, joiden varaus on 2+. Lisäksi hilassa on kutakin ionia kohti kaksi vapaata ulkoelektronia. Ensimmäisen ryhmän metallien hila puolestaan rakentuu ionesta, joidem varaus on1+ ja hilassa o kutakin ionia kohti vain yksi vapaa uloelektroni. Lisäksi toisen ryhmän, metallin positiivinen ioni (taulukkokrja). Toisen ryhmän metallien hilarakenne on siten tiiviimpi ja metallisidokset vahvempia.
b) Ennusta kuvaajalta rubidiumin ja strontiumin sulamispisteet.
- Kuvaajalta ennustettujen alkuaineiden sulamispisteet: Rubidium (Rb) n. 40 °C ja strontium (Sr) n. 775 °C.
Seuraavassa on luetelt aumiiin ominaisuuksia. Yhdistä ominaisuus yhteen sopivaankäyttökohteeseen.
Lentokoneiden rakenteet: Kevyt, luja, muokattava, edullinen
Virvotusjuomatölkit: Myrkytön, kierrätettävä, tiivis, hajuton
Lamput: Hejastaa valoa
Lämpöpatterit: Johtaa lämpöä
Kattilat: Johtaa lämpöä, kevyt
Saunan eristeet: Heijastaa lämpösäteilyä, palamaton, lämmöneriste
Alumiinifolio: Tiivis, hajuton, ei läpäisee makuja
Lääkkeiden pakkaukset: Tiivis, hajuton, ei läpäise makuja
Pakastusrasiat: Myrkytön, hajuton, kevyt, ei läpäise makuja
Veneden ja laivojen rakenteet: Kevyt, luja, muokattava, edullinen
Ilma- ja maakapelit: Johtaa sählöä, kevyt, edullinen.
T.2
Alumiini on tärkeä käyttömetalli, jota saadaan luonnossa esiintyvistä alumiiniyhdisteistä ja kierrätettävästä alumiiniromusta. Rakennusteollisuus käyttää alumiinia sen keveyden ja kestävyyden vuoksi. Alumiinia käytetään kuparin sijasta sähkölaitteissa ja johtimissa, koska se on halvempaa kuin kupari. Kotitalouksissa alumiini on tuttu muun muassa juomatölkeistä, foliokalvoista ja paistovuoista.
a) Kuvaa piirroksen avula, miten alumiinin metallihila on rakentunut.

b) Selitä, mikä tekee alumiinimetallista niin kestävää, että sitä käytetään esimerkiksi lentokoneiden siivissä.
- Kun metallihila muodostu, jokainen alumiiniatomi luovuttaa kolme ulkoelektronia. Hilassa on siten runsaasti vapaita elektroneja ja pieniä, positiivisia alumiini-ioeja Al3+. Näiden ionien ja vapaiden elektronien välille muodostuu vahvoja sähköisiä vetovoimia, jotka selittävät alumiinin kestävyyden.
c) Selitä, miksi alumiini soveltuu sähkönjohteeksi.
- Metallin hilarakenteen vapaasti liikkuvat elektronit toimivat sähkön kuljettajina.
d) Selitä, miksi alumiini soveltuu muokata ohueksi alumiinifolioksi.
- Metallihilassa oleva vapaiden elektronien ''meri'' estää positiivisia alumiini-ioneja joutumasta kohdakkain, mistä syystä hilarakenne ei murru.
e) Selitä, miksi alumiini on hyvä paistovuoan materiaali.
- Lämpövärähtely siirtyy hyvin alumiinin metallihilassa, kun vapaat elektronit törmäilevät toisiinsa ja positiivinen metalli-ioneihin.
T.4
Piirrä kuvaaja, josta näkyy miten 1. ja 2. ryhmän metallien sulamispiste muuttuu järjestysluvun kasvaessa. Käytä hyväksi taulukkokirjasta löytyviä arvoja.
a) Mitä voit päätellä kuvaajasta? Miten selität sulamispisteiden muutokset?
- Metallien sulamispiste pienenee kummassalom ryhmässä, kun alkuaineen järjestysluku kasvaa. Poikkeus tästä on magnesium, jonka sulamispiste on alhaisempi kuin kuvajalta voisi olettaa. Sulamispisteen pieneneminen selittyy sillä, että ryhmässä alaspäin mentäessä metallihilan rakenneosana olevan positiivisen ionin koko kasvaa. Suurten ionien eli sähköinen vetovima metalli-ionien ja ulkoelektronien välillä on heikompi.
- Toinen ryhmän metalleilla on huomattavasti korkeammat sulamispisteet kuin esimmäisen tyhmän alkalimetalleilla. Tämä selittyy sillä, että toisen tyhmän metallien metallihila muodostuu positiivista ionesta, joiden varaus on 2+. Lisäksi hilassa on kutakin ionia kohti kaksi vapaata ulkoelektronia. Ensimmäisen ryhmän metallien hila puolestaan rakentuu ionesta, joidem varaus on1+ ja hilassa o kutakin ionia kohti vain yksi vapaa uloelektroni. Lisäksi toisen ryhmän, metallin positiivinen ioni (taulukkokrja). Toisen ryhmän metallien hilarakenne on siten tiiviimpi ja metallisidokset vahvempia.
b) Ennusta kuvaajalta rubidiumin ja strontiumin sulamispisteet.
- Kuvaajalta ennustettujen alkuaineiden sulamispisteet: Rubidium (Rb) n. 40 °C ja strontium (Sr) n. 775 °C.
Tehtävät 3,3 S.86,90-92
S.86
T.13
Selitä, miten seuraavat alkuaineatomit saavat jalokaasun elektronirakenteen ja millainen ioni tällöin muodostuu?
a) Natrium
- Nariumatomin elektronirakenne on . Se saa jalokaasu elektronirakenteen luovuttamalla uloimman elektroninsa
. Se saa jalokaasu elektronirakenteen luovuttamalla uloimman elektroninsa
( ). Natriumatomista muodostuu tällöin positiivinen Na+-ioni, jonka elektronirakenne
). Natriumatomista muodostuu tällöin positiivinen Na+-ioni, jonka elektronirakenne  vastaa neonin elektronirakennetta.
vastaa neonin elektronirakennetta.
b) Kalsium
- Kalsiumin elektronirakenne on . Se saa jalokaasu elektronirakenteen luovuttamalla uloimmat elektroninsa
. Se saa jalokaasu elektronirakenteen luovuttamalla uloimmat elektroninsa
( ). Kalsiumista muodostuu tällöin positiivinen Ca2+-ioni, jonka elektronirakenne
). Kalsiumista muodostuu tällöin positiivinen Ca2+-ioni, jonka elektronirakenne  vastaa argonin elektronirakennetta.
vastaa argonin elektronirakennetta.
c) Kloori
- Kloorin elektronirakenne on . mistä nähdään, että ulkoelektronirakenne on
. mistä nähdään, että ulkoelektronirakenne on  . Jalokaasun elektronirakenne syntyy, kun klooriatomi täydentää 3p-alakuoren ottamalla vastaan yhden elektronin. Klooriatomista muodostuu tällöin negatiivinen kloridi-ioni (Cl-), jonka elektronirakenne on
. Jalokaasun elektronirakenne syntyy, kun klooriatomi täydentää 3p-alakuoren ottamalla vastaan yhden elektronin. Klooriatomista muodostuu tällöin negatiivinen kloridi-ioni (Cl-), jonka elektronirakenne on  . Tämä vastaa argonin elektrnirakennetta.
. Tämä vastaa argonin elektrnirakennetta.
d) Rikki
- Rikkiatomin elektronirakenne on , mistä nähdään että ulkoelektronirakenne on
, mistä nähdään että ulkoelektronirakenne on  . Jalokaasun elektronirakenne syntyy, kun 3p-alakuorelle tulee kaksi elektronia lisää. Rikkiatomista muodostuu tällöin negatiivinen sulfdi-ioni
. Jalokaasun elektronirakenne syntyy, kun 3p-alakuorelle tulee kaksi elektronia lisää. Rikkiatomista muodostuu tällöin negatiivinen sulfdi-ioni
( ), jonka elektronirakenne on
), jonka elektronirakenne on  . Tämäkin elektronirakenne vastaa argonin elektroninrakennetta.
. Tämäkin elektronirakenne vastaa argonin elektroninrakennetta.
T.14
Millä seuraavista hiukkasista on enemmän elektroneja kuin protoneja? Perustele valintasi.



- , koska sillä on 17 protonia, mutta 18 elektronia.
, koska sillä on 17 protonia, mutta 18 elektronia.
T.15
Minkä jalokaasun elektronirakenne on seuraavilla ioneilla? Kirjoita ionin ulkoelektronirakenne taulukkokirjan avulla.
a) Cs+
- Ksenon elektronirakenne (54 elektronia). Ulkoelektronirakenne:
b) F-
- Neonin elektronirakenne (10 elektronia). Ulkoelektronirakenne:
c) Ca2+
- Argonin elektronirakenne (18 elektronia). Ulkoelektronirakenne:
T.17
Mitkä seuraavista ioneista ovat syntyneet hapettumisen, mitkä pelkistymisen kautta? Perustele vastauksesi.






- Kaikki positiiviset ionit eli kationit ovat muodostuneet hapettumisen kautta, koska tällöin atomi (yleensä metalliatomi) on luovuttanut elektronin tai elektroneja. Kattioneja ovat ,
,  ,
,  .
.
- Kaikki negatiiviset ionit eli anionit ovat muodostuneet pelkistmisen kauta, koska tällöin atomi (yleensä epämetalli) on vastaanottanut elektronin tai elektroneja. Anioneja ovat ,
,  ,
,  .
.
T.18
Yhdistä toisiinsa alkuaineen nimi ja elektronirakenne. Valitse kullekin aineelle oikea liekin väri.
A 4 Punainen
B 3 violetti
C 2 Keltainen
D 1 Oranssi
S.90
T.20
Yhdistä alkuaine oikeaan ryhmään.
1 B
2 C
3 F
4 D
5 E
6 A
7 G
T.21
Tutki jaksollista järjestelmää ja päättele, kuinka monta ulkoelektronia on
a) Litiumilla
- Yksi
b) Hiilellä
- Neljä
c) Neonilla
- Kahdeksan
T.22
Selitä, mitä yhteistä on
a) 2. ryhmän alkuaineiden elektronirakenteissa.
- Kaikilla toisen ryhmän alkuaineiden atomeilal on kaksi ulkoelektronia.
b) 3. jakson alkuaineiden elektronirankenteissa.
- Kaikilla kolmannen jakson alkuaineiden atomeilla uloimmat elektronit ovat kolmannella elektronikuorella (M- kuorella).
T.23
Selvitä, millä seuraavista alkuaineatomeista on samoja kemiallisia ominaisuuksia. Perustele vastauksesi.
Kalsium, Sr, F, Mg, Cl, Bromi, Pii, Happi
Mg, Ca, Sr ovat toisen ryhmän alkuaineita, joiden atomeilla on kaksi ulkoelektronia. Ne kaikki ovat myös metalleja. Kemiallisissa reaktiossa näiden alkuaineiden atomit pyrkivät hapettumaan luovuttamalla ulkoelektroninsa. Atomeissa muodostuu kationeja joiden varaus on 2+.
F, Cl, Br ovat ryhmän 17 alkuaineita eli halogeeneja. Ne ovat kaikki epämetalleja, joiden atomien uloimmalla kuorella on 7 elektronia. Atomit pelkistyvät ottamalla vastaan yhden elektronin, jolloin muodostuu anioneja, joiden varaus on 1-.
T.13
Selitä, miten seuraavat alkuaineatomit saavat jalokaasun elektronirakenteen ja millainen ioni tällöin muodostuu?
a) Natrium
- Nariumatomin elektronirakenne on
(
b) Kalsium
- Kalsiumin elektronirakenne on
(
c) Kloori
- Kloorin elektronirakenne on
d) Rikki
- Rikkiatomin elektronirakenne on
(
T.14
Millä seuraavista hiukkasista on enemmän elektroneja kuin protoneja? Perustele valintasi.
-
T.15
Minkä jalokaasun elektronirakenne on seuraavilla ioneilla? Kirjoita ionin ulkoelektronirakenne taulukkokirjan avulla.
a) Cs+
- Ksenon elektronirakenne (54 elektronia). Ulkoelektronirakenne:
b) F-
- Neonin elektronirakenne (10 elektronia). Ulkoelektronirakenne:
c) Ca2+
- Argonin elektronirakenne (18 elektronia). Ulkoelektronirakenne:
T.17
Mitkä seuraavista ioneista ovat syntyneet hapettumisen, mitkä pelkistymisen kautta? Perustele vastauksesi.
- Kaikki positiiviset ionit eli kationit ovat muodostuneet hapettumisen kautta, koska tällöin atomi (yleensä metalliatomi) on luovuttanut elektronin tai elektroneja. Kattioneja ovat
- Kaikki negatiiviset ionit eli anionit ovat muodostuneet pelkistmisen kauta, koska tällöin atomi (yleensä epämetalli) on vastaanottanut elektronin tai elektroneja. Anioneja ovat
T.18
Yhdistä toisiinsa alkuaineen nimi ja elektronirakenne. Valitse kullekin aineelle oikea liekin väri.
A 4 Punainen
B 3 violetti
C 2 Keltainen
D 1 Oranssi
S.90
T.20
Yhdistä alkuaine oikeaan ryhmään.
1 B
2 C
3 F
4 D
5 E
6 A
7 G
T.21
Tutki jaksollista järjestelmää ja päättele, kuinka monta ulkoelektronia on
a) Litiumilla
- Yksi
b) Hiilellä
- Neljä
c) Neonilla
- Kahdeksan
T.22
Selitä, mitä yhteistä on
a) 2. ryhmän alkuaineiden elektronirakenteissa.
- Kaikilla toisen ryhmän alkuaineiden atomeilal on kaksi ulkoelektronia.
b) 3. jakson alkuaineiden elektronirankenteissa.
- Kaikilla kolmannen jakson alkuaineiden atomeilla uloimmat elektronit ovat kolmannella elektronikuorella (M- kuorella).
T.23
Selvitä, millä seuraavista alkuaineatomeista on samoja kemiallisia ominaisuuksia. Perustele vastauksesi.
Kalsium, Sr, F, Mg, Cl, Bromi, Pii, Happi
Mg, Ca, Sr ovat toisen ryhmän alkuaineita, joiden atomeilla on kaksi ulkoelektronia. Ne kaikki ovat myös metalleja. Kemiallisissa reaktiossa näiden alkuaineiden atomit pyrkivät hapettumaan luovuttamalla ulkoelektroninsa. Atomeissa muodostuu kationeja joiden varaus on 2+.
F, Cl, Br ovat ryhmän 17 alkuaineita eli halogeeneja. Ne ovat kaikki epämetalleja, joiden atomien uloimmalla kuorella on 7 elektronia. Atomit pelkistyvät ottamalla vastaan yhden elektronin, jolloin muodostuu anioneja, joiden varaus on 1-.
Tehtävät 3,1 S.74+80
S.74
T.2
Hyödynnä taulukkokirjaa ja täydennä puuttuvat tiedot. Laske, kuinka moninkertainen protonin ja neutronin massa on elektronin massaan verrattuna.
T.4
Yhdistä isotooppimerkintä oikeaan neutronien lukumäärään.
1 D
2 C
3 A
4 E
5 B
T.5
Tunnista alkuaine isotooppimerkinnän perusteella. Mikä on alkuaineen kemiallinen merkki ja nimi?
a) Yb ytterbium
Yb ytterbium
b) P fosfori
P fosfori
c) Te telluuri
Te telluuri
d) K Kalium
K Kalium
T.6
S.80
T.9
Valitse taulukosta rivi, joka kuvaa klooriatomin järjestyslukua ja elektronirakennetta.
T.10
Päättele taulukkokirjan avulla, minkä alkuaineatomin elektronirakennetta seuraava merkintä esittää.
a) natriumin
natriumin
b) piin
piin
c) kuparin
kuparin
T.11
Kirjoita taulukkokirjan avulla elektronirakenteet seuraaville alkuaineille. Päättele elektronirakenteen perusteella, kuinka monta ulkoelektronia kullakin alkuaineella on.
a) Beryllium
- , kaksi ulkoelektronia (
, kaksi ulkoelektronia ( ).
).
b) Rikki
- , kuusi ulkoelektronia (
, kuusi ulkoelektronia ( ).
).
c) Argon
- , kahdeksan ulkoelektronia (
, kahdeksan ulkoelektronia ( ).
).
T.12
Ratkaise taulukkokirjan avulla.
a) Mikä on sen alkuaineen kemiallinen merkki, jolla ensimmäisenä täyttyy alakuori 3d?
- Sc
b) Kuinka monta elektronia enintään voi olla alakuorella 3d?
- 10
c) Mikä on sen alkuaineen järjestysluku, jolla on kaksi elektronia alakuorella 4s ja kuusi elektronia alakuorella 3d?
- 26
d) Mikä on sen alkuaineen nimi, jolla ensimmäisenä täyttyy f-alakuori?
- Cerium
T.2
Hyödynnä taulukkokirjaa ja täydennä puuttuvat tiedot. Laske, kuinka moninkertainen protonin ja neutronin massa on elektronin massaan verrattuna.
| Alkeishiukkanen | Lepomassa (kg) | Varaus (C) |
| protoni (p+) | ||
| neutroni (n0) | ||
| elektroni (e-) |
T.4
Yhdistä isotooppimerkintä oikeaan neutronien lukumäärään.
1 D
2 C
3 A
4 E
5 B
T.5
Tunnista alkuaine isotooppimerkinnän perusteella. Mikä on alkuaineen kemiallinen merkki ja nimi?
a)
b)
c)
d)
T.6
| Isotooppi- merkintä |
|||||
| Järjestysluku | 6 | 16 | 92 | 8 | 11 |
| Massaluku | 14 | 32 | 238 | 16 | 23 |
| Neutronien lukumäärä |
8 | 16 | 146 | 8 | 12 |
| Elektronien lukumäärä |
6 | 16 | 92 | 10 | 10 |
S.80
T.9
Valitse taulukosta rivi, joka kuvaa klooriatomin järjestyslukua ja elektronirakennetta.
| Rivi | Järjestysluku (Z) | Elektroni- rakenne |
| A | 17 | 2,8,7 |
| B | 17 | 2,8,8 |
| C | 18 | 2,8,7 |
| D | 18 | 2,8,8 |
T.10
Päättele taulukkokirjan avulla, minkä alkuaineatomin elektronirakennetta seuraava merkintä esittää.
a)
b)
c)
T.11
Kirjoita taulukkokirjan avulla elektronirakenteet seuraaville alkuaineille. Päättele elektronirakenteen perusteella, kuinka monta ulkoelektronia kullakin alkuaineella on.
a) Beryllium
-
b) Rikki
-
c) Argon
-
T.12
Ratkaise taulukkokirjan avulla.
a) Mikä on sen alkuaineen kemiallinen merkki, jolla ensimmäisenä täyttyy alakuori 3d?
- Sc
b) Kuinka monta elektronia enintään voi olla alakuorella 3d?
- 10
c) Mikä on sen alkuaineen järjestysluku, jolla on kaksi elektronia alakuorella 4s ja kuusi elektronia alakuorella 3d?
- 26
d) Mikä on sen alkuaineen nimi, jolla ensimmäisenä täyttyy f-alakuori?
- Cerium
Tehtävät 2,4 S.63
T.23
Seoksessa on 536 grammaa natriumkarbonaattia ja 1418 grammaa natriumkloridia. Laske kummankin koponentin osuus massaprosentteina.
%3D%5Cfrac%7B536%5C%20g%7D%7B536%5C%20g%2B1418%5C%20g%7D%3D0%2C2743...%5Capprox0%2C274%3D27%2C4%5C%25)
%3D%5Cfrac%7B1418%5C%20g%7D%7B536%5C%20g%2B1418%5C%20g%7D%3D0%2C7256...%5Capprox0%2C726%3D72%2C6%5C%25)

T.25
Valtamerien suolapitoisuus on keskimäärin 3,5 massaprosenttia. Laske, kuinka monta kilogrammaa suolaa on kuutiometrissä merivettä. Voit olettaa, että meriveden tiheys on 1,0kg/l.
%3D3%2C5%5C%25)



T.26
Kemian tunnilla opiskelijat kuumensivat haihdutusmaljassa kiinteää kidevedellistä bariumkloridia( ), jolloin kidevesi poistui aineesta. Laske seuraavien punnistustulosten avulla kidevedellisen briumkloridin kideveden osuus massaprosentteina.
), jolloin kidevesi poistui aineesta. Laske seuraavien punnistustulosten avulla kidevedellisen briumkloridin kideveden osuus massaprosentteina.
m(Haihdutusmalja)=30,286g
m(Haihdutusmalja + )= 31,673g
)= 31,673g
m(Haihdustmalja+ )= 31,461g
)= 31,461g
%3D%5Cfrac%7B31%2C673-30%2C286-%5Cleft(31%2C461-30%2C286%5Cright)%7D%7B31%2C673-30%2C286%7D%3D0%2C1528...%5Capprox0%2C153%3D15%2C3%5C%25)
T.28
Biologian harjoitustöissä tarvitaan fysiologista suolaliuosta, joka on 0,90-massaprosenttinen natriumkloridin vesiliuos. Kuinka paljon mittaat eri aineita, kun tarvitset 5,0 litraa tätä liuosta? Voit olettaa, että yhden liuoslitran massa on 1000g.
%3D500g%5Ccdot0%2C9%5C%25%3D45g)
%3D500-45%3D455g)
T.29
10,0 litraan vettä lisättiin 3,0 litraa mehutiivistettä. Mikä on näi saadun liuoksen mehutiivistepitoisuus tilavuusprosentteina?
%3D%5Cfrac%7B3l%7D%7B10l%2B3l%7D%3D0.2307...%5Capprox0%2C23%3D23%5C%25)
T.30
2,0 litraa 20-tilavuusprosenttista etanoliliuosta lisätään 0,80 litraa vettä. Mikä on näin saadun liuoksen etanolipitoisuus tilavuusprosenttina?



%3D%5Cfrac%7B0%2C4l%7D%7B2%2C8l%7D%3D0%2C142...%5Capprox0%2C14%3D14%5C%25)
Seoksessa on 536 grammaa natriumkarbonaattia ja 1418 grammaa natriumkloridia. Laske kummankin koponentin osuus massaprosentteina.
T.25
Valtamerien suolapitoisuus on keskimäärin 3,5 massaprosenttia. Laske, kuinka monta kilogrammaa suolaa on kuutiometrissä merivettä. Voit olettaa, että meriveden tiheys on 1,0kg/l.
T.26
Kemian tunnilla opiskelijat kuumensivat haihdutusmaljassa kiinteää kidevedellistä bariumkloridia(
m(Haihdutusmalja)=30,286g
m(Haihdutusmalja +
m(Haihdustmalja+
T.28
Biologian harjoitustöissä tarvitaan fysiologista suolaliuosta, joka on 0,90-massaprosenttinen natriumkloridin vesiliuos. Kuinka paljon mittaat eri aineita, kun tarvitset 5,0 litraa tätä liuosta? Voit olettaa, että yhden liuoslitran massa on 1000g.
T.29
10,0 litraan vettä lisättiin 3,0 litraa mehutiivistettä. Mikä on näi saadun liuoksen mehutiivistepitoisuus tilavuusprosentteina?
T.30
2,0 litraa 20-tilavuusprosenttista etanoliliuosta lisätään 0,80 litraa vettä. Mikä on näin saadun liuoksen etanolipitoisuus tilavuusprosenttina?
Tehtävät 2.3 S.56
T.19
Meriveden suolapitoisuus selvitettiin seuraavasti. Täysipipetillä pipetoitiin 20,00ml merivettä haihdutusmaljaan, jonka massa oli 20,15g. Näytteestä haidutettiin vesi pois. Jäähtynyt haihdutusmalja punnittiin, ja tulokseksi saatiin 20,45g. Laske, kuinka monta grammaa suolaa litra tutkittua merivettä sisältää.





T.20
Nesteseos sisältää seuraavia orgaanisia aineita: propanoni, etaanihappo ja 1-propanoli. Hyödynnä taulukkokirjaa ja perustele, missä järjestyksessä seoksen komponentit tislautuvat.
Propanoni: 56,3°C
Etaanihappo: 118,1°C
1-Propanoli: 97°C
T.22
Karamellinäytteestä liuotettiin väriaineet ja seos anaysoitiin ohutlevykromatografialla. Jotta eri väriaineet voitiin tunnistaa, ohutlevylle pipetoitiin myös tunnettuja väriaineita. Selvitä, saatujen tulosten perusteella , mitä väriaineita tutkittujen karamellien värjäämiseen oli käytetty ja etsi kunkin väriaineen E-koodi.
- Kuvan perusteella näyte sisältää patentisinistä E131 ja briljanttimusta E 151.
Meriveden suolapitoisuus selvitettiin seuraavasti. Täysipipetillä pipetoitiin 20,00ml merivettä haihdutusmaljaan, jonka massa oli 20,15g. Näytteestä haidutettiin vesi pois. Jäähtynyt haihdutusmalja punnittiin, ja tulokseksi saatiin 20,45g. Laske, kuinka monta grammaa suolaa litra tutkittua merivettä sisältää.
T.20
Nesteseos sisältää seuraavia orgaanisia aineita: propanoni, etaanihappo ja 1-propanoli. Hyödynnä taulukkokirjaa ja perustele, missä järjestyksessä seoksen komponentit tislautuvat.
Propanoni: 56,3°C
Etaanihappo: 118,1°C
1-Propanoli: 97°C
T.22
Karamellinäytteestä liuotettiin väriaineet ja seos anaysoitiin ohutlevykromatografialla. Jotta eri väriaineet voitiin tunnistaa, ohutlevylle pipetoitiin myös tunnettuja väriaineita. Selvitä, saatujen tulosten perusteella , mitä väriaineita tutkittujen karamellien värjäämiseen oli käytetty ja etsi kunkin väriaineen E-koodi.
- Kuvan perusteella näyte sisältää patentisinistä E131 ja briljanttimusta E 151.
Tehtävät 2.2 S.42-46
T.8
Etsi taulukkokirjasta seuraavien yhdisteiden kemiallinen kaava:
Mönjä: Pb3O4
Potaska: K2CO3
Katkerosuola: MgSO4
Kipsi: CaSO4 · 2 H2O
Maantiesuola: CaCl2
Ruokasooda: NaHCO3
T.9
Sijoita seuraavat aineet oheiseen kaavioon.

T.14
Jäätelö on usean ainee homogeeninen seos. Jäätelöpakkauksen tuoteselosteessa on merkintä: ''E322, E470a, E401, E412''. Mihin samaan lisäaineryhmään mainitut lisäaineet kuuluvat.
- E322: Hapettumisenesto- ja happamuudensäätöaineet
- E401, E412, E470a: Sakeuttamis-, stabilointi- ja emulgointiaineet
Etsi taulukkokirjasta seuraavien yhdisteiden kemiallinen kaava:
Mönjä: Pb3O4
Potaska: K2CO3
Katkerosuola: MgSO4
Kipsi: CaSO4 · 2 H2O
Maantiesuola: CaCl2
Ruokasooda: NaHCO3
T.9
Sijoita seuraavat aineet oheiseen kaavioon.

T.14
Jäätelö on usean ainee homogeeninen seos. Jäätelöpakkauksen tuoteselosteessa on merkintä: ''E322, E470a, E401, E412''. Mihin samaan lisäaineryhmään mainitut lisäaineet kuuluvat.
- E322: Hapettumisenesto- ja happamuudensäätöaineet
- E401, E412, E470a: Sakeuttamis-, stabilointi- ja emulgointiaineet
Tehtävät 2.1 S.40-41
T.1
Täydennä olomuotojen muutokset nuolien kohdalle
Neste - Jähmenttyminen > Kiinteä
< Sulaminen -
Kiinteä - Sublimoituminen > Kaasu
< Härmistyminen -
Kaasu - Tiivistyminen > Neste
< Höyrystyminen -
T.2
Pohdi, mikä olomuodon muutos on kyseessä, kun
a) auton ikkunoihin muodostuu jäätä talvella.
- Härmistyminen
b) pyykit kuivuvat kesällä auringopaisteessa.
- Höyrystyminen
c) auton pakoputkesta tulee ulos vettä.
- Tiivistyminen
d) sulatettua uuden vuoden tinaa kaadetaan veteen.
- Jähmentyminen
T.3
Ammoniumkloridia (vas.) ja johdia (oik.) on lämmitetty. Miten selität havainnot?
- Molemmat aineet ovat lämminttäessä sublimoituneet eli suoraan kiinteästä kaasuksi. Kaasua on härmistynyt putkien viileään yläosaan.
T.4
Elinympäristössämme aineita esiintyy kolmessa eri olomuodossa. Yhdistä laatikosta tuote tai tapahtuma ja siihen liittyvä aine. Kirjoita aineen kemiallinen kaava ja olomuoto viivalle.
A Ruokasuola (Natriumkloridi NaCl s)
B Sokerin käymisreaktio (Etanoli CH3CH2OH l)
C Poranterä (Timantti C s)
D Pronssikoru (Kupari, Cu s)
E Soluneste (Vesi H2O l)
F Puun palaminen (Hiilidioksidi CO2 g)
G Soluhengitys (Happi O2 g)
H Maakaasu (Metaani CH4 g)
Täydennä olomuotojen muutokset nuolien kohdalle
Neste - Jähmenttyminen > Kiinteä
< Sulaminen -
Kiinteä - Sublimoituminen > Kaasu
< Härmistyminen -
Kaasu - Tiivistyminen > Neste
< Höyrystyminen -
T.2
Pohdi, mikä olomuodon muutos on kyseessä, kun
a) auton ikkunoihin muodostuu jäätä talvella.
- Härmistyminen
b) pyykit kuivuvat kesällä auringopaisteessa.
- Höyrystyminen
c) auton pakoputkesta tulee ulos vettä.
- Tiivistyminen
d) sulatettua uuden vuoden tinaa kaadetaan veteen.
- Jähmentyminen
T.3
Ammoniumkloridia (vas.) ja johdia (oik.) on lämmitetty. Miten selität havainnot?
- Molemmat aineet ovat lämminttäessä sublimoituneet eli suoraan kiinteästä kaasuksi. Kaasua on härmistynyt putkien viileään yläosaan.
T.4
Elinympäristössämme aineita esiintyy kolmessa eri olomuodossa. Yhdistä laatikosta tuote tai tapahtuma ja siihen liittyvä aine. Kirjoita aineen kemiallinen kaava ja olomuoto viivalle.
A Ruokasuola (Natriumkloridi NaCl s)
B Sokerin käymisreaktio (Etanoli CH3CH2OH l)
C Poranterä (Timantti C s)
D Pronssikoru (Kupari, Cu s)
E Soluneste (Vesi H2O l)
F Puun palaminen (Hiilidioksidi CO2 g)
G Soluhengitys (Happi O2 g)
H Maakaasu (Metaani CH4 g)
Tehtävät 1.3 S.32-33
Käsitetesti
Liuotin - Aine, jota liuksessa on eniten.
AD-arvo - Arvo, joka kertoo kuinka paljon (mg/kg/vrk) lisäaineita voi päivittäin käyttää, jos käyttö jatkuu koko elämän ajan.
Lisäaine - Aine, joka ei ole varsinainen elintarvike, vaan se lisätään esimerkiksi tuotteen säilyvyyden parantamiseksi.
Tensidi - Pesuaineissa käytetty pinta-aktiivinen aine, joka pienentää pintajännitystä.
Synteettinen kemikaali - Aine, jota ei esiinny luonnossa, vaan kemianteollisuus valmistaa sitä haluttua käyttötarkoitusta varten.
Biomolekyyli - Soluissa esiintyvä, usein suuri, orgaaninen molekyyli.
Ylioppilastehtäviä
1. Nimeä kuhunkin kuvaukseen sopia yhdiste tai alkuaine
a) Se saa monet hedelmät ja marhat maistumaan makealta.
- Fruktoosi
b) Sen runsas syöminen on yhteydessä kohonneeseen verenpaineeseen. Sen saantisuositus aikuiselle on enitääbn 5 grammaa päivässä. Markkarassa tätä yhdistettä voi olla jopa 1,8%.
- Natriumkloridi
c) Sitä käytetään makeutusaineen esimerkiksi purukumeissa. Sen käyttö ehkäisee hampaiden reikiintymistä.
- Ksylitoli
d) SItä käytetään hapettumisenestoaineena elintarvikkeissa. Se on myös ihmiselle elintärkeä vitamiini.
- Askorbiinihappo (C-vitamiini)
e) Yhdistettä on maidossa noin 90%.
- Vesi
f) SItä käytetään suojakaasuna, kun lihavalmisteet halutaan säilyttää hapettomissa olosuhteissa.
- Typpi ja hiilidioksidi.
2. Allaolevassa taulukossa on esitetty kuusi yhdistettä ja kohteita, joihin niitä tavallisesti käytetään. Valitse kullekin yhdisteelle ominainen käyttökohde.
Kalsiumkloridi - maantiesuola, ammoniumnitraatti - lannoite, titaanidioksidi - valkoinen pigmentti, litiumkarbonaatti - lääkeaine, natriumnitriitti - säilöntäaine, alumiinioksidi - hiota-aine
3.Monista tavallisista kemiallisiste yhdisteistä käytetään usein niiden yleisnimiä. Selvitä kaavan avulla tai muulla tavoin, mitä seuraavat aineet ovat kemialliselta koostumukseltaan.
a) Etikka
- Vettä ja etaani- eli etikkahappoa
ja etaani- eli etikkahappoa  .
.
b) Saippua
- Rasvahappojen natrium- tai kaliumsuolaa
c) Taloussokeri
- Sakkaroosia
d) Ruokaöljy
- Yleensä tyydyttymättömien rasvahappojen ja glyserolin muodostamia estereitä eli triglyseridejä.
e) Bensiini
- Erilaisten nestemäisten hiilivetyjen seos; pääasiassa oktaanin ja iso-oktaanin seos.
f) Tärkkelys
- Glukoosiyksiköistä koostunut pitkäketjuinen hiilihydraatto eli polysakkaridi.
Liuotin - Aine, jota liuksessa on eniten.
AD-arvo - Arvo, joka kertoo kuinka paljon (mg/kg/vrk) lisäaineita voi päivittäin käyttää, jos käyttö jatkuu koko elämän ajan.
Lisäaine - Aine, joka ei ole varsinainen elintarvike, vaan se lisätään esimerkiksi tuotteen säilyvyyden parantamiseksi.
Tensidi - Pesuaineissa käytetty pinta-aktiivinen aine, joka pienentää pintajännitystä.
Synteettinen kemikaali - Aine, jota ei esiinny luonnossa, vaan kemianteollisuus valmistaa sitä haluttua käyttötarkoitusta varten.
Biomolekyyli - Soluissa esiintyvä, usein suuri, orgaaninen molekyyli.
Ylioppilastehtäviä
1. Nimeä kuhunkin kuvaukseen sopia yhdiste tai alkuaine
a) Se saa monet hedelmät ja marhat maistumaan makealta.
- Fruktoosi
b) Sen runsas syöminen on yhteydessä kohonneeseen verenpaineeseen. Sen saantisuositus aikuiselle on enitääbn 5 grammaa päivässä. Markkarassa tätä yhdistettä voi olla jopa 1,8%.
- Natriumkloridi
c) Sitä käytetään makeutusaineen esimerkiksi purukumeissa. Sen käyttö ehkäisee hampaiden reikiintymistä.
- Ksylitoli
d) SItä käytetään hapettumisenestoaineena elintarvikkeissa. Se on myös ihmiselle elintärkeä vitamiini.
- Askorbiinihappo (C-vitamiini)
e) Yhdistettä on maidossa noin 90%.
- Vesi
f) SItä käytetään suojakaasuna, kun lihavalmisteet halutaan säilyttää hapettomissa olosuhteissa.
- Typpi ja hiilidioksidi.
2. Allaolevassa taulukossa on esitetty kuusi yhdistettä ja kohteita, joihin niitä tavallisesti käytetään. Valitse kullekin yhdisteelle ominainen käyttökohde.
Kalsiumkloridi - maantiesuola, ammoniumnitraatti - lannoite, titaanidioksidi - valkoinen pigmentti, litiumkarbonaatti - lääkeaine, natriumnitriitti - säilöntäaine, alumiinioksidi - hiota-aine
3.Monista tavallisista kemiallisiste yhdisteistä käytetään usein niiden yleisnimiä. Selvitä kaavan avulla tai muulla tavoin, mitä seuraavat aineet ovat kemialliselta koostumukseltaan.
a) Etikka
- Vettä
b) Saippua
- Rasvahappojen natrium- tai kaliumsuolaa
c) Taloussokeri
- Sakkaroosia
d) Ruokaöljy
- Yleensä tyydyttymättömien rasvahappojen ja glyserolin muodostamia estereitä eli triglyseridejä.
e) Bensiini
- Erilaisten nestemäisten hiilivetyjen seos; pääasiassa oktaanin ja iso-oktaanin seos.
f) Tärkkelys
- Glukoosiyksiköistä koostunut pitkäketjuinen hiilihydraatto eli polysakkaridi.
Tehtävät 1.2 S.26
T.8
T.9
A Fluori: 3
B Rauta: 4
C Jodi: 5
D Kalsium: 1
E Fosfori: 2
T.10
A Fruktoosi: 3
B Glukoosi: 5
C Laktoosi: 6
D Sakkaroosi: 7
E Tärkkelys: 4
F Glykogeeni: 2
G Selluloosa: 1
T.12
1. Vety
2. Rikki
3. fosfori
4. Fluori
5. Typpi
6. Kalsium
7. Seleeni
8. Jodi
9. Rauta
10. Natrium
11. Happi
11. Hiili
12. Kloori

T.9
A Fluori: 3
B Rauta: 4
C Jodi: 5
D Kalsium: 1
E Fosfori: 2
T.10
A Fruktoosi: 3
B Glukoosi: 5
C Laktoosi: 6
D Sakkaroosi: 7
E Tärkkelys: 4
F Glykogeeni: 2
G Selluloosa: 1
T.12
1. Vety
2. Rikki
3. fosfori
4. Fluori
5. Typpi
6. Kalsium
7. Seleeni
8. Jodi
9. Rauta
10. Natrium
11. Happi
11. Hiili
12. Kloori
Tehtävät 1.1 S.22
1. Seuraa esimerkiksi yhden vuorokauden ajan, millaisten kemikaalien kanssa olet tekemisissä ja missä yhteyksissä. Onkojoukossa kemikaaleja, joihin on liitetty jokin varoitusmerkki?
- Haamastahna, Shampo, käsienpesuaine.
- Ei ollut mitään varoitus merkejä.
2. Yhdistä aine sen käyttökohteeseen. Etsi kullekin aineelle sen kemiallinen kaava.
a) Natriumkarbonaatti --- Na2CO3
b) Sammutettu kalkki --- Ca(OH)2
c) Propaani --- C3H8
d) Asetoni --- CH3COCH3
e) Aspartaami --- C14H18N2O5
f) Etikkahappo --- CH3COOH
g) Vetyperoksidi --- H2O2
h) Natriumhydroksidi --- NaOH
i) Titaanidioksidi --- TiO₂
3.Tutki, mitä varoitusmerkkejä töytyy kotisi pesuja uhdistusaineista.
- Haitallinen, ärsyttävä, herkistävä, vaarallinen otsonikerrokselle.
4. Yhdistä ravintoaine sen pääasialliseen lähteeseen
A Hiilihydraatit: 3,7,10
B Rasvat: 1,8,9,11
C Proteiinit: 1,4,8
D) Vitamiini: 2,5,6
5. Elintarvikkeiden lisäaineet voidaan ryhmitellä niiden käyttötarkoituksen mukaan. Yhdistä lisäaine oikeaan ryhmään.
A Makeutusaineet 1,7
B Väriaineet 5,8,
C Säilöaineet 6,3,11
D Hapettumisenestoaineet 4,
E Happamuudensäätöaineet 10
F emulgointiaineet 9,2
6. Selvitä E-koodien avulla, mitä lisäaineita esimerkiksi makeiset tai virvoitusuojamat .
7. Tutustu eri ruokien koostumuksiin osoitteessa fineli.fi. Suunnittele ateria ja listaa, mitä ravintoaineita ja kuinka palkon ruokalailija saa yhdestä annoksesta.
-Lihapulla, peruna, kurkku
- Lihapulla: Rasva 57%/231 kcal
Proteiini 226%/231 kcal
Hiilihydraatti imeytyvä 16%/231 kcal
-Peruna: Rasva 2%/78 kcal
Proteiini 9%/78 kcal
Hiilihydraatti imeytyvä 84%/78 kcal
Orgaaniset hapot 2%/78 kcal
Kuitu,kokonais 2%/78 kcal
-Kurkku: Rasva 8%/11 kcal
Proteiini 23%/11 kcal
Hiilihydraatti imeytyvä 50%/11 kcal
Orgaaniset hapot 7%/ 11 kcal
Kuitu, kokonais- 12%/11 kcal
- Haamastahna, Shampo, käsienpesuaine.
- Ei ollut mitään varoitus merkejä.
2. Yhdistä aine sen käyttökohteeseen. Etsi kullekin aineelle sen kemiallinen kaava.
a) Natriumkarbonaatti --- Na2CO3
b) Sammutettu kalkki --- Ca(OH)2
c) Propaani --- C3H8
d) Asetoni --- CH3COCH3
e) Aspartaami --- C14H18N2O5
f) Etikkahappo --- CH3COOH
g) Vetyperoksidi --- H2O2
h) Natriumhydroksidi --- NaOH
i) Titaanidioksidi --- TiO₂
3.Tutki, mitä varoitusmerkkejä töytyy kotisi pesuja uhdistusaineista.
- Haitallinen, ärsyttävä, herkistävä, vaarallinen otsonikerrokselle.
4. Yhdistä ravintoaine sen pääasialliseen lähteeseen
A Hiilihydraatit: 3,7,10
B Rasvat: 1,8,9,11
C Proteiinit: 1,4,8
D) Vitamiini: 2,5,6
5. Elintarvikkeiden lisäaineet voidaan ryhmitellä niiden käyttötarkoituksen mukaan. Yhdistä lisäaine oikeaan ryhmään.
A Makeutusaineet 1,7
B Väriaineet 5,8,
C Säilöaineet 6,3,11
D Hapettumisenestoaineet 4,
E Happamuudensäätöaineet 10
F emulgointiaineet 9,2
6. Selvitä E-koodien avulla, mitä lisäaineita esimerkiksi makeiset tai virvoitusuojamat .
| Makeutusaine | |
| Aspartaami | E 951 |
| Asesulfaami K | E 950 |
| Sukraloosi | E 955 |
7. Tutustu eri ruokien koostumuksiin osoitteessa fineli.fi. Suunnittele ateria ja listaa, mitä ravintoaineita ja kuinka palkon ruokalailija saa yhdestä annoksesta.
-Lihapulla, peruna, kurkku
- Lihapulla: Rasva 57%/231 kcal
Proteiini 226%/231 kcal
Hiilihydraatti imeytyvä 16%/231 kcal
-Peruna: Rasva 2%/78 kcal
Proteiini 9%/78 kcal
Hiilihydraatti imeytyvä 84%/78 kcal
Orgaaniset hapot 2%/78 kcal
Kuitu,kokonais 2%/78 kcal
-Kurkku: Rasva 8%/11 kcal
Proteiini 23%/11 kcal
Hiilihydraatti imeytyvä 50%/11 kcal
Orgaaniset hapot 7%/ 11 kcal
Kuitu, kokonais- 12%/11 kcal