Tehtävät 4,3 S.122
T.29
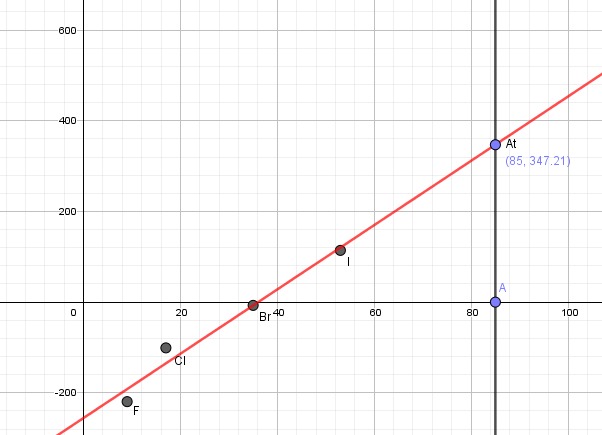
Hae taulukkokirjasta fluorin, kloorin, bromin ja jodin sulamispisteet. Piirrä kuvaaja, jossa on esitetty halogeenin sulamispiste sen järjestys luvun funktiona.
a) Määritä kuvaajalta, mikä olisi astatiinin sulamispiste.
- Fluori: -219,6°C
- Kloori: -101°C
- Bromi: -7,2°C
- Jodi: 114°C
b)Selitä, miksi halogeenin sulamispiste kasvaa ryhmäsäässä alaspäin mentäessä.
- Sulamispiste kasvaa, koska molekyylien koko kasvaa. Suurempien poolittomien halogeenimolekyylien välille muodostuu enemmän dispersiovoimia, sillä hetkellisten dipolien määrä on suurempi moolekyyleissä, jossa on enemmän elektroneja.
T.30
Otsonin kiehumispiste on noin -112°C ja happikaasun alhaisempi, noin -183°C. Miksi kiehumispisteet eroavat toisistaan.
Molemmat hapen allotrooppiset muodot koostuvat poolittomista molekyyleistä. Otsonimolekyylissä on kolme happiatomia kun taas happiatomissa vain kaksi. Otsonimolekyyli on siten suurempi kuin happimolekyyli, joten otsonimolekyylien välille muodostuu enemmän dispersiovoiia kuin happimolekyylien välille.
T.32
Merkitse rastilla, mitä molekyylien välisiä sidoksia taulukon aineissa esiintyy.
T.33
Järjestä sidokset heikommasta vahvimpaan. Mitkä sidoksista muodostuvat atomien välille, mitkä molekyylien välille.
Dispersiovoima < Dipoli-dipolisidos < Vetysidos < Kovalenttinen sidos
T.34
Mitä atomien välisiä ja molekyylien välisiä sidoksia esiintyy suljetussa astiassa, jossa on
a) Happimolekyylejä
- Happiatomien välill on pooliton kovalenttinen kaksoissidos. Molekyylien välillä esiintyy dispersiovoimia.
b) Vertykloridimolekyylejä
- Verty ja klooriatomin välillä on yksinkertainen, poolinen kovalenttinen sidos. Molekyylien välillä esiintyy dipoli-dipolisidoksia.
c) Vesimolekyylejä?
- Vety ja happiatomin väliset sidokset ovat yksinkertaisia, poolisia, kovalenttisia sidoksia. Vesimolekyylien välillä esiintyy vertysidoksia.
T.36
Mallinna piirroksella seuraava tilannetta. Merkitse kuvaan osittaisvaraukset.
a) Vertyjodidimolekyylit sitoutuvat toisiinsa dipoli-dipolisidoksilla.
b) Ammoniakkimolekyylit sitoutuvat toisiinsa vertysidoksilla.
T.43
Tarkastele metaania (CH4), ammoniakkia (NH3) ja vettä (H2O). Selvitä kunkin aineen
a) Atomien väliset sidokset
- Kaikissa molekyyleissä atomien välilä on yksinkertaisia, poolisia, kovalenttisia sidoksia
b) Molekyylihilan rakenne
- Metaanin molekyylihila on koostunut poolittomista metaanimolekyyleistä. Ammoniakin ja veden molekyylihilat puolestaan rakentuvat poolisia dipolimolekyyleistä.
c) Molekyylihilaa koossapitävät sidokset
- Metaanin molekyylihilaa pitävät koossa metaanimolekyylien välille syntyvät dispersiovoimat. Ammoniakin ja veden molekyylihiloissa molekyylien välillä vaikuttavat sekä disperisovoimat että vetysidokset
Hae taulukkokirjasta fluorin, kloorin, bromin ja jodin sulamispisteet. Piirrä kuvaaja, jossa on esitetty halogeenin sulamispiste sen järjestys luvun funktiona.
a) Määritä kuvaajalta, mikä olisi astatiinin sulamispiste.
- Fluori: -219,6°C
- Kloori: -101°C
- Bromi: -7,2°C
- Jodi: 114°C

b)Selitä, miksi halogeenin sulamispiste kasvaa ryhmäsäässä alaspäin mentäessä.
- Sulamispiste kasvaa, koska molekyylien koko kasvaa. Suurempien poolittomien halogeenimolekyylien välille muodostuu enemmän dispersiovoimia, sillä hetkellisten dipolien määrä on suurempi moolekyyleissä, jossa on enemmän elektroneja.
T.30
Otsonin kiehumispiste on noin -112°C ja happikaasun alhaisempi, noin -183°C. Miksi kiehumispisteet eroavat toisistaan.
Molemmat hapen allotrooppiset muodot koostuvat poolittomista molekyyleistä. Otsonimolekyylissä on kolme happiatomia kun taas happiatomissa vain kaksi. Otsonimolekyyli on siten suurempi kuin happimolekyyli, joten otsonimolekyylien välille muodostuu enemmän dispersiovoiia kuin happimolekyylien välille.
T.32
Merkitse rastilla, mitä molekyylien välisiä sidoksia taulukon aineissa esiintyy.
| Molekyyli | Dipoli-dipolisidos | Vetysidos | Dispersiovoima |
| Vesi (H2O) | x | x | |
| Jodi (I2) | x | ||
| Vetykloridi (HCl) | x | x | |
| Ammoniakki (NH3) | x | x | |
| Typpi (N2) | x | ||
| Otsoni (O3) | x | ||
| Divetysulfidi (H2S) | x | x |
T.33
Järjestä sidokset heikommasta vahvimpaan. Mitkä sidoksista muodostuvat atomien välille, mitkä molekyylien välille.
Dispersiovoima < Dipoli-dipolisidos < Vetysidos < Kovalenttinen sidos
T.34
Mitä atomien välisiä ja molekyylien välisiä sidoksia esiintyy suljetussa astiassa, jossa on
a) Happimolekyylejä
- Happiatomien välill on pooliton kovalenttinen kaksoissidos. Molekyylien välillä esiintyy dispersiovoimia.
b) Vertykloridimolekyylejä
- Verty ja klooriatomin välillä on yksinkertainen, poolinen kovalenttinen sidos. Molekyylien välillä esiintyy dipoli-dipolisidoksia.
c) Vesimolekyylejä?
- Vety ja happiatomin väliset sidokset ovat yksinkertaisia, poolisia, kovalenttisia sidoksia. Vesimolekyylien välillä esiintyy vertysidoksia.
T.36
Mallinna piirroksella seuraava tilannetta. Merkitse kuvaan osittaisvaraukset.
a) Vertyjodidimolekyylit sitoutuvat toisiinsa dipoli-dipolisidoksilla.
b) Ammoniakkimolekyylit sitoutuvat toisiinsa vertysidoksilla.
T.43
Tarkastele metaania (CH4), ammoniakkia (NH3) ja vettä (H2O). Selvitä kunkin aineen
a) Atomien väliset sidokset
- Kaikissa molekyyleissä atomien välilä on yksinkertaisia, poolisia, kovalenttisia sidoksia
b) Molekyylihilan rakenne
- Metaanin molekyylihila on koostunut poolittomista metaanimolekyyleistä. Ammoniakin ja veden molekyylihilat puolestaan rakentuvat poolisia dipolimolekyyleistä.
c) Molekyylihilaa koossapitävät sidokset
- Metaanin molekyylihilaa pitävät koossa metaanimolekyylien välille syntyvät dispersiovoimat. Ammoniakin ja veden molekyylihiloissa molekyylien välillä vaikuttavat sekä disperisovoimat että vetysidokset