Tehtävät 4,1 S.104
T.1
Seuraavassa on luetelt aumiiin ominaisuuksia. Yhdistä ominaisuus yhteen sopivaankäyttökohteeseen.
Lentokoneiden rakenteet: Kevyt, luja, muokattava, edullinen
Virvotusjuomatölkit: Myrkytön, kierrätettävä, tiivis, hajuton
Lamput: Hejastaa valoa
Lämpöpatterit: Johtaa lämpöä
Kattilat: Johtaa lämpöä, kevyt
Saunan eristeet: Heijastaa lämpösäteilyä, palamaton, lämmöneriste
Alumiinifolio: Tiivis, hajuton, ei läpäisee makuja
Lääkkeiden pakkaukset: Tiivis, hajuton, ei läpäise makuja
Pakastusrasiat: Myrkytön, hajuton, kevyt, ei läpäise makuja
Veneden ja laivojen rakenteet: Kevyt, luja, muokattava, edullinen
Ilma- ja maakapelit: Johtaa sählöä, kevyt, edullinen.
T.2
Alumiini on tärkeä käyttömetalli, jota saadaan luonnossa esiintyvistä alumiiniyhdisteistä ja kierrätettävästä alumiiniromusta. Rakennusteollisuus käyttää alumiinia sen keveyden ja kestävyyden vuoksi. Alumiinia käytetään kuparin sijasta sähkölaitteissa ja johtimissa, koska se on halvempaa kuin kupari. Kotitalouksissa alumiini on tuttu muun muassa juomatölkeistä, foliokalvoista ja paistovuoista.
a) Kuvaa piirroksen avula, miten alumiinin metallihila on rakentunut.
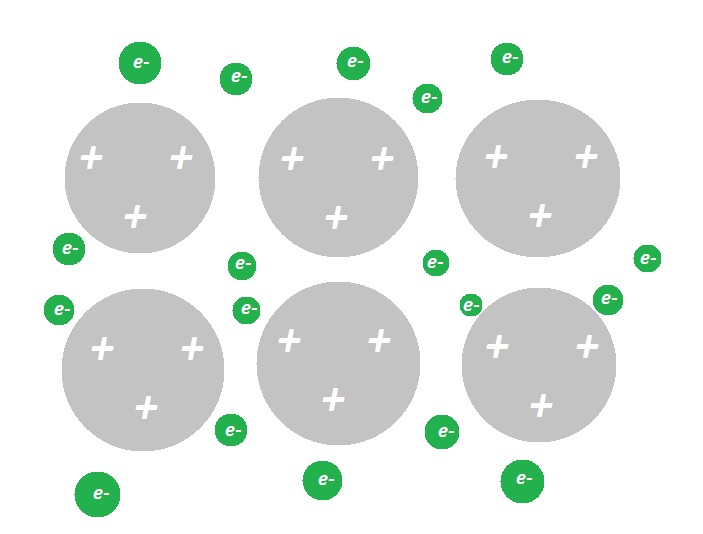
b) Selitä, mikä tekee alumiinimetallista niin kestävää, että sitä käytetään esimerkiksi lentokoneiden siivissä.
- Kun metallihila muodostu, jokainen alumiiniatomi luovuttaa kolme ulkoelektronia. Hilassa on siten runsaasti vapaita elektroneja ja pieniä, positiivisia alumiini-ioeja Al3+. Näiden ionien ja vapaiden elektronien välille muodostuu vahvoja sähköisiä vetovoimia, jotka selittävät alumiinin kestävyyden.
c) Selitä, miksi alumiini soveltuu sähkönjohteeksi.
- Metallin hilarakenteen vapaasti liikkuvat elektronit toimivat sähkön kuljettajina.
d) Selitä, miksi alumiini soveltuu muokata ohueksi alumiinifolioksi.
- Metallihilassa oleva vapaiden elektronien ''meri'' estää positiivisia alumiini-ioneja joutumasta kohdakkain, mistä syystä hilarakenne ei murru.
e) Selitä, miksi alumiini on hyvä paistovuoan materiaali.
- Lämpövärähtely siirtyy hyvin alumiinin metallihilassa, kun vapaat elektronit törmäilevät toisiinsa ja positiivinen metalli-ioneihin.
T.4
Piirrä kuvaaja, josta näkyy miten 1. ja 2. ryhmän metallien sulamispiste muuttuu järjestysluvun kasvaessa. Käytä hyväksi taulukkokirjasta löytyviä arvoja.
a) Mitä voit päätellä kuvaajasta? Miten selität sulamispisteiden muutokset?
- Metallien sulamispiste pienenee kummassalom ryhmässä, kun alkuaineen järjestysluku kasvaa. Poikkeus tästä on magnesium, jonka sulamispiste on alhaisempi kuin kuvajalta voisi olettaa. Sulamispisteen pieneneminen selittyy sillä, että ryhmässä alaspäin mentäessä metallihilan rakenneosana olevan positiivisen ionin koko kasvaa. Suurten ionien eli sähköinen vetovima metalli-ionien ja ulkoelektronien välillä on heikompi.
- Toinen ryhmän metalleilla on huomattavasti korkeammat sulamispisteet kuin esimmäisen tyhmän alkalimetalleilla. Tämä selittyy sillä, että toisen tyhmän metallien metallihila muodostuu positiivista ionesta, joiden varaus on 2+. Lisäksi hilassa on kutakin ionia kohti kaksi vapaata ulkoelektronia. Ensimmäisen ryhmän metallien hila puolestaan rakentuu ionesta, joidem varaus on1+ ja hilassa o kutakin ionia kohti vain yksi vapaa uloelektroni. Lisäksi toisen ryhmän, metallin positiivinen ioni (taulukkokrja). Toisen ryhmän metallien hilarakenne on siten tiiviimpi ja metallisidokset vahvempia.
b) Ennusta kuvaajalta rubidiumin ja strontiumin sulamispisteet.
- Kuvaajalta ennustettujen alkuaineiden sulamispisteet: Rubidium (Rb) n. 40 °C ja strontium (Sr) n. 775 °C.
Seuraavassa on luetelt aumiiin ominaisuuksia. Yhdistä ominaisuus yhteen sopivaankäyttökohteeseen.
Lentokoneiden rakenteet: Kevyt, luja, muokattava, edullinen
Virvotusjuomatölkit: Myrkytön, kierrätettävä, tiivis, hajuton
Lamput: Hejastaa valoa
Lämpöpatterit: Johtaa lämpöä
Kattilat: Johtaa lämpöä, kevyt
Saunan eristeet: Heijastaa lämpösäteilyä, palamaton, lämmöneriste
Alumiinifolio: Tiivis, hajuton, ei läpäisee makuja
Lääkkeiden pakkaukset: Tiivis, hajuton, ei läpäise makuja
Pakastusrasiat: Myrkytön, hajuton, kevyt, ei läpäise makuja
Veneden ja laivojen rakenteet: Kevyt, luja, muokattava, edullinen
Ilma- ja maakapelit: Johtaa sählöä, kevyt, edullinen.
T.2
Alumiini on tärkeä käyttömetalli, jota saadaan luonnossa esiintyvistä alumiiniyhdisteistä ja kierrätettävästä alumiiniromusta. Rakennusteollisuus käyttää alumiinia sen keveyden ja kestävyyden vuoksi. Alumiinia käytetään kuparin sijasta sähkölaitteissa ja johtimissa, koska se on halvempaa kuin kupari. Kotitalouksissa alumiini on tuttu muun muassa juomatölkeistä, foliokalvoista ja paistovuoista.
a) Kuvaa piirroksen avula, miten alumiinin metallihila on rakentunut.

b) Selitä, mikä tekee alumiinimetallista niin kestävää, että sitä käytetään esimerkiksi lentokoneiden siivissä.
- Kun metallihila muodostu, jokainen alumiiniatomi luovuttaa kolme ulkoelektronia. Hilassa on siten runsaasti vapaita elektroneja ja pieniä, positiivisia alumiini-ioeja Al3+. Näiden ionien ja vapaiden elektronien välille muodostuu vahvoja sähköisiä vetovoimia, jotka selittävät alumiinin kestävyyden.
c) Selitä, miksi alumiini soveltuu sähkönjohteeksi.
- Metallin hilarakenteen vapaasti liikkuvat elektronit toimivat sähkön kuljettajina.
d) Selitä, miksi alumiini soveltuu muokata ohueksi alumiinifolioksi.
- Metallihilassa oleva vapaiden elektronien ''meri'' estää positiivisia alumiini-ioneja joutumasta kohdakkain, mistä syystä hilarakenne ei murru.
e) Selitä, miksi alumiini on hyvä paistovuoan materiaali.
- Lämpövärähtely siirtyy hyvin alumiinin metallihilassa, kun vapaat elektronit törmäilevät toisiinsa ja positiivinen metalli-ioneihin.
T.4
Piirrä kuvaaja, josta näkyy miten 1. ja 2. ryhmän metallien sulamispiste muuttuu järjestysluvun kasvaessa. Käytä hyväksi taulukkokirjasta löytyviä arvoja.
a) Mitä voit päätellä kuvaajasta? Miten selität sulamispisteiden muutokset?
- Metallien sulamispiste pienenee kummassalom ryhmässä, kun alkuaineen järjestysluku kasvaa. Poikkeus tästä on magnesium, jonka sulamispiste on alhaisempi kuin kuvajalta voisi olettaa. Sulamispisteen pieneneminen selittyy sillä, että ryhmässä alaspäin mentäessä metallihilan rakenneosana olevan positiivisen ionin koko kasvaa. Suurten ionien eli sähköinen vetovima metalli-ionien ja ulkoelektronien välillä on heikompi.
- Toinen ryhmän metalleilla on huomattavasti korkeammat sulamispisteet kuin esimmäisen tyhmän alkalimetalleilla. Tämä selittyy sillä, että toisen tyhmän metallien metallihila muodostuu positiivista ionesta, joiden varaus on 2+. Lisäksi hilassa on kutakin ionia kohti kaksi vapaata ulkoelektronia. Ensimmäisen ryhmän metallien hila puolestaan rakentuu ionesta, joidem varaus on1+ ja hilassa o kutakin ionia kohti vain yksi vapaa uloelektroni. Lisäksi toisen ryhmän, metallin positiivinen ioni (taulukkokrja). Toisen ryhmän metallien hilarakenne on siten tiiviimpi ja metallisidokset vahvempia.
b) Ennusta kuvaajalta rubidiumin ja strontiumin sulamispisteet.
- Kuvaajalta ennustettujen alkuaineiden sulamispisteet: Rubidium (Rb) n. 40 °C ja strontium (Sr) n. 775 °C.