4. Moleyyliyhdiste
Molekyylisidoksen muodostuminen
Vetyatomin ytimessä on yksi protoni ja ainoalla elektronikuorella yksi elektroni.
Molemmat vetyatomit luovuttavat ainoat elektroninsa yhteiseen käyttöön, jolloin syntyy yhteinen elektronipari. Tämän elektroniparin elektronit sijaitsevat suurimmaksi osaksi vety-ytimien välissä ja näin syntyy kemiallinen sidos, molekyyli- eli kovalenttinen sidos, joka pitää vetymolekyylin koossa.
Koska sidos muodostuu yhteisestä elektroniparista, molempien vetyatomien voidaan ajatella omaavan nämä kaksi elektronia uloimmalla kuorellaan ja siten saavuttavan oktettirakenteen.
Vaikka molekyylisidos käyttäytyy jousen lailla, sitä mallinnetaan atomien välisellä yhtenäisellä viivalla: Vetymolekyyli H2 voidaan merkitä myös H-H.
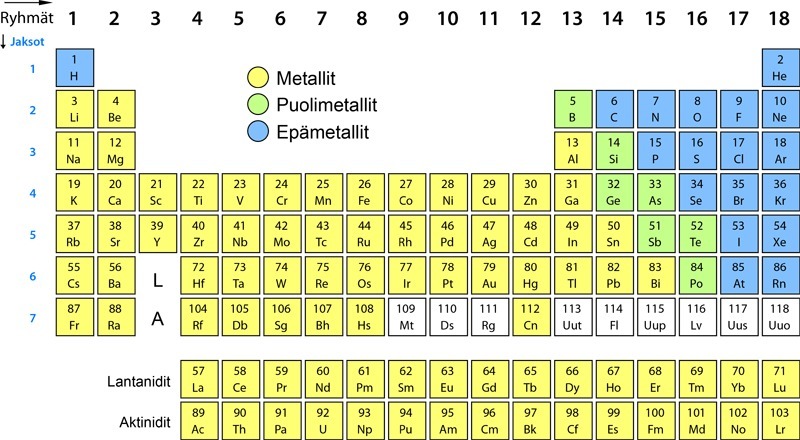
Millaisten atomien välille muodostuu molekyylisidoksia?
Jos ajattelet tähän mennessä tuttuja molekyylejä, kuten esimerkiksi vetymolekyyliä H2, happimolekyyliä O2, vesimolekyyliä H2O, hiilidioksidimolekyyliä CO2 ja metaanimolekyyliä CH4 niin huomaat kaikkien niissä esiintyvien alkuaineiden olevan epämetalleja. Kun epämetalli reagoi epämetallin kanssa, syntyy kovalenttisia sidoksia.
Ioniyhdisteen ja molekyyliyhdisteen erot
| ioniyhdiste | molekyyliyhdiste | |
| sähkönjohtavuus | Hajoaa vedessä ioneiksi. Vesiliuos johtaa sähköä |
Ei hajoa vedessä. Ei johda sähköä |
| muodostumistapa | metalliatomi luovuttaa ulkoelektroninsa epämetalliatomille. Molemmat saavat oktetin. Muodostuu positiivinen metalli-ioni ja negatiivinen epämetalli-ioni |
Epämetalliatomit jakavat elektroneja yhteiskäyttöön kunnes kaikilla atomeilla on oktetti. |
| Muodostavat alkuaineet | metalli + epämetalli | epämetalli + epämetalli |
| Sidostyyppi | Ionisidos | Kovalenttinen sidos |
Loppukevennys