3. Ioniyhdiste
Johdanto
 Meille kaikille tutuin ioniyhdiste on ruokasuola, joka koostuu natriumista ja kloorista. Natrium on metalli ja kloori on epämetalli. Ioniyhdiste muodostuu siis aina metallin ja epämetallin välille. Ruokasuola on siis yhdiste, jossa natriumin ja kloorin välillä on kemiallinen sidos jota kutsutaan ionisidokseksi. Tämä sidos, niin voimakas kuin se onkin, on herkkä katkeamaan joutuessaan veden kanssa kosketuksiin.
Meille kaikille tutuin ioniyhdiste on ruokasuola, joka koostuu natriumista ja kloorista. Natrium on metalli ja kloori on epämetalli. Ioniyhdiste muodostuu siis aina metallin ja epämetallin välille. Ruokasuola on siis yhdiste, jossa natriumin ja kloorin välillä on kemiallinen sidos jota kutsutaan ionisidokseksi. Tämä sidos, niin voimakas kuin se onkin, on herkkä katkeamaan joutuessaan veden kanssa kosketuksiin.Silmille näkymättömällä atomitasolla se näyttää taas tältä:
Tutki suolan liukenemista tällä Java-simulaatiolla myös itse.
Ionin muodostuminen
Ionit muodostuvat alkuaineista kahdella tavalla: luovuttamalla uloimpia elektronejaan pois tai vastaanottamalla niitä lisää. Alkuaineen tavoitteena on päästä oktettiin, jolloin alkuaine on muuttunut positiiviseksi tai negatiiviseksi ioniksi (ei sovellu jalokaasuihin).
Alkuaineatominen rakenne määrää sen, millainen ioni alkuaineesta muodostuu.
Alkuaineatominen rakenne määrää sen, millainen ioni alkuaineesta muodostuu.
Metalliatomit ja niiden ionit
Tarkastellaan alkuainetta natrium. Sen järjestysluku on 11 ja se kuuluu ensimmäiseen pääryhmään eli alkalimetalleihin. Natriumilla on alkuaineena 11 protonia ytimessä ja 11 elektronia kuorillaan. Atomin on siis ulkoisesti varaukseton. Elektronit jakautuvat sisäkuorelta alkaen järjestyksessä 2, 8, 1 eli uloimmalla kuorella on 1 elektroni eli ulkoelektroni.
natriumin atomi Na
https://peda.net/id/257cc04b17f
Natrium saavuttaa helpoiten oktetin, mikäli se luovuttaa pois ainoan ulkoelektroninsa. Tämän jälkeen natriumilla on siis vain kaksi elektronikuorta. Ytimessä on edelleen 11 protonia, mutta elektroneja on vain 10. Atomi on siis muuttunut ioniksi, jolla on positiivinen sähkövaraus, koska rakenteessa on protoneja yksi kappale enemmän. Ionin kuva on esitetty alla.
natriumin ioni Na1+
https://peda.net/id/257c33f017f
Samaa periaatetta voidaan soveltaa muihin ensimmäisen pääryhmän alkuaineisiin, koska niillä kaikilla on uloimalla kuorellaan vain yksi ulkoelektroni. Siten kaikkien alkalimetallien ionien sähkövaraus on 1+, aivan kuten natriumilla.
Yleistys: metalleilla on uloimmalla kuorellaan 1-3 ulkoelektronia. Koska elektronien määrä on pieni, muodostavat metallin oktetin luovuttamalla uloimmat elektroninsa pois. Sisäkuoret ovat valmiiksi täynnä, jolloin myös oktetti saavutetaan. Metalli-ionien varaus on 1+. 2+ tai 3+ riippuen siitä, kuinka monta ulkoelektronia on luovutettu.
natriumin atomi Na
https://peda.net/id/257cc04b17f
Natrium saavuttaa helpoiten oktetin, mikäli se luovuttaa pois ainoan ulkoelektroninsa. Tämän jälkeen natriumilla on siis vain kaksi elektronikuorta. Ytimessä on edelleen 11 protonia, mutta elektroneja on vain 10. Atomi on siis muuttunut ioniksi, jolla on positiivinen sähkövaraus, koska rakenteessa on protoneja yksi kappale enemmän. Ionin kuva on esitetty alla.
natriumin ioni Na1+
https://peda.net/id/257c33f017f
Samaa periaatetta voidaan soveltaa muihin ensimmäisen pääryhmän alkuaineisiin, koska niillä kaikilla on uloimalla kuorellaan vain yksi ulkoelektroni. Siten kaikkien alkalimetallien ionien sähkövaraus on 1+, aivan kuten natriumilla.
Yleistys: metalleilla on uloimmalla kuorellaan 1-3 ulkoelektronia. Koska elektronien määrä on pieni, muodostavat metallin oktetin luovuttamalla uloimmat elektroninsa pois. Sisäkuoret ovat valmiiksi täynnä, jolloin myös oktetti saavutetaan. Metalli-ionien varaus on 1+. 2+ tai 3+ riippuen siitä, kuinka monta ulkoelektronia on luovutettu.
Pääryhmien ja ionien varauksien yhteys
Pääryhmän numero kuvaa alkuaineatomin uloimmalla kuorella olevien elektronien määrää. Pääryhmän numerosta on siten helppo päätellä ryhmän alkuaineiden ionien varaus. Koska kaikilla saman pääryhmän alkuaineilla on sama määrä ulkoelektroneja, muodostavat atomit ionin samalla tavalla. Kaikilla saman pääryhmän alkuaineilla on siis sama ionivaraus.
|
pääryhmä |
ulkoelektronien määrä |
ionin varaus |
|
alkalimetallit |
1 |
1+ |
|
maa-alkalimetallit |
2 |
2+ |
|
booriryhmä |
3 |
3+ |
|
hiiliryhmä |
4 |
muodostavat molekyyliyhdisteitä |
|
typpiryhmä |
5 |
3- |
|
happiryhmä |
6 |
2- |
|
halogeenit |
7 |
1- |
|
jalokaasut |
8 (tai 2) |
ei ioneja, valmiiksi oktetissa |
Suolojen nimeäminen
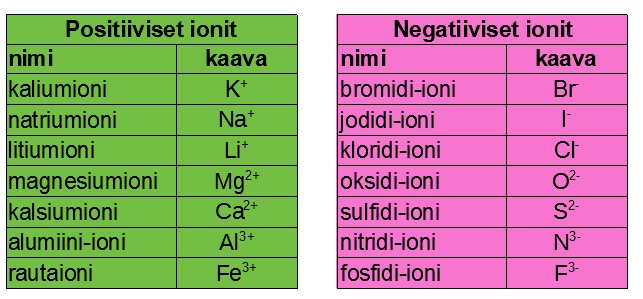
Suolan nimeäminen perustuu sen muodostaviin ioneihin. Nimen etuosa tulee suolan positiiviselta ionilta tai ioneilta ja on yleensä sama kuin sen metallin nimi, josta ioni on muodostunut. Esimerkiksi natrium-, kalsium-, kupari-, alumiini- jne.
Nimen loppuosa tulee suolan negatiiviselta ionilta tai ioneilta mutta niiden nimeäminen ei mene yhtä suoraviivaisesti kuin positiivisella puolella. Yhdestä epämetallin atomista muodostuneet negatiiviset ionit päättyvät tavuun -di. Esimerkiksi happiatomista muodostuu oksidi-, rikkiatomista sulfidi- ja klooriatomista kloridi-ioni. Lisäksi on syytä tuntea typpiatomista muodostuva nitridi-ioni ja foforiatomista muodostuva fosfidi-ioni.
Nimen loppuosa tulee suolan negatiiviselta ionilta tai ioneilta mutta niiden nimeäminen ei mene yhtä suoraviivaisesti kuin positiivisella puolella. Yhdestä epämetallin atomista muodostuneet negatiiviset ionit päättyvät tavuun -di. Esimerkiksi happiatomista muodostuu oksidi-, rikkiatomista sulfidi- ja klooriatomista kloridi-ioni. Lisäksi on syytä tuntea typpiatomista muodostuva nitridi-ioni ja foforiatomista muodostuva fosfidi-ioni.