6. Hapot ja emäkset
Aine voi olla hapan, emäksinen tai neutraali
Aineet ja yhdisteet voidaan luokitella niiden happamuuksien perusteella happamiksi, neutraaleiksi tai emäksiksi aineiksi. Sitruunan kirpeä ja hapan maku aiheutuu siinä olevasta sitruunahaposta, kun taas suolakurkkuja säilötään happamassa etikkahappoliemessä. Puhdas vesi on varmasti tutuin esimerkki neutraalista aineesta. Siivouskomerosta puolestaan löytyy voimakkaasti emäksiä puhdistusaineita, kuten putkienavausliuokset ja konetiskiaineet.
Kuten aiemmin oppilastyössä totesit, johtavat ioniyhdisteiden vesiliuokset sähköä. Liuoksessa olevat positiiviset ja negatiiviset ionit pääsevät liikkumaan vapaasti ja toimivat sähkön kuljettajina.
Emäksisyys on happamuuden vastakohta. Emäs on aine, joka pystyy vastaanottamaan vetyionin (H+). Vesiliuoksen emäksisyys johtuu hydroksidi-ioneista (OH-). Mitä enemmän liuoksessa on hydroksidi-ioneja, sen emäksisempi liuos on.
Liuos voi olla myös neutraali. Neutraalissa liuoksessa on yhtä paljon oksonium- ja hydroksidi-ioneja, jolloin niiden vaikutuksen kumoavat toisensa.
Tutki ilmiötä tällä Java-simulaatiolla.
https://peda.net/id/327bf4f417f
Kuten aiemmin oppilastyössä totesit, johtavat ioniyhdisteiden vesiliuokset sähköä. Liuoksessa olevat positiiviset ja negatiiviset ionit pääsevät liikkumaan vapaasti ja toimivat sähkön kuljettajina.
Videosta huomaat, että happojen ja emästen vesiliuokset johtavat myös sähköä. Niidenkin täytyy tuottaa vesiliuoksiinsa ioneja.
Sitruunahapon hapan maku ei johdu happomolekyylistä vaan sen kyvystä luovuttaa vetyioni eli protoni (H+). Tämä happomolekyylistä irtoava vetyioni reagoi vesimolekyylin kanssa ja syntyy oksoniumioni, joka aiheuttaa vesiliuoksen happamuuden. Mitä enemmän liuoksessa on oksoniumioneja, sen happamampi liuos on.[[$ \text{H}^+ + \text{H}_2\text{O} \rightarrow \text{H}_3\text{O}^+ $]]
Emäksisyys on happamuuden vastakohta. Emäs on aine, joka pystyy vastaanottamaan vetyionin (H+). Vesiliuoksen emäksisyys johtuu hydroksidi-ioneista (OH-). Mitä enemmän liuoksessa on hydroksidi-ioneja, sen emäksisempi liuos on.
[[$ \text{NaOH} + \text{H}_2\text{O} \rightarrow \text{Na}^+ + \text{OH}^- $]]
Liuos voi olla myös neutraali. Neutraalissa liuoksessa on yhtä paljon oksonium- ja hydroksidi-ioneja, jolloin niiden vaikutuksen kumoavat toisensa.
[[$ \text{H}_3\text{O}^+ + \text{OH}^- \rightarrow \text{2 H}_2\text{O} $]]
Tutki ilmiötä tällä Java-simulaatiolla.
https://peda.net/id/327bf4f417f
Happamuus todetaan indikaattorilla
Indikaattorit ovat väriaineita, joita käytetään liuoksen happamuuden toteamiseen. Indikaattorit ovat erivärisiä happamassa, neutraalissa ja emäksisessä liuoksessa. Indikaattoreiden värit tunnetaan, joten niiden avulla voidaan päätellä liuoksen happamuus.
https://peda.net/id/3280786a17f
https://peda.net/id/327d17fa17f
Esimerkiksi BTS:n väri muuttuu keltaisesta vihreän kautta siniseen. Fenoliftaleiini muuttuu värittömästä fuksiaan, joka on kirkkaan vaaleanpunainen.
https://peda.net/id/327da6cb17f
Myös esim. puolukasta ja punakaalista voidaan valmistaa indikaattoriliuos.
https://peda.net/id/327f52a817f
Video luonnonindikaattorien värinmuutoksista.
https://peda.net/id/3280786a17f
https://peda.net/id/327d17fa17f
Esimerkiksi BTS:n väri muuttuu keltaisesta vihreän kautta siniseen. Fenoliftaleiini muuttuu värittömästä fuksiaan, joka on kirkkaan vaaleanpunainen.
https://peda.net/id/327da6cb17f
Myös esim. puolukasta ja punakaalista voidaan valmistaa indikaattoriliuos.
https://peda.net/id/327f52a817f
Video luonnonindikaattorien värinmuutoksista.
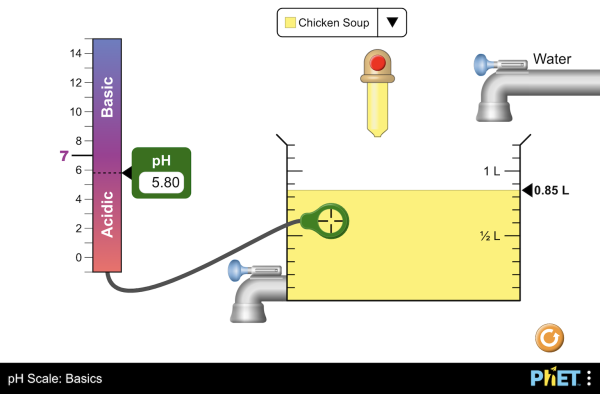
Happamuus ilmaistaan pH-arvona
Kaikki happamat ruoka-aineet eivät ole yhtä happamia, eivätkä emäksiset yhtä emäksisiä On olemassa siis eri vahvuisia happoja ja emäksiä. Aineiden vesiliuoksen happamuus ilmaistaan pH-asteikolla, joka kertoo onko liuos neutraali, hapan tai emäksinen.
pH:ta voidaan mitata esimerkiksi pH-paperilla tai pH-mittarilla.
https://peda.net/id/327ec43117f
Huomaa, että saippua voi olla myös emäksistä (vertaa alta taulukosta).
Hyvin happamat tai emäksiset liuokset ovat vaarallisen syövyttäviä. Alta taulukosta näet joidenkin tuttujen aineiden pH-arvoja.
https://peda.net/id/327fe4fd17f
- pH < 7 hapan
- pH = 7 neutraali
- pH > 7 emäksinen
pH:ta voidaan mitata esimerkiksi pH-paperilla tai pH-mittarilla.
https://peda.net/id/327ec43117f
Huomaa, että saippua voi olla myös emäksistä (vertaa alta taulukosta).
Hyvin happamat tai emäksiset liuokset ovat vaarallisen syövyttäviä. Alta taulukosta näet joidenkin tuttujen aineiden pH-arvoja.
https://peda.net/id/327fe4fd17f
Tutki miten laimentaminen vaikuttaa pH-arvoon
Emäkset ja hapot ovat tärkeitä teollisuuden raaka-aineita
Happosade
Happosade on sadetta, jonka pH on alle 5,6. Sadevesi on normaalistikin hiukan hapanta (pH hieman alle 6), koska ilmakehän hiilidioksidi liukenee sadeveteen ja muodostaa hiilihappoa. Hiilihappo on heikko happo. Itse happosade johtuu sadeveteen liuenneista ilmansaasteista, kuten esim. teollisuuden rikki- ja typpipäästöistä.
https://peda.net/id/327c866d17f
Soittolistassa on kaksi videota. Ensimmäisessä muutetaan veden pH:ta puhaltamalla. Muutoksen saa aikaan ihmisen hengityksessä oleva hiilidioksidi. Toisessa videossa rakennetaan hiilidioksidimolekyyli muovimalleilla.
https://peda.net/id/327c866d17f
Soittolistassa on kaksi videota. Ensimmäisessä muutetaan veden pH:ta puhaltamalla. Muutoksen saa aikaan ihmisen hengityksessä oleva hiilidioksidi. Toisessa videossa rakennetaan hiilidioksidimolekyyli muovimalleilla.