2. Alkuaineiden jaksollinen järjestelmä
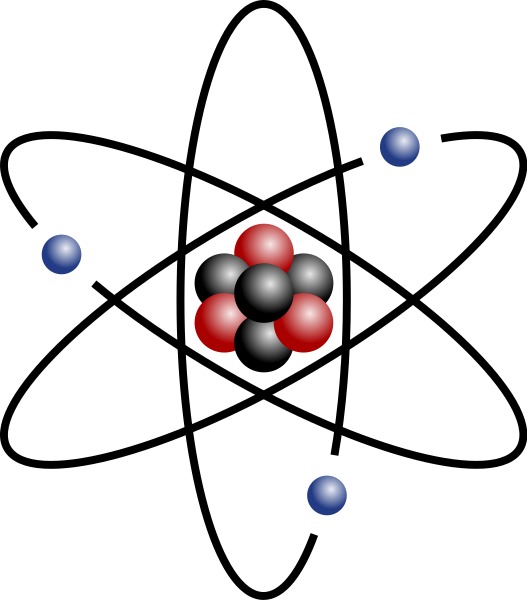
Atomi koostuu protoneista, neutroneista ja elektroneista
Ennen kuin alkuaineiden jaksollista järjestelmää on mahdollista tulkita, täytyy ymmärtää atomin rakennetta hieman yksityiskohtaisemmin.
Aikaisemmista kemian opinnoistasi tiedät, että atomi koostuu kolmenlaisista hiukkasista:
-
Positiivisesti varautuneista protoneista (p+), jotka sijaitsevat atomin ytimessä. Protonien lukumäärä on sama kuin alkuaineen järjestysluku.
-
Sähköisesti neutraaleista neutroneista (n), jotka sijaitsevat myös atomin ytimessä.
-
Negatiivisesti varautuneista elektroneista (e-), jotka sijaitsevat ytimen ympärillä.
Koska positiivisesti varautuneiden protonien ja negatiivisesti varautuneiden elektronien lukumäärät atomissa ovat samat, atomi on kokonaisuudessaan varaukseton eli neutraali. Elektronien sijoittuminen ytimen ympärille kuvataan ns. kuorimallilla. Kuorimalli on hyvin yksinkertaistettu tapa kuvata atomin rakennetta ja se soveltuukin vain järjestysluvun 1-18 omaavien alkuaineiden atomimallien piirtämiseen.
Jaksollisen järjestelmän keksiminen
Kemian tutkimuksen pioneeriaikoina 1700- ja 1800 -luvuilla löydettiin paljon uusia alkuaineita. Tutkimusten ohessa havaittiin, että tietyillä alkuaineilla oli samanlaisia kemiallisia ominaisuuksia. Havaintojen pohjalta sen ajan kemistit saivat ajatuksen, että alkuaineet voitaisiin asettaa järjestykseen niiden ominaisuuksiin perustuen.
Tätä palapeliä yritettiin koota monella tavalla, kunnes venäläinen kemisti Dimitri Mendelejev 1800-luvun puolivälin jälkeen ymmärsi jättää tyhjiä aukkoja omaan järjestelmäänsä. Hän ennusti, että aukot kuuluvat alkuaineille joita ei vielä ollut löydetty, mutta tullaan löytämään myöhemmin. Lopulta tyhjät paikat saatiin täytettyä mikä osoitti, että Mendelejev oli oikeassa.

Jaksollinen järjestelmä on edelleen käytössä, vaikka Mendelejevin aikaan mittaukset suoritettiin hämyisissä laboratorioissa paljon nykyajan laitteita ja kokeita alkeellisimmilla menetelmillä. Myöskään atomin rakennetta ei silloin vielä tunnettu. Vuosisatojen aikana taulukkoa on täydennetty ja täsmennetty uusien tutkimustulosten myötä. Näin tiede toimii.
Tätä palapeliä yritettiin koota monella tavalla, kunnes venäläinen kemisti Dimitri Mendelejev 1800-luvun puolivälin jälkeen ymmärsi jättää tyhjiä aukkoja omaan järjestelmäänsä. Hän ennusti, että aukot kuuluvat alkuaineille joita ei vielä ollut löydetty, mutta tullaan löytämään myöhemmin. Lopulta tyhjät paikat saatiin täytettyä mikä osoitti, että Mendelejev oli oikeassa.

Jaksollinen järjestelmä on edelleen käytössä, vaikka Mendelejevin aikaan mittaukset suoritettiin hämyisissä laboratorioissa paljon nykyajan laitteita ja kokeita alkeellisimmilla menetelmillä. Myöskään atomin rakennetta ei silloin vielä tunnettu. Vuosisatojen aikana taulukkoa on täydennetty ja täsmennetty uusien tutkimustulosten myötä. Näin tiede toimii.
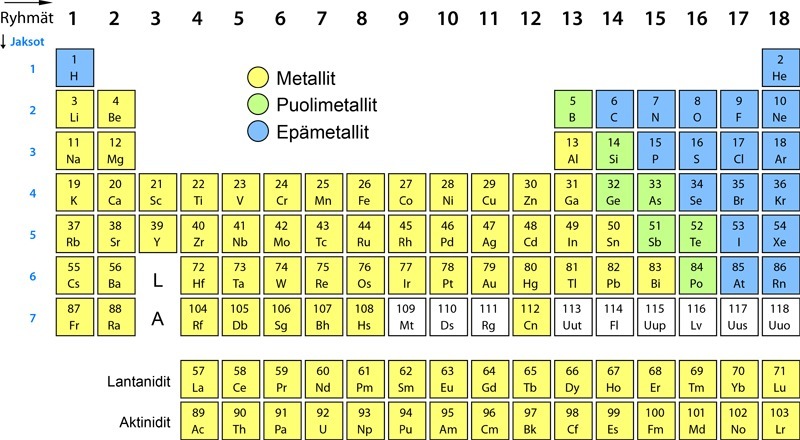
Tätä taulukkoa kutsutaan alkuaineiden jaksolliseksi järjestelmäksi. Siitä löytyy valtavasti kemiallista tietoa, kunhan sitä oppii tulkitsemaan. Ensimmäinen havainto taulukosta on, että siinä on kolmenlaisia alkuaineita: suurin osa alkuaineista on metalleja, loput joko epämetalleja tai puolimetalleja. Puolimetalleilla on sekä metallien että epämetallien ominaisuuksia.
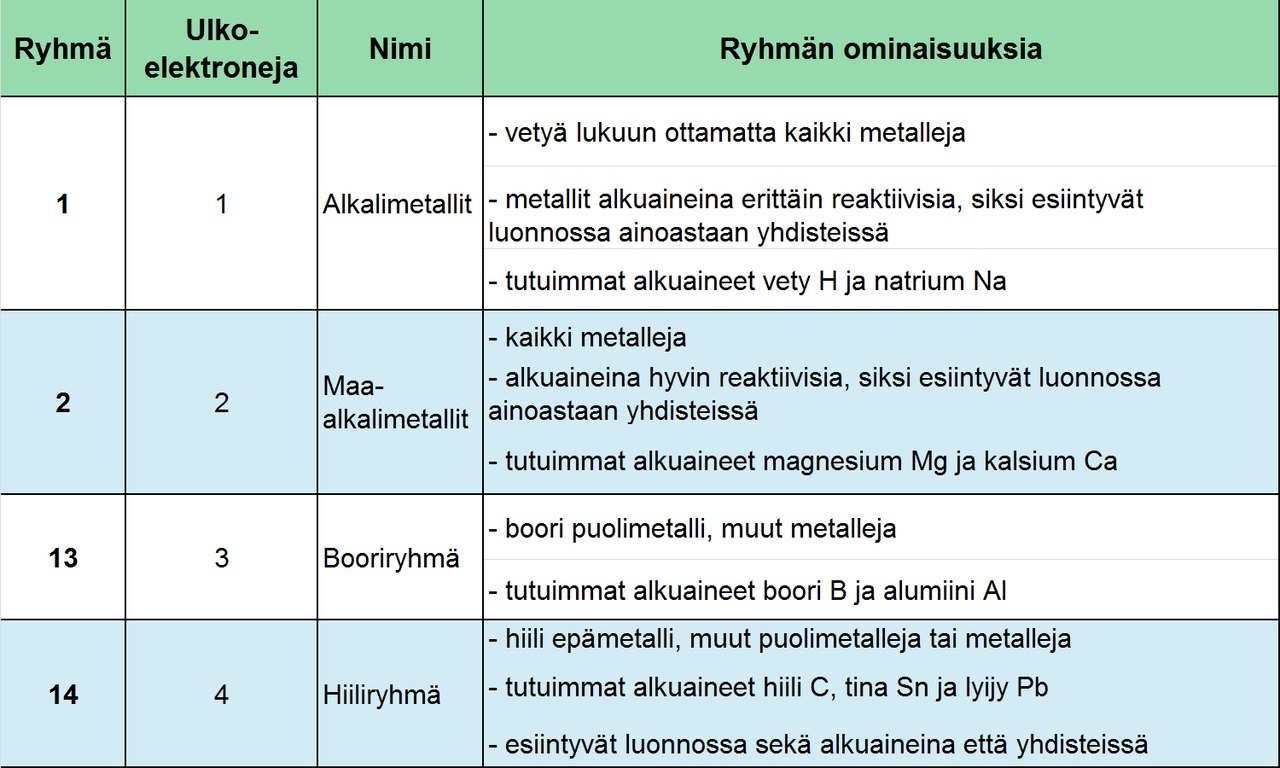
Alkuaineen järjestysluku Z on merkitty alkuaineen merkin yläpuolelle. Sekä pysty- että vaakarivit ovat numeroitu. Pystyrivejä on 18 ja niitä kutsutaan ryhmiksi, vaakarivejä puolestaan on 7 ja niitä kutsutaan jaksoiksi. Pystyrivejä 1, 2, 13, 14, 15, 16, 17 ja 18 kutsutaan pääryhmiksi, pystyrivejä 3 - 12 sivuryhmiksi. Saman pääryhmän atomeilla on on yhtä monta elektronia uloimmalla kuorella.
Sivuryhmien alkuaineet ovat kaikki metalleja. Näistä löytyvät tutut ja tärkeät metallit, kuten esimerkiksi kromi Cr, rauta Fe, koboltti Co, nikkeli Ni, kupari Cu, sinkki Zn, hopea Ag ja kulta Au. Kaikilla sivuryhmien metalleilla on 1 tai 2 elektronia uloimmalla kuorellaan.
Jaksollisen järjestelmän vaakarivit ovat jaksoja. Saman jakson (vaakarivin) alkuaineiden atomeilla on elektroneja yhtä monella kuorella.
Alkuaineen järjestysluku Z on merkitty alkuaineen merkin yläpuolelle. Sekä pysty- että vaakarivit ovat numeroitu. Pystyrivejä on 18 ja niitä kutsutaan ryhmiksi, vaakarivejä puolestaan on 7 ja niitä kutsutaan jaksoiksi. Pystyrivejä 1, 2, 13, 14, 15, 16, 17 ja 18 kutsutaan pääryhmiksi, pystyrivejä 3 - 12 sivuryhmiksi. Saman pääryhmän atomeilla on on yhtä monta elektronia uloimmalla kuorella.
Sivuryhmien alkuaineet ovat kaikki metalleja. Näistä löytyvät tutut ja tärkeät metallit, kuten esimerkiksi kromi Cr, rauta Fe, koboltti Co, nikkeli Ni, kupari Cu, sinkki Zn, hopea Ag ja kulta Au. Kaikilla sivuryhmien metalleilla on 1 tai 2 elektronia uloimmalla kuorellaan.
Jaksollisen järjestelmän vaakarivit ovat jaksoja. Saman jakson (vaakarivin) alkuaineiden atomeilla on elektroneja yhtä monella kuorella.