1. Atomi
Kertaus
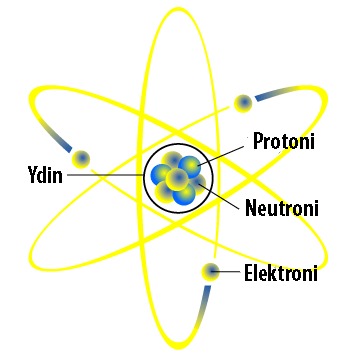
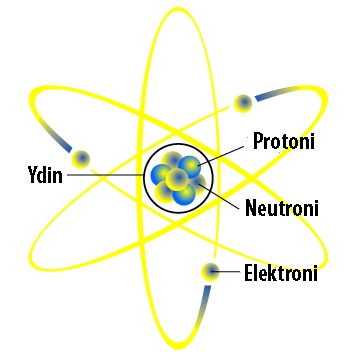
Nykyisin tiedetään, että atomit voidaan jakaa pienempiin osiin. Atomit koostuvat ytimestä ja sitä ympäröivästä elektronipilvestä. Ytimessä sijaitsevat neutronit ja protonit. Erilaisia alkeishiukkasia atomissa on siis kolme: neutroni, protoni ja elektroni.
Elektronien varaus on negatiivinen (-1), protonien positiivinen (+1) ja neutroneilla nimensä mukaisesti ei ole varausta.
Atomin kokonaisvaraus on aina nolla. Atomilla ei siis ole varausta. Tämä johtuu siitä, että elektronien ja protonien määrä atomissa on aina sama ja näin erimerkkiset varaukset kumoavat toisensa.
Järjestysluku Z
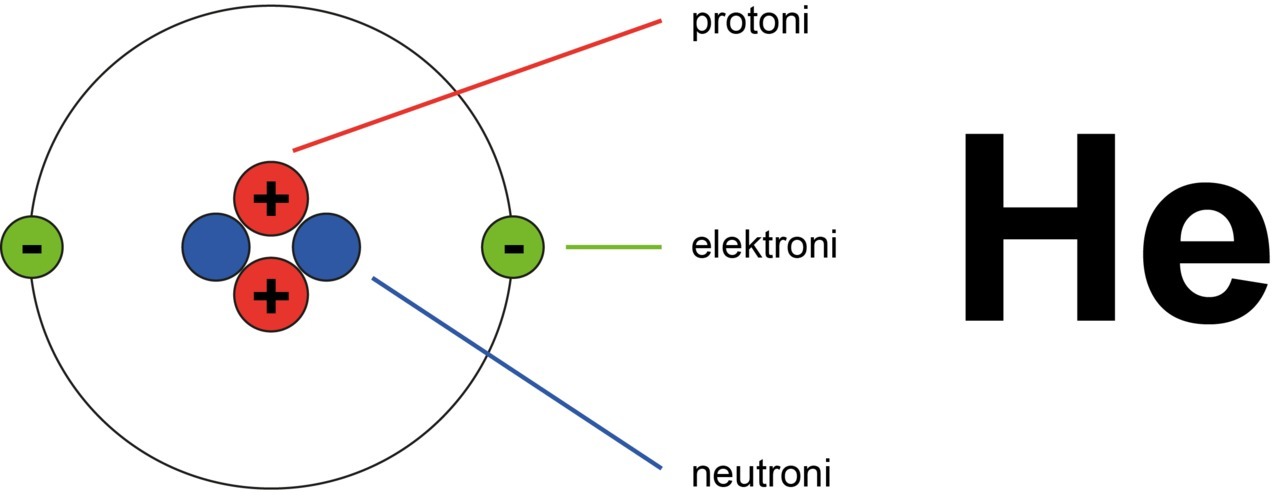
Heliumatomissa on kaksi protonia. Heliumin järjestysluku on siis 2.
Massaluku A
Kuvassa kyseessä on litium-atomi, jolla on ytimessä kolme protonia ja neljä neutronia. Ydintä kiertää kolme elektronia. Litiumin järjestysluku on siis 3 ja massaluku 7. Massaluku on ytimessä olevien protonien ja neutronien yhteismäärä.
Yleistys
 , missä
, missäX = kyseisen alkuaineen kemiallinen tunnus,
Z =Järjestysluku = protonien lukumäärä
A = massaluku = protonien ja neutroneiden lukumäärä.
Jos laskemme erotuksen A - Z, niin saamme isotoopin neutronien lukumäärän selville
Isotooppi
Vedyllä on kolme eri isotooppia
 ,
,  ja
ja  . Tutkitaan, mitä eroa isotoopeilla on keskenään?
. Tutkitaan, mitä eroa isotoopeilla on keskenään?
 , Z = 1 eli protoneita yksi, A = 1
, Z = 1 eli protoneita yksi, A = 1  N = A - Z = 1 - 1 = 0 eli neutroneita ei ole yhtään.
N = A - Z = 1 - 1 = 0 eli neutroneita ei ole yhtään.
 , Z = 1 eli protoneita yksi, A = 2
, Z = 1 eli protoneita yksi, A = 2  N = A - Z = 2 - 1 = 1 eli neutroneita yksi. Kyseessä raskas vety eli deuterium.
N = A - Z = 2 - 1 = 1 eli neutroneita yksi. Kyseessä raskas vety eli deuterium.
 , Z = 1 eli protoneita yksi, A = 3
, Z = 1 eli protoneita yksi, A = 3  N = A - Z = 3 - 1 = 2 eli neutroneita kaksi. Kyseessä on vedyn isotooppi nimeltään tritium.
N = A - Z = 3 - 1 = 2 eli neutroneita kaksi. Kyseessä on vedyn isotooppi nimeltään tritium.
Bohrin atomimallin piirtäminen
-
Piirrä ytimen ympärille isompi ympyrä. Tämä on 1. kuori eli sisin elektronikuori. Tälle kuorelle mahtuu 2 elektronia. Merkitse ne tälle ympyrälle vaikkapa pieninä mustina palloina.
-
Jos elektroneja on vielä jäljelle, piirrä uusi ympyrä isommalla säteellä ytimen ympärille. Tämä on 2. kuori ja sille mahtuu 8 elektronia. Merkitse elektronit tälle kuorelle.
-
Mikäli elektroneja on vielä jäljelle, piirrä taas uusi ympyrä isommalla säteellä. Tämä on 3. kuori jolle mahtuu 18 elektronia. Täytä kuori elektroneilla.
Eli
| kuoren numero | elektronien lukumäärä |
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| n | 2n2 |