KPL 4 Olomuodon muutokset
Johdanto
Vettä keitetään liedellä. Veden keittämiseen eli höyrystämiseen tarvitaan energiaa. Sanotaan, että höyrystymisessä energiaa sitoutuu aineeseen. Energia on peräisin sähkövoimalaitoksesta. Sähköenergia muuntuu tilanteessa lämpöenergiaksi. Mitä ainetta vedestä ja puurosta nouseva höyry on? Entä mitä ovat veden ja puuron kiehuessa syntyvät kuplat?
Aineen olomuodot


Jään massa ei muutu sulaessa. Kuvassa näkyy vaa’an lukema ennen ja jälkeen jääpalojen sulamisen.
Aineen rakenneosasten välisten sidosten määrä on erilainen eri olomuodoissa. Kiinteässä olomuodossa rakenneosasten välillä on eniten sidoksia ja kaasumaisessa olomuodossa niitä ei ole tai niitä on erittäin vähän.

Kuvassa on esitetty aineen olomuodon muutokset ja niiden nimitykset. Ylöspäin nousevat nuolet osoittavat olomuodon muutokset, joissa tarvitaan energiaa. Alaspäin laskevat nuolet puolestaan osoittavat olomuodon muutokset, joissa vapautuu energiaa.
Luonnossa tapahtuu kaikkia mainittuja olomuodon muutoksia. Vesistöjen vedet jäätyvät talviaikaan ja sulavat keväisin. Kesäaamuisin nurmikko on kostea, vaikkei yöllä olekaan satanut vettä. Ilmassa oleva kosteus on tiivistynyt nurmikkoon. Vesistöistä vesien pinnalta haihtuu (höyrystyy) vettä vesihöyryksi. Talviaikaan ulos viedyt pyykit kuivuvat, vaikka ne jäätyvätkin. Tilanteessa vesi sublimoituu kiinteästä olomuodosta kaasuksi. Syksyisin nurmikot ovat kuuran peitossa kylmän yön jäljiltä. Kuura muodostuu, kun vesihöyry härmistyy suoraan kiinteäksi jääksi.
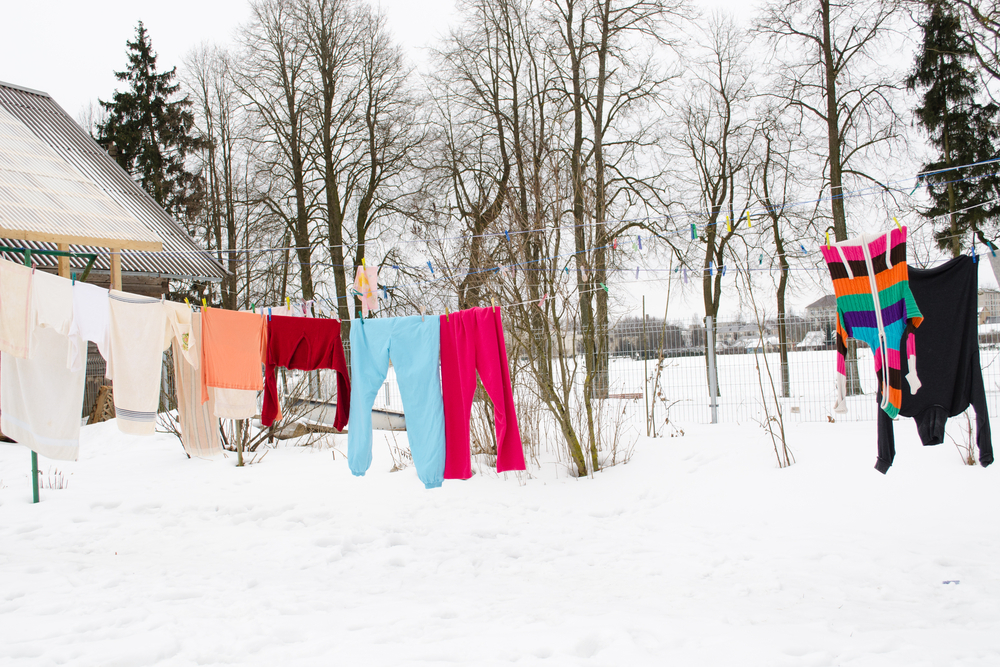
Pyykit kuivuvat myös pakkasella, kun jäätynyt vesi sublimoituu.
Syksyllä kylmän yön jälkeen heinät ja maa voivat olla kuuran peitossa. Kuura on muodostunut suoraan ilman vesihöyrystä härmistymällä kylmille pinnoille. Huurre muodostuu puolestaan alijäähtyneestä vedestä kylmille pinnoille.
Puuaidan pinnasta jää sublimoituu vesihöyryksi, kun Aurinko lämmittää aitaa.

Kiinteässä olomuodossa aineen rakenneosaset ovat sitoutuneet toisiinsa tiukasti. Lämpöliike on kiinteässä aineessa rakenneosien ja niiden välisten sidosten värähtelyä. Nestemäisessä olomuodossa rakenneosasten välisiä sidoksia on vähemmän ja rakenneosaset pääsevät liikkumaan toistensa ohitse. Kaasumaisessa olomuodossa rakenneosasten välillä ei ole sidoksia ollenkaan tai niitä on erittäin vähän. Siten rakenneosat pääsevät liikkumaan vapaasti.
Sulamispiste ja kiehumispiste
Kiehumispiste on jokaiselle aineelle ominainen lämpötila, jossa kyseinen aine muuttuu nesteimäisestä olomuodosta kaasumaiseen olomuotoon tai päinvastoin. Kiehumispistettä voidaan muuttaa mm. paineen ja epäpuhtauksien avulla.
Eri aineiden sulamis- ja kiehumispisteitä löydät täältä.
Sulamis- ja kiehumispisteeseen vaikuttavia tekijöitä
Sulamispiste on riippuvainen paineesta. Paineen suurentaminen alentaa sellaisen aineiden sulamispistettä, jotka laajenevat muuttuessaan nesteestä kiinteäksi (esimerkiksi vesi).
Jää sulaa rautalangan alta, koska rautalanka kohdistaa jäähän suuren paineen. Paineen kasvu laskee sulamispistettä. Jäätyminen tapahtuu uudelleen rautalangan yläpuolella.
Talvisin moottoriteitä suolataan, jotta vesi ei jäätyisi tien pintaan. Suolan liukeneminen veteen laskee sulamispistettä ja näin vesi ei jäädy tien pintaan pienellä pakkasella. Vastaavasti kiehumispiste nousee, kun veteen liukenee suolaa.
Suolan lisääminen lumeen alentaa sen sulamispistettä. Siksi lumi, johon on lisätty suolaa, sulaa aikaisemmin.
Energia olomuodon muutoksissa
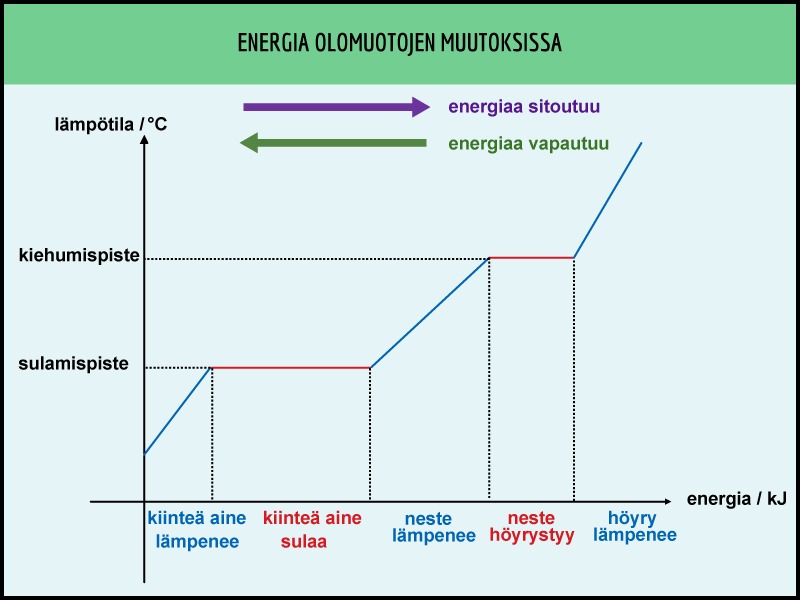
Kuvassa on esitetty aineen olomuodon muutokset ja niihin liittyvät energian muutokset. Liikuttaessa kuvaajassa vasemmalta oikealle energiaa sitoutuu aineeseen. Kun liikutaan päinvastaiseen suuntaan, energiaa vapautuu ympäristöön.
Kun kiinteän aineen lämpötila on kohonnut pisteeseen, jossa rakenneosasten välisiä sidoksia alkaa katkeamaan, ollaan aineen sulamispisteessä. Kyseinen lämpötila on ominainen kullekin aineelle. Esimerkiksi jää sulaa 0 °C:ssa ja tina 231,9 °C:ssa. Katso muiden aineiden sulamis- ja kiehumispisteet taulukosta.
Olomuodon muutosten aikana lämpötila ei muutu. Tämä johtuu siitä, että aineeseen tuotu energia ei kasvata enää rakenneosasten värähdysliikettä, vaan sitä tarvitaan aineen rakenneosasten välisten sidosten rikkomiseen.
Ominaissulamislämpö
Aineen sulattamiseksi kiinteästä aineesta nesteeksi tarvitaan energiaa. Energian suuruuden laskemiseksi pitää tietää, mikä on aineen massa ja mikä on aineen ominaissulamislämpö. Ominaissulamislämmön tunnus on s ja yksikkö on kJ/kg eli se ilmoittaa tarvittavan energian kilogrammaa kohden.

Ominaishöyrystymislämpö
Aineen höyrystämiseksi nesteestä höyryksi tarvitaan energiaa. Energian suuruuden laskemiseksi pitää tietää, mikä on aineen massa ja mikä on aineen ominaishöyrystymislämpö. Ominaishöyrystymislämmön tunnus on r ja yksikkö on kJ/kg eli se ilmoittaa tarvittavan energian kilogrammaa kohden.

Samalla kaavalla lasketaan vapautuvan energian määrä, kun kaasumainen aine tiivistyy nesteeksi. Taulukosta löydät aineiden ominaishöyrystymislämpöjä.
Laskuesimerkkejä
Laskuesimerkki 1.
Kuinka paljon energiaa tarvitaan, kun 1,0 kg sulamispisteessä olevaa jäätä sulatetaan?
Ratkaisu:
[[$ m = $]] 1,0 kg
[[$ s = $]] 333 [[$ \dfrac{kJ}{kg} $]]
[[$ E = $]] ?
[[$ E = s \cdot m = 333 \, \dfrac{kJ}{kg} \cdot 1,0 \, kg = 333 \, kJ $]]
Sulamisen aikana lämpötila ei muutu. Siksi lämpötilan muutosta ei ole mukana laskukaavassa.
Laskuesimerkki 2.
Kuinka paljon energiaa tarvitaan, kun 1,0 kg kiehumispisteessä olevaa vettä höyrystetään?
Ratkaisu:
[[$ m = $]] 1,0 kg
[[$ r = $]] 2160 [[$ \dfrac{kJ}{kg} $]]
[[$ E = $]] ?
[[$ E = r \cdot m = 2160 \, \dfrac{kJ}{kg} \cdot 1,0 \, kg = 2160 \, kJ $]]
Laskuesimerkki 3.
Kuinka paljon energiaa tarvitaan, kun 1,5 kg 35 °C:sta vettä höyrystetään?
Ratkaisu:
[[$ m = $]] 1,5 kg
[[$ c = $]] 4,19 [[$ \dfrac{kJ}{kg\,°C} $]]
[[$ r = $]] 2260 [[$ \dfrac{kJ}{kg} $]]
[[$ \Delta t $]] = 100 °C - 35 °C = 65 °C
Ensin vesi on lämmitettävä kiehuvaksi:
[[$ E_1 = c \cdot m \cdot \Delta t = 4,19 \dfrac{kJ}{kg \, °C} \cdot 1,5 \, kg \cdot 65 \, °C = 408,525 \, kJ $]]
Sitten 100 °C vesi höyrystetään:
[[$ E_2 = r \cdot m = 2260 \dfrac{kJ}{kg} \cdot 1,5 \, kg = 3390 \, kJ $]]
Tarvittu energia on eo. summa eli
[[$ E = E_1 + E_2 = 408,525 \, kJ + 3390 \, kJ = 3798,525 \, kJ \approx 3800 \, kJ $]]
Laskuesimerkki 4.
Kuinka paljon energiaa tarvitaan, kun 3,6 kg jäätä, jonka lämpötila on -15 astetta, höyrystetään? Oletuksena on, että aineen massa säilyy samana koko muutosprosessin aikana.
Ratkaisu:
Jään on käytävä läpi olomuodon muutokset kiinteästä, nesteen kautta höyryksi. Olomuodon muutos voi tapahtua vain tietyssä lämpötilassa, joten ainetta on lämmitettävä kyseiseen lämpötilaan ennen kuin olomuodon muutos voi tapahtua. Apuna käytetään kaaviokuvaa, johon on numeroitu vaiheet 1-4:
1. vaihe: Jäätä lämmitetään sulamispisteeseen
[[$ c_{jää} = 2,1 \, \dfrac{kJ}{kg \, °C} $]]
[[$ m = $]] 3,6 kg
[[$ \Delta t = $]] 15 °C
[[$ E_1 = c \cdot m \cdot \Delta t = 2,1 \dfrac{kJ}{kg \, °C} \cdot 3,6 \, kg \cdot 15 \, °C = 113,4 \, kJ $]]
2. vaihe: Jää sulaa 0°C vedeksi
[[$ s = 333 \dfrac{kJ}{kg} $]]
[[$ m = $]] 3,6 kg
[[$ E_2 = s \cdot m = 333 \, \dfrac{kJ}{kg} \cdot 3,6 \, kg = 1198,8 \, kJ $]]
3. vaihe: Vesi lämmitetään kiehumispisteeseen
[[$ c_{vesi} = 4,2 \, \dfrac{kJ}{kg \, °C} $]]
[[$ m = $]] 3,6 kg
[[$ \Delta t = $]] 100 °C
[[$ E_3 = c \cdot m \cdot \Delta t = 4,2 \dfrac{kJ}{kg \, °C} \cdot 3,6 \, kg \cdot 100 \, °C = 1512 \, kJ $]]
4. vaihe: Kiehuva vesi höyrystetään
[[$ r = 2160 \, \dfrac{kJ}{kg} $]]
[[$ m = $]] 3,6 kg
[[$ E_4 = r \cdot m = 2160 \, \dfrac{kJ}{kg} \cdot 3,6 \, kg = 7776 \, kJ $]]
Energiaa tarvitaan kaiken kaikkiaan
[[$ E_{kok} = E_1 + E_2 + E_3 + E_4 $]]
[[$ = 113,4 \, kJ + 1198,8 \, kJ + 1512 \, kJ + 7776 \, kJ = 10600,2 \, kJ \approx 11 \, MJ $]]
Tiivistelmä - Olomuodon muutoksissa sitoutuu tai vapautuu energiaa

Vesi esiintyy luonnossa kaikissa kolmessa olomuodossa, kiinteänä jäänä, nestemäisenä vetenä ja kaasumaisena vesihöyrynä. Suomen leveysasteilla veden kaikki olomuodot ovat nähtävissä eri vuodenaikoina. Vesistöt jäätyvät talveksi ja sulavat keväällä. Jään sulattamiseen ja veden lämmittämiseen tarvitaan paljon energiaa. Loppusyksystä vesistöjen läheisyydessä on ympäröivää seutua lämpimämpää, koska veteen on kesän aikana sitoutunut lämpöenergiaa. Keväällä tilanne on päinvastainen, koska jään sulattamiseen tarvitaan paljon energiaa.