Neutraloituminen
Etikan titraus
Neutraloiminen kpl 21
Neutraloituminen:
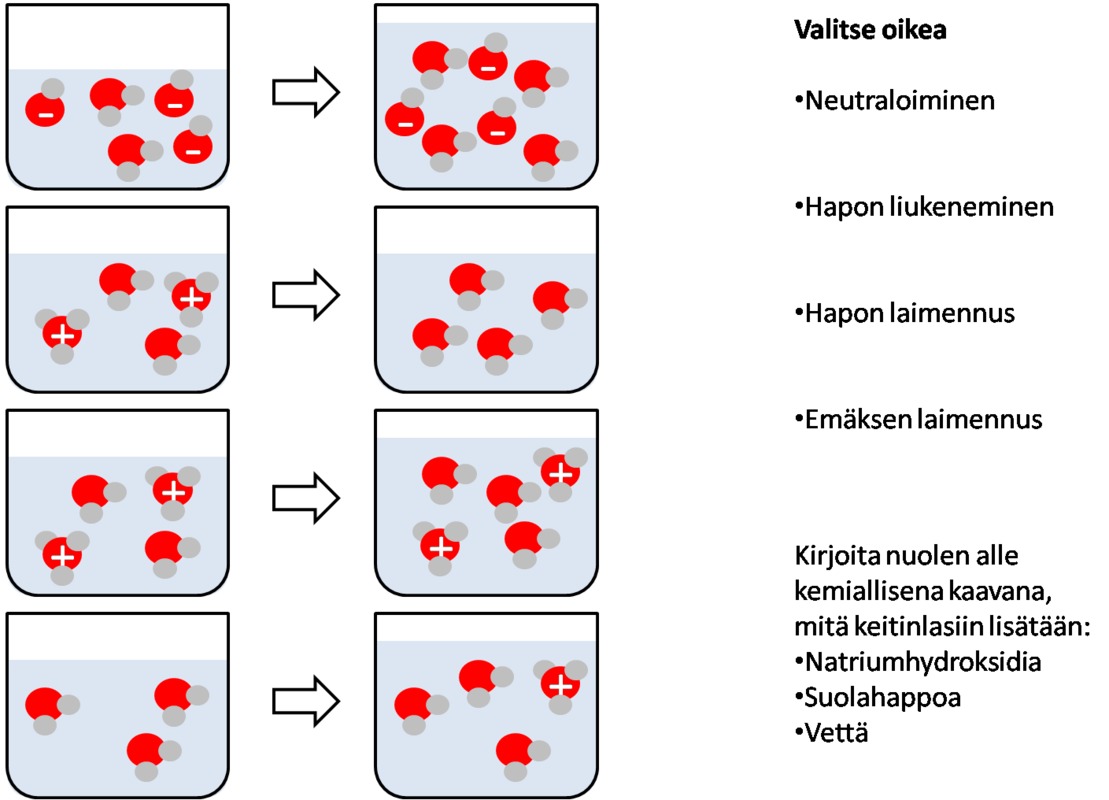
Happamassa liuoksessa on oksoniumioneita H3O+ ja emäksisessä hydroksidi-ioneita OH-
Jos nämä yhdistetään, tapahtuu neutraloitumisreaktio H3O+ + OH- ---> 2 H2O
Reaktiotuotteena on vettä.
Jos happona käytetään esim. suolahappoa HCl, jäljelle jää kloridi-ioneita.
Jos emäksenä käytetään esim. kaliumhydroksidia, jäljelle jää kaliumioneita.
Puskuriliuos:
Puskuriliuoksen pH on usein noin 7 tai melko lähellä sitä.
Tarkoittaa sellaista liuosta, joka vastustaa pH:n muutoksia.
Jos lisäät puskuriliuokseen happoa, sen pH ei laske kuten puhtaalla vedellä.
Jos lisäät puskuriliuokseen emästä, sen pH ei nouse kuten puhtaalla vedellä.
Jos happoa tai emästä lisätään liikaa, puskurivaikutus loppuu ja pH muuttuu.
Puskuriliuos on heikon emäksen ja heikon hapon sekoitus.
Vain pieni osa heikosta emäksestä ja haposta tuottavat veteen oksonium- ja hydroksidi-ioneita,
joiden määrä ratkaisee pH:n. Loput haposta ja emäksestä toimivat tällöin varastona eli puskurina.
Jos happoa lisätään, emästä neutraloituu. Jos emästä lisätään, happoa neutraloituu.
Neutraloitunut osuus korvautuu tuosta varastosta.
Titraustyö, kolme vaihetta. 1 Titraus, 2 Suodatus, 3 Haihdutus
Hapanta liuosta voidaan neutraloida emäksellä tai emäksistä liuosta hapolla.
Kun neutralointi tehdään tarkasti niin, että neutraloitavaa ei jää eikä kemikaaliylimäärää jää, puhutaan titrauksesta.
Vaihe 1 titraus
Kirjaa ylös pH reagensseille ja titratulle nesteelle.
Ensi kerralla puskuriliuoksen tutkiminen, jos sopii aikatauluun...
Tuntitehtävä, jos titraustyöstä jää aikaa.
Vastaukset:
https://peda.net/mikkeli/perusopetus/urheilupuisto/oppiaineet/kemia/havi-8lk/vastauksia
Happamassa liuoksessa on oksoniumioneita H3O+ ja emäksisessä hydroksidi-ioneita OH-
Jos nämä yhdistetään, tapahtuu neutraloitumisreaktio H3O+ + OH- ---> 2 H2O
Reaktiotuotteena on vettä.
Jos happona käytetään esim. suolahappoa HCl, jäljelle jää kloridi-ioneita.
Jos emäksenä käytetään esim. kaliumhydroksidia, jäljelle jää kaliumioneita.
Puskuriliuos:
Puskuriliuoksen pH on usein noin 7 tai melko lähellä sitä.
Tarkoittaa sellaista liuosta, joka vastustaa pH:n muutoksia.
Jos lisäät puskuriliuokseen happoa, sen pH ei laske kuten puhtaalla vedellä.
Jos lisäät puskuriliuokseen emästä, sen pH ei nouse kuten puhtaalla vedellä.
Jos happoa tai emästä lisätään liikaa, puskurivaikutus loppuu ja pH muuttuu.
Puskuriliuos on heikon emäksen ja heikon hapon sekoitus.
Vain pieni osa heikosta emäksestä ja haposta tuottavat veteen oksonium- ja hydroksidi-ioneita,
joiden määrä ratkaisee pH:n. Loput haposta ja emäksestä toimivat tällöin varastona eli puskurina.
Jos happoa lisätään, emästä neutraloituu. Jos emästä lisätään, happoa neutraloituu.
Neutraloitunut osuus korvautuu tuosta varastosta.
Titraustyö, kolme vaihetta. 1 Titraus, 2 Suodatus, 3 Haihdutus
Hapanta liuosta voidaan neutraloida emäksellä tai emäksistä liuosta hapolla.
Kun neutralointi tehdään tarkasti niin, että neutraloitavaa ei jää eikä kemikaaliylimäärää jää, puhutaan titrauksesta.
| Vaihe 1 Välineet: Mittalasi tai koeputki, Keittopullo, petrimalja, pH-paperia Reagenssit: Suolahappo, Natriumhydroksidi, Indikaattori: BTS |
Vaihe 2 Välineet: Suppilo, suodatinpaperi, haihdutusmalja Reagenssi: Aktiivihiilijauhe |
Vaihe 3 Välineet: Kolmijalka, kuumennusverkko kaasupoltin |
- Mittaa 10 ml mittalasillinen tai yksi koeputkellinen suolahappoa keittopulloon
- Tutki pH esim tiputtamalla tippa petrimaljalle - vertaa kirjan sivun 126 asteikkoon
- Lisää 5 pisaraa indikaattoria ja tarkista väri - vertaa kirjan sivun 125 taulukkoon
- Titraa eli lisää hitaasti pisaroittain NaOH:ia samalla sekoittaen kunnes väri on vihreä
- Jos menee siniseksi, lisää pisara happoa
- Tutki pH
- Opettaja lisää aktiivihiiltä keittopulloon
- Taittele suppiloon paperi
- Suodata varovasti suppilon läpi haihdutusmaljaan
- Varmista, että liuos on kirkasta
- Sytytä kaasupoltin
- Kuumenna kunnes neste on poistunut
- Tutki ja dokumentoi jäänteet
Kirjaa ylös pH reagensseille ja titratulle nesteelle.
Ensi kerralla puskuriliuoksen tutkiminen, jos sopii aikatauluun...
Tuntitehtävä, jos titraustyöstä jää aikaa.

Vastaukset:
https://peda.net/mikkeli/perusopetus/urheilupuisto/oppiaineet/kemia/havi-8lk/vastauksia
