Tuntemattoman molekyylin määrittäminen
Miksi määrittelemme empiirisen, molekyyli- ja rakennekaavoja?
Uuden molekyyli tai tunnistamattoman molekyylin määrittäminen etenee vaiheittain. Tässä vaiheessa ei puututa siihen, miten molekyyli eristetään seoksesta, jossa se mitä todennäköisimmin on. Erotusmenetelmänä käytetään usein uuttamista, sillä erilaiset molekyylit liukenevat eri liuottimiin eri lailla, ja/tai kromatografiaa. Kromatografialla voidaan määrittää myös ko. aineen pitoisuuksia suhteessa seoksen muihin aineisiin.
Esimerkiksi jos saadaan tulokseksi, että yhdisteen empiirinen kaava on CH3, aineen täytyy olla etaani, CH3CH3. Jos taas tulos on, että empiirinen kaava on CH2, mahdollisuuksia onkin enemmän kuin yksi. Esim. eteeni CH2=CH2, 1-buteeni CH2=CHCH2CH3, syklobutaani ... jne. Eli tässä tapauksessa empiirinen kaava ei enää määrittelekään yksiselitteisesti molekyyliä. Tarvitaan lisää tietoa.
Nyt esimerkkinä CH2-yhdisteen (empiirinen kaava) molekyylin määrittäminen, jos tiedossa olisi tutkittavan molekyylin moolimassa. Viereisestä massaspektristä huomataan, että molekyylimassa ko. molekyylille on 70, eli siinä täytyy olla 5 kpl C-atomia ja 10 kpl H-atomia (5 x 12 + 10 x 1 = 70 g/mol). Kyseessä voisi olla esim. kuvan penteeni.

Massaspektrien tulkintaa erikoistunut pystyisi päättelemään jo tästä, että kyse on 2-penteenistä. Käytännössä työn tekevät tietokoneet, mutta koska tämä saattaa olla mahdotonta, tarvitaan lisää informaatiota.
Spektroskopian lajeja on siis useampia, joita käytetään tuntemattomien molekyylien tunnistamissa rinnakkain siten, että ne tukevat toisiaan. kokonaisuuden hahmottamisessa.
Empiirisen kaavan määrittäminen
Esimerkiksi polttoanalyysillä määritetään empiirinen kaava – näin saadaan selville eri alkuaineiden väliset suhteet.Esimerkiksi jos saadaan tulokseksi, että yhdisteen empiirinen kaava on CH3, aineen täytyy olla etaani, CH3CH3. Jos taas tulos on, että empiirinen kaava on CH2, mahdollisuuksia onkin enemmän kuin yksi. Esim. eteeni CH2=CH2, 1-buteeni CH2=CHCH2CH3, syklobutaani ... jne. Eli tässä tapauksessa empiirinen kaava ei enää määrittelekään yksiselitteisesti molekyyliä. Tarvitaan lisää tietoa.
Molekyylikaavan määrittäminen
Kun empiirisen kaavan informaatio ei riitä, täytyy selvittää molekyylin molekyylikaava. Tähän tehtävään tarvitaan tieto yhdisteen moolimassasta. Moolimassan kertoo esim. massapektri, joka antaa yleensä tutkittavan molekyylin moolimassan (molekyylimassan). Joissakin laskutehtävissä moolimassa voidaan määrittää kaasujen yleisen tilayhtälön avulla. Kyseistä yhtälöä voidaan käyttää, jos on tiedossa paine, tilavuus ja esim. massa (paineen, tilavuuden ja ainemäärän keskinäinen riippuvuus).Nyt esimerkkinä CH2-yhdisteen (empiirinen kaava) molekyylin määrittäminen, jos tiedossa olisi tutkittavan molekyylin moolimassa. Viereisestä massaspektristä huomataan, että molekyylimassa ko. molekyylille on 70, eli siinä täytyy olla 5 kpl C-atomia ja 10 kpl H-atomia (5 x 12 + 10 x 1 = 70 g/mol). Kyseessä voisi olla esim. kuvan penteeni.

Massaspektrien tulkintaa erikoistunut pystyisi päättelemään jo tästä, että kyse on 2-penteenistä. Käytännössä työn tekevät tietokoneet, mutta koska tämä saattaa olla mahdotonta, tarvitaan lisää informaatiota.
IR-spektrien vertailu
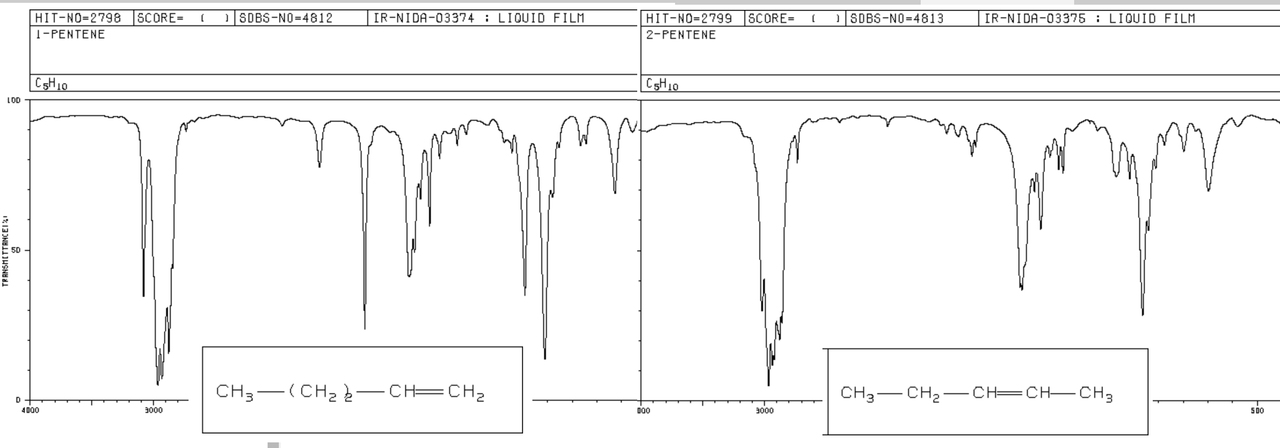
Jos molekyylikaava ei anna lopullista vastausta, tarvitaan rakenteeseen liittyvää informaatiota, kuten esim. IR-spektriä. Kokeilaan ensin tunnistusreaktioita, jotka kertoisivat mahdollisista funktionaalisista ryhmistä. Tässä tapauksessa kyse oli penteenistä, joten alkeenien tunnistusreaktioilla voitaisiin varmistaa, että kyse on alkeenista eikä esim. syklopentaanista. Sykloalkaanien molekyylikaava on myös yleistä muotoa (CH2)n. Tunnistusreaktio ei kuitenkaan kerro, että olisi kyseessä 1-penteeni, 2-penteeni tai 3-penteeni. Se selviää, kun tutkittavasti aineesta ajetaan IR-spektri. Analysoidaan seuraavaksi alla olevaa kuvaa, jossa 1-penteenin ja 2-penteenin IR-spektrit ovat vierekkäin.
Spektroskopian lajeja on siis useampia, joita käytetään tuntemattomien molekyylien tunnistamissa rinnakkain siten, että ne tukevat toisiaan. kokonaisuuden hahmottamisessa.