Erilaiset mallit
Erilaiset rakennemallit
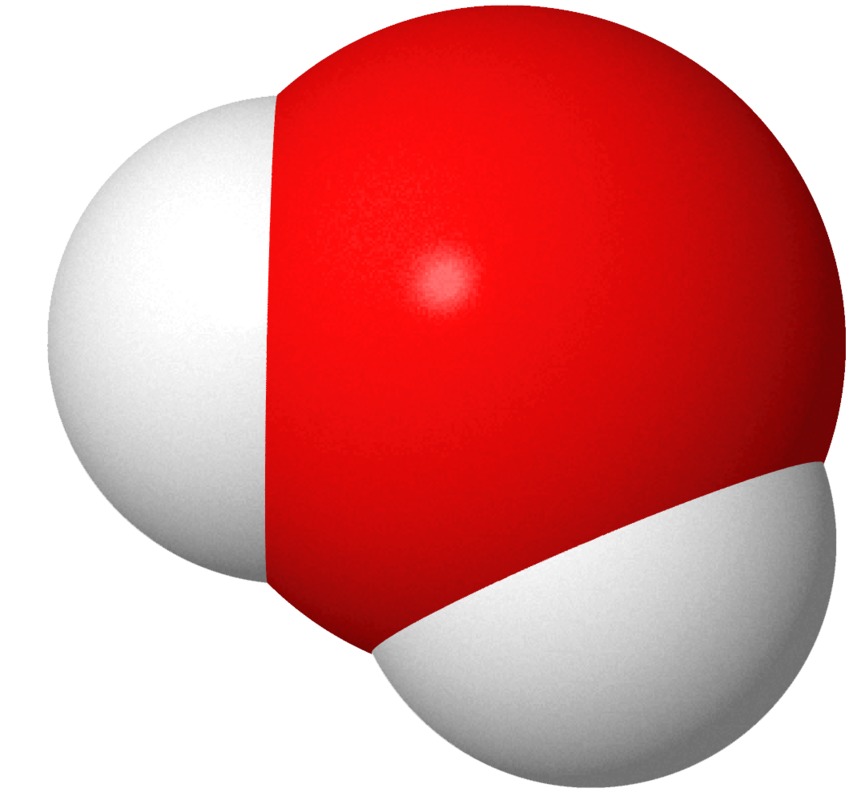 Kalottimallissa atomit ja niiden paikat kuvataan toisiinsa upotettujen eriväristen pallojen avulla. Atomit esitetään eri väreillä, jotta ne voitaisiin tunnistaa helpommin. Todellisuudessa atomit eivät ole minkään värisiä. Eri alkuaineen atomit kuvataan erikokoisilla palloilla. Pallon koko perustuu laskennalliseen kemiaan.
Kalottimallissa atomit ja niiden paikat kuvataan toisiinsa upotettujen eriväristen pallojen avulla. Atomit esitetään eri väreillä, jotta ne voitaisiin tunnistaa helpommin. Todellisuudessa atomit eivät ole minkään värisiä. Eri alkuaineen atomit kuvataan erikokoisilla palloilla. Pallon koko perustuu laskennalliseen kemiaan.
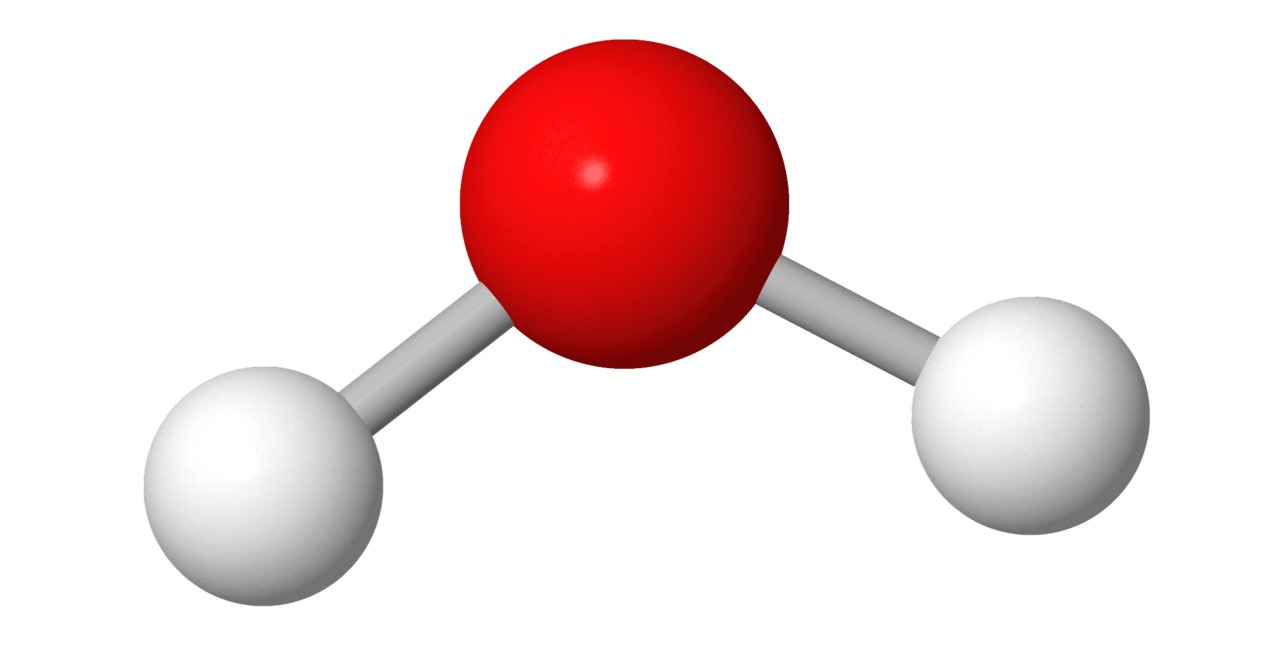
Pallotikkumallissa pallot ovat samankokoisia kuin kalottimallissa, mutta atomien välinen etäisyys on suurempi. Atomeja yhdistävä viiva kuvaa atomien välistä sähköistä vuorovaikutusta eli sidosta. Sidosviivojen suunta, pituus ja niiden väliset kulmat perustuvat laskennalliseen kemiaan. Pallotikkumalli näyttää molekyylin kolmiulotteisen rakenteen kalottimallia selkeämmin.
Rakennekaava ilmoittaa molekyylissä olevien atomien laadun ja määrän, atomeja yhdistävien sidosten laadun ja rakenteen geometrian. Atomit merkitään niiden kemiallisilla merkeillä ja atomien väliset sidokset sidosviivoilla. Sidosviivojen väliset kulmat voivat olla todelliset tai piirrosteknisistä syistä yksinkertaistettuja ja suurpiirteisiä.
Tiivistetty rakennekaava ilmoittaa molekyylin rakenteen samalla tarkkuudella kuin rakennekaava, mutta jotkin sidosviivoista jätetään merkitsemättä. Esimerkiksi etanoli merkitään CH3 – CH2 – OH tai vielä lyhyemmin CH3CH2OH.
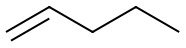
Viivakaava on rakennekaavamallien yksinkertaistetuin esitysmuoto. Hiili- ja vetyatomien symbolit jätetään merkitsemättä. Hiiliatomit sijaitsevat viivan päissä, kulmissa ja haarautumiskohdissa. Jokainen tällainen kohta käsittää myös sen verran vetyatomeja, joita kyseiseen hiileen voi enintään liittyä. Hiilivetyketjuun liittyneet vierasatomit ja toiminnalliset ryhmät merkitään näkyviin niitä vastaavilla kemiallisilla merkeillä, samoin muihin kuin hiiliatomiin sitoutuneet vetyatomit merkitään näkyviin.
Kolmiulotteinen rakennekaava on rakennekaavan visuaalisempi muoto. Se kuvaa atomien keskinäiset paikat pallotikku- tai kalottimallia vastaavalla tavalla. Kolmiulotteista rakennekaavaa käytetään erityisesti silloin, kun rakennekaavassa halutaan korostaa yhdisteen geometriaa. Tällä on erityinen merkitys rakenne- eli konstituutioisomeriassa ja avaruus- eli stereoisomeriassa.
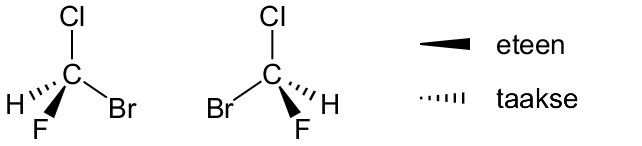
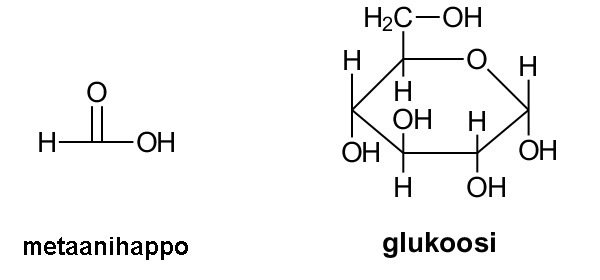
Suhdekaava ilmoittaa yhdisteen alkuaineiden lukumäärien suhteen. Esimerkiksi ruokasuolan suhdekaava on NaCl, mikä tarkoittaa sitä, että natriumia ja vetyä on yhdisteessä suhteessa 1:1. Glukoosissa C6H12O6 hiiltä, vetyä ja happea on suhteessa 1:2:1, joten sen suhdekaava on (CH2O)6. Toisinaan suhdekaava on sama kuin yhdisteen molekyylikaava. Esimerkiksi veden kaava H2O on samalla sekä suhdekaava että molekyylikaava. Suhdekaavasta käytetään myös nimitystä bruttokaava.
Yhdisteen suhdekaavan alaindeksit tarkoittavat yhdessä molekyylissä tai kaavayksikössä olevien atomien lukumääriä. Niillä voidaan tarkoittaa myös yhdessä yhdistemoolissa olevien alkuaineiden ainemäärien suhteita, joiden perusteella voidaan määrittää alkuaineiden massasuhteet ja massaprosenttiset osuudet. Esimerkiksi glukoosilla ja formaldehydillä on sama suhdekaava CH2O tai (CH2O)x.
Empiirinen kaava tarkoittaa samaa kuin suhdekaava, mutta korostaa sitä, että yhdisteen kemiallinen koostumus on määritetty kokeellisesti. Mittausten perusteella tiedetään alkuaineiden laatu ja niiden suhteellinen määrä, muttei atomien paikkoja tai sidostyyppejä. Esimerkiksi etaanin C2H6 empiirinen kaava on CH3 tai tarkemmin (CH3)x. Kun x:n arvo saadaan selville, voidaan ratkaista yhdisteen tarkka suhde-, molekyyli- ja rakennekaava.
Molekyylikaava ilmoittaa yhdisteen sisältämien alkuaineiden atomien lajit ja todelliset lukumäärät sekä mahdollisesti myös toiminnallisen ryhmän. Esimerkiksi etanolin molekyylikaava on C2H5OH, joka korostaa molekyylissä olevan OH-ryhmä. Glukoosin molekyylikaava on C6H12O6, mutta tämä ei kerro, että yhdisteessä on monta OH-ryhmää.
Ionikaava ilmoittaa hiukkasen varauksen. Yksittäisen atomit, atomiryhmät ja molekyylit voivat esiintyä varauksellisina ioneina. Esimerkiksi vesimolekyylin kaava on H2O, mutta ionisoituessa siitä muodostuu joko oksoniumioni H3O+ tai hydroksidi-ioni OH–.
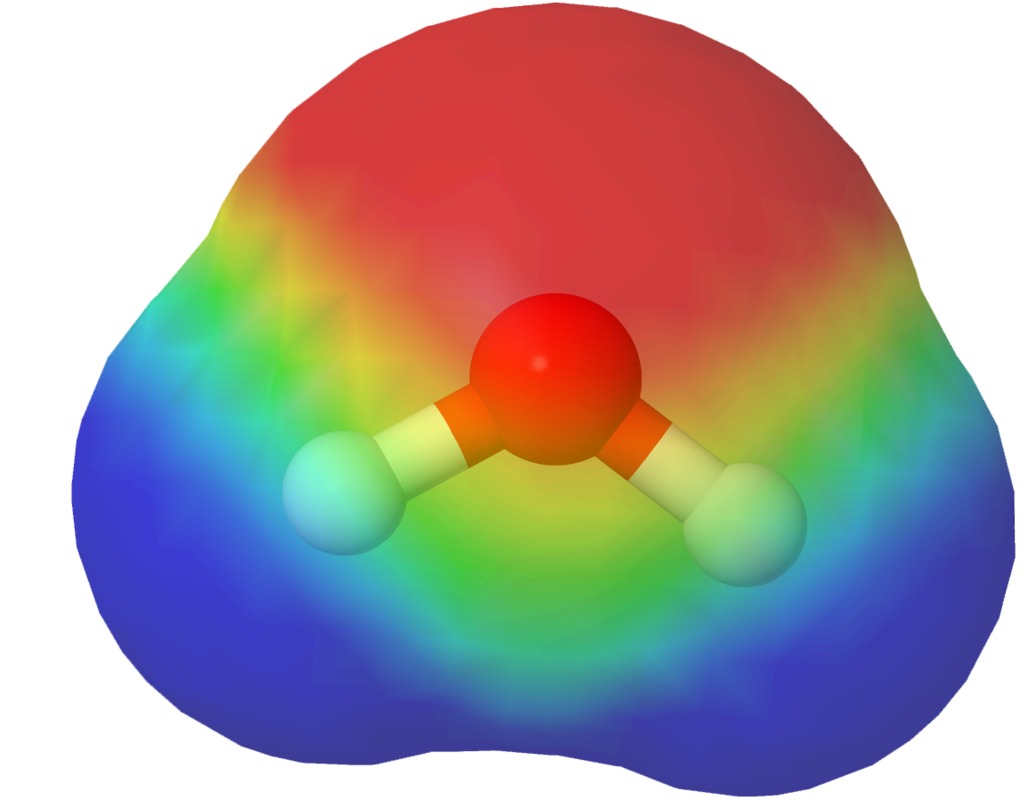 Varausjakaumamalli havainnollistaa sähkövarausten jakautumisen molekyylin eri osissa. Varausjakaumamallit perustuvat laskennalliseen kemiaan.
Varausjakaumamalli havainnollistaa sähkövarausten jakautumisen molekyylin eri osissa. Varausjakaumamallit perustuvat laskennalliseen kemiaan.
Mikä malli valitaan?
Tilanne ratkaisee, mikä malli on tarkoituksenmukaisin. Oikean mallin valitseminen on kemistin ammattitaitoa. Mikään malli ei vastaa täysin todellisuutta, koska molekyylin muoto muuttuu lämpövärähtelyn vuoksi.