5. MOLEKYYLIEN AVARUUDELLINEN RAKENNE - 3D
Orbitaaliteorian kehittäminen
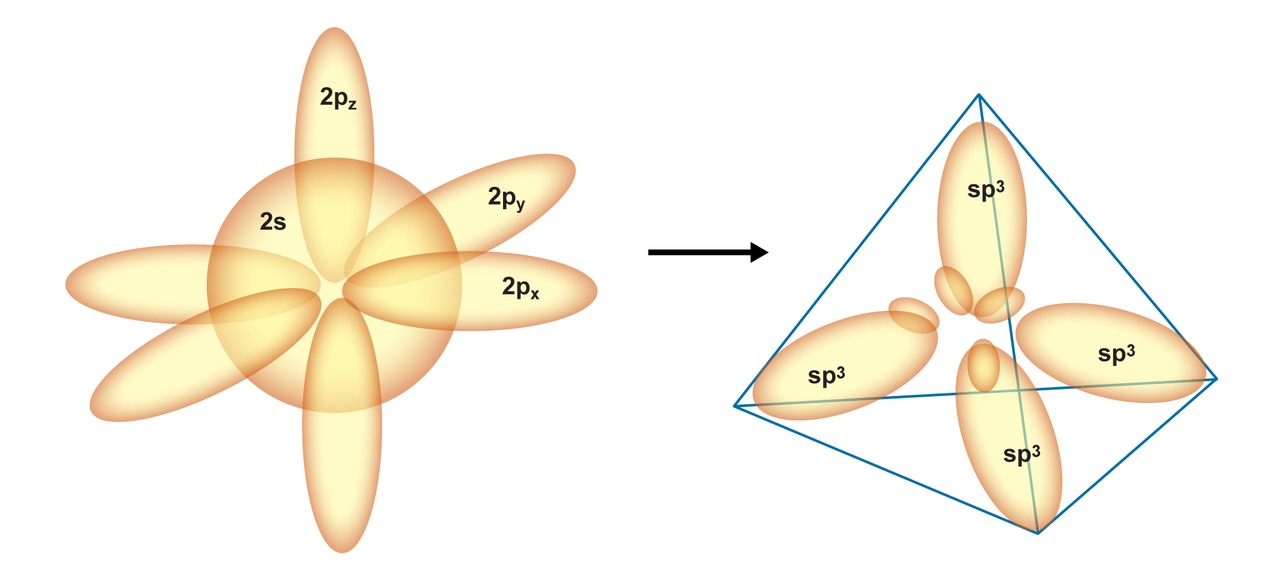
Molekyylien sidosmalleja kehitettäessä oltiin havaittu ongelma teoreettisen mallin ja käytännön havaintojen välillä. Orbitaaliteorian perusteella tiedettiin, että hiiliatomilla on uloimman energiatasollaan neljä elektronia. Näistä kaksi on s-orbitaalilla ja toiset kaksi p-orbitaalilla (2s22p2). Ongelmia herätti kuitenkin se, ettei tällaisella mallilla voitu selittää esimerkiksimetaanimolekyylin sidoksia. Atomiorbitaaliteorian perusteella metaanissa olisi pitänyt olla kahta eri sidostyyppiä, osa sidoksista muodostuisi s-orbitaalien yhteensulautuessa vetyatomien s-orbitaalien kanssa ja osa p-orbitaalien yhteensulautuessa vetyatomien s-orbitaalien kanssa. Tutkimuksissa oli kuitenkin havaittu, että metaanimolekyylissä hiilen ja vetyjen välillä oli neljä keskenään samanlaista sidosta.
Pauling tarjosi selitysmallina atomiorbitaalien hybridisaatiota. Sen mukaan hiilen s- ja p-orbitaalit muuntuivat sidoksen muodostumisessa keskenään samanlaisiksi, atomirobitaaleista poikkeaviksi sp3-hybridiorbitaaleiksi. Hybridiorbitaalien energia on suurempi kuin s-orbitaalin, mutta pienempi kuin p-orbitaalien energia.

Perustilassa olevan ja hybridisoituneen hiiliatomin energiatasot.