4. Hapot ja emäkset
1. Virittäytyminen – hapot ja emäkset kotona
2. Aine voi olla hapan, emäksinen tai neutraali
Maaperässä, vesistöissä ja ihmiskehossa on monia happoja, emäksiä ja neutraaleja aineita. Monet ruoka-aineet ovat happamia. Ne tunnistaa helposti happamasta mausta. Emäksisiä ruokia on vähän, koska niiden metallimaista makua pidetään vieraana. Selvästi emäksisiä ruoka-aineita ovat lipeäkala ja kananmunan valkuainen.
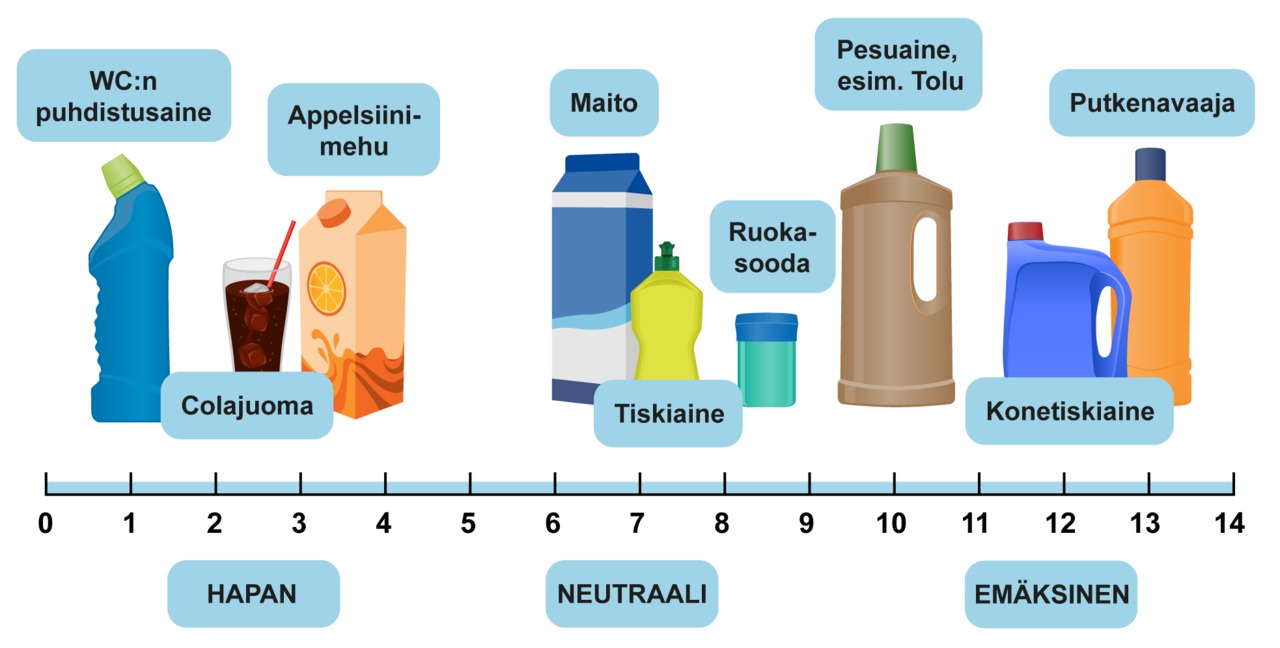
Pesuaineiden happamuus vaihtelee happamasta emäksiseen. Paljaan ihon kanssa kosketuksissa olevat pesuaineet ovat yleensä hieman happamia tai neutraaleja. Konepesuaineet ovat vahvasti emäksisiä. WC:n puhdistusaine on vahvasti hapanta.
Neutraalissa aineessa happamuutta aiheuttavia oksoniumioneja ja emäksisyyttä aiheuttavia hydroksidi-ioneja on lukumääräisesti yhtä paljon tai ne puuttuvat siitä kokonaan. Neutraaleja aineita on paljon. Puhdas vesi on neutraalia, samoin kuin suolainen vesi. Ruokasuola ei vaikuta veden happamuuteen. Voit tutkia neutraalin liuoksen ominaisuuksia oheisella simulaatiolla.
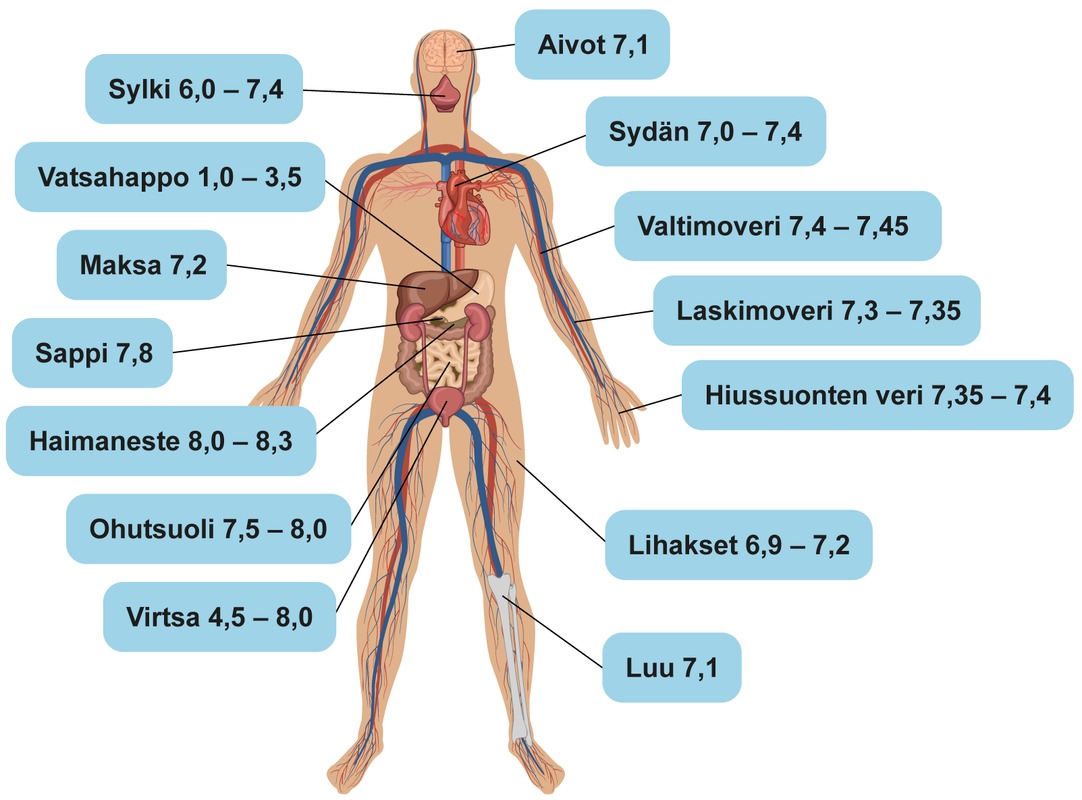
3. Ihmiskehon happamuus
4. Hapot ja emäkset luokitellaan vahvoiksi ja heikoiksi
Hapot luokitellaan vahvoiksi ja heikoiksi hapoiksi. Vahva happo reagoi niin, että lähes jokainen happomolekyyli luovuttaa vetyionin. Vahvoja happoja ovat esimerkiksi suolahappo, typpihappo ja rikkihappo. Heikko happo reagoi niin, että vain vähäinen osa happomolekyyleistä luovuttaa vetyionin. Esimerkiksi karboksyylihapot ovat heikkoja happoja.
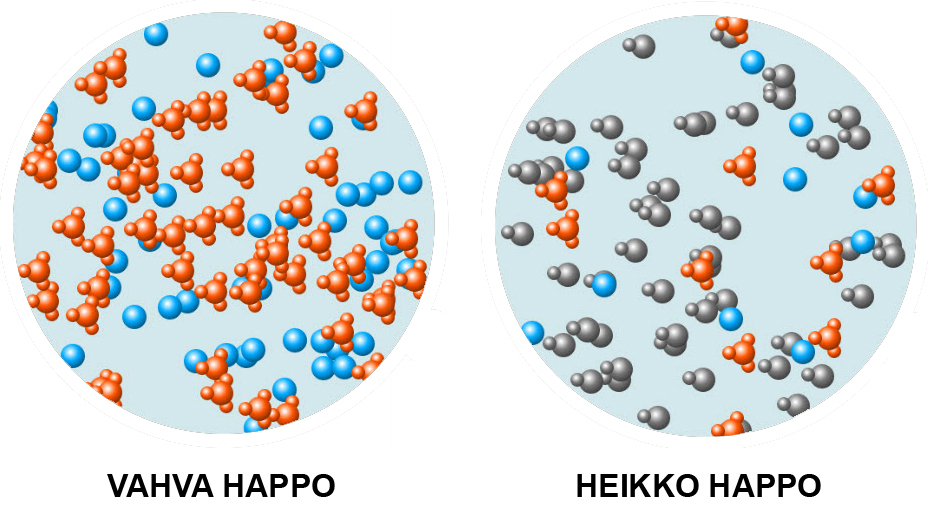
Heikossa hapossa vain pieni osa harmaista happo-molekyyleistä on luovuttanut protonin.
 Samoin emäkset jaotellaan vahvoiksi ja heikoiksi emäksiksi. Vahva emäs reagoi niin, että lähes jokainen emäsmolekyyli vastaanottaa vetyionin. Vahvoja emäksiä ovat esimerkiksi hydroksidi-ioni (OH-) ja sulfidi-ioni (S2-).
Samoin emäkset jaotellaan vahvoiksi ja heikoiksi emäksiksi. Vahva emäs reagoi niin, että lähes jokainen emäsmolekyyli vastaanottaa vetyionin. Vahvoja emäksiä ovat esimerkiksi hydroksidi-ioni (OH-) ja sulfidi-ioni (S2-).
Ne esiintyvät yhdisteissä, kuten litiumhydroksidissa, natriumhydroksidissa ja natriumsulfidissa. Heikko emäs reagoi niin, että vain vähäinen osa emäsmolekyyleistä vastaanottaa vetyionin. Esimerkiksi ammoniakki on heikko emäs.
5. Happamuus todetaan indikaattorilla
Indikaattorit ovat väriaineita, joita käytetään liuoksen happamuuden toteamiseen. Indikaattorit ovat erivärisiä happamassa, neutraalissa ja emäksisessä liuoksessa. Indikaattoreiden värit tunnetaan, joten niiden avulla voidaan päätellä liuoksen happamuus. Jokaisella indikaattorilla on sille tunnusomainen happamuusalue, jossa se vaihtaa väriään. Niitä nimitetään happo-emäsindikaattoreiksi.

Yleisindikaattorit ovat aineita, joissa on sekoitettuna kahta tai usempaa happo-emäsindikaattoria. Jokainen indikaattoreista vaihtaa väriään omalla happamuusalueella. Yleisindikaattoriliuoksen väri muuttuu liukuvasti yhdestä toiseen, jolloin happamuuden muutoksia voidaan seurata laajemmin kuin yksittäistä indikaattoria käytettäessä.

Indikaattoreita käytetään yleensä liuoksina tai paperiliuskoihin imeytettynä. Tutkittavaan liuokseen lisätään pieni määrä indikaattoriliuosta. Happo-emäsreaktioiden edetessä liuoksen väri muuttuu. Indikaattoripaperi kastetaan tutkittavaan liuokseen. Liuoksessa oleva happo tai emäs reagoi paperissa olevan indikaattorimolekyylin kanssa, jolloin paperin väri muuttuu.

Indikaattoriliuos.

PH-paperia.
Indikaattoreina toimivia aineita voidaan valmistaa laboratoriossa, mutta niitä esiintyy myös luonnossa. Punakaalista ja orvokista saadaan yleisindikaattoriliuosta ja kurkumasta happo-emäsindikaattoriliuosta.
 Punakaali-indikaattori on punainen happamassa, sininen emäksisessä ja violetti neutraalissa ympäristössä.
Punakaali-indikaattori on punainen happamassa, sininen emäksisessä ja violetti neutraalissa ympäristössä.
Video luonnonindikaattorien värinmuutoksista.
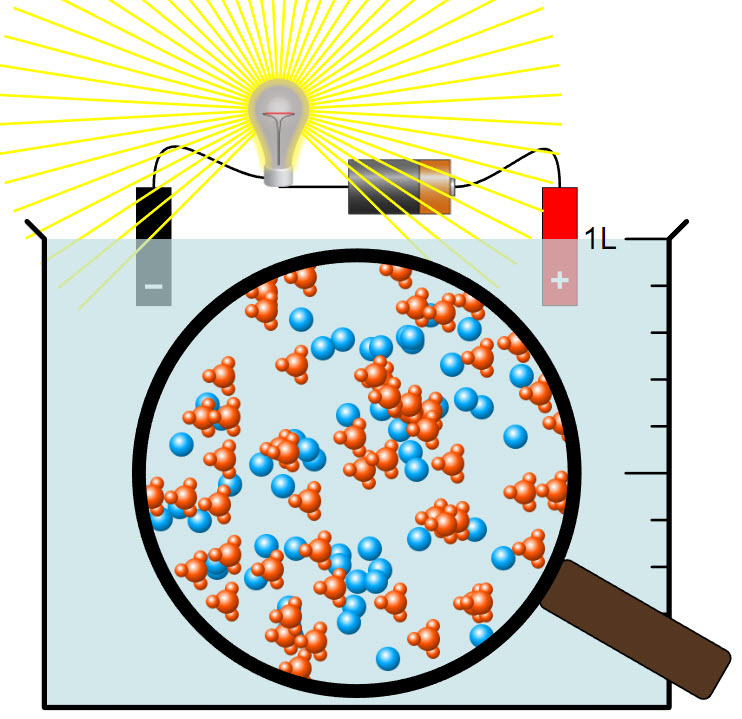
6. Happo- ja emäsliuokset johtavat sähköä
7. Happamuus ilmaistaan pH-luvulla
Vesiliuoksen happamuus ilmaistaan pH-luvulla. Se määräytyy vedessä olevien oksoniumionien määrän perusteella. Mitä pienempi pH luku on, sitä enemmän liuoksessa on oksoniumioneja (H3O+) ja sitä happamampi se on. Mitä suurempi pH luku on, sitä vähemmän liuoksessa on oksoniumioneja.
Neutraalin liuoksen pH on täsmälleen seitsemän. Happaman liuoksen pH on alle seitsemän ja emäksisen liuoksen pH on yli seitsemän.
- pH < 7 hapan
- pH = 7 neutraali
- pH > 7 emäksinen
Liuoksen happamuutta mitataan indikaattoriliuoksella, pH-paperilla ja pH-mittarilla. Indikaattoriliuos on epätarkin ja pH-mittari tarkin.

Huomaa, että saippua voi olla myös emäksistä (vertaa alta taulukosta).
Hyvin happamat tai emäksiset liuokset ovat vaarallisen syövyttäviä. Alta taulukosta näet joidenkin tuttujen aineiden pH-arvoja.
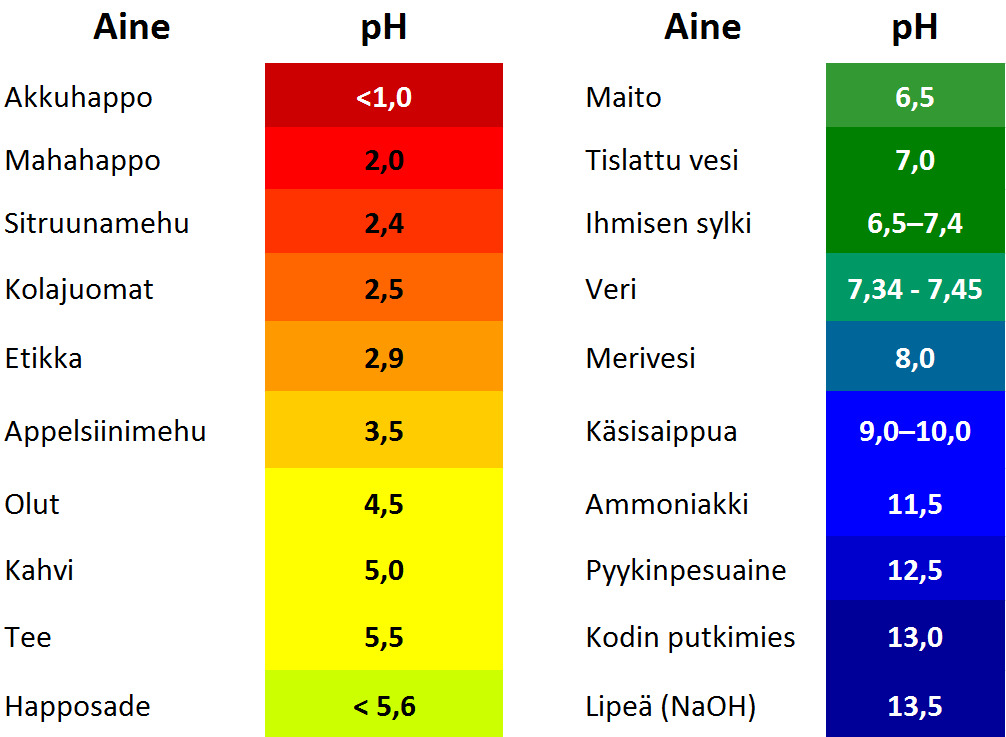
Simuloi eri aineiden pH-arvoja
8. Happosade vahingoittaa luontoa ja rakennuksia
Sadeveden pH on hieman alle 6. Sadevesi happamoituu, koska ilmakehästä liukenee sadeveteen hiilidioksidia. Hiilidioksidi reagoi veden kanssa, jolloin muodostaa hiilihappoa. Teollisuuden ja liikenteen päästöt tuottavat ympäristöön rikin ja typen oksideja. Ne liukenevat sadeveteen ja happamoittavat sadevettä entisestään. Happosateeksi tai happamaksi sateeksi nimitetään sadevettä, jonka pH on alle 5,6.

Erityisen arkoja happosateelle ovat kasvit, sillä hapot liuottavat niitä suojaavan pinnan pois.
Soittolistassa on kaksi videota. Ensimmäisessä muutetaan veden pH:ta puhaltamalla. Muutoksen saa aikaan ihmisen hengityksessä oleva hiilidioksidi. Toisessa videossa rakennetaan hiilidioksidimolekyyli muovimalleilla.
9. Kuvagalleria: emäkset ja hapot ovat tärkeitä teollisuuden raaka-aineita
Tiivistelmä
- Aine voi olla hapan, emäksinen tai neutraali.
- Hapot luokitellaan vahvoiksi ja heikoiksi hapoiksi.
- Indikaattorit ovat väriaineita, joita käytetään liuoksen happamuuden toteamiseen.
- Happojen ja emästen liuetessa veteen muodostuu ioneja. Happojen ja emästen vesiliuokset johtavat sähköä.
- Happosateeksi tai happamaksi sateeksi nimitetään sadevettä, jonka pH on alle 5,6.