3.2 Monielektroniatomit
Energiatasot ja siirtymät monielektroniatomeissa
Vetyatomin ytimessä on yksi protoni ja ytimeen on sitoutunut yksi elektroni. Kun hiukkasia on vain kaksi, tilanne on yksinkertainen ja elektronin mahdolliset energiatilat saadaan ratkaistua Schrödingerin yhtälöstä. Muilla alkuaineilla on enemmän elektroneja, jolloin keskenään vuorovaikuttavia hiukkasia on kolme tai enemmän: ydin ja vähintään kaksi elektronia. Useamman varauksen vuorovaikutusta on hankalampi mallintaa, koska elektroniverhon elektronit vuorovaikuttavat myös keskenään. Schrödingerin yhtälöstä tulee monimutkainen, eikä sitä pystytä ratkaisemaan tarkasti. Atomien perustilojen energiat ovat kuitenkin mitattavissa ja muille tiloille voidaan ratkaista approksimaatiot.
Monielektroniatomeja tarkastellaan samalla tavalla kuin vetyatomia, vaikka monielektroniatomien energiatiloille ei ole yksinkertaista laskukaavaa. Atomi absorboi fotoneja, joiden energia [[$E_\text{fotoni}$]] on yhtä suuri kuin perustilan ja viritystilan välinen energiaero [[$\Delta E$]]. Atomi emittoi fotoneja, joiden energia on yhtä suuri kuin energiaero joltakin viritystilalta alemmalle viritystilalle tai perustilalle. Energiaero ja fotonin aallonpituus kytkeytyvät siis toisiinsa seuraavalla kaavalla.
[[$ \quad \Delta E=\dfrac{hc}{\lambda_\text{fotoni}}$]]
Tarkastelemalla aineen emissio- ja absorptiospektrejä voidaan laskea siirtymien energiat ja siten päätellä mahdolliset energiatilat. Niitä voidaan sitten vertailla erilaisiin Schrödingerin yhtälön approksimaatioihin. Mahdolliset energiatilat on kirjattu taulukoihin. Monipuolinen ja ilmainen lähde on esimerkiksi NIST (National Institute of Standards and Technology).
![]() Taulukoita alkuaineiden ominaisuuksista, mm. energiatilat (NIST eng.)
Taulukoita alkuaineiden ominaisuuksista, mm. energiatilat (NIST eng.)
Atomin monimutkaistuessa energiatilojen lukumäärä lisääntyy. Vaihtoehtoisia siirtymiä tilalta toiselle on enemmän ja spektriviivoja nähdään useampia kuin vedyllä. Alla on osa heliumin emissiospektriä:

Heliumin emissiospektrin kirkkaimman kellertävän viivan aallonpituus on noin 590 nm. Tämän perusteella tiedetään, että spektriviivan synnyttäneiden energiatilojen välinen energiaero on ollut
[[$ \quad \Delta E=E_\text{fotoni} \\
\quad E_{\text{fotoni}}=\dfrac{hc}{\lambda} \\
\quad E_{\text{fotoni}}=\dfrac{4,136\cdot 10^{-15} \textrm{ eVs}\cdot 2,998\cdot 10^8 \textrm{ m/s}}{590 \cdot 10^{-9} \textrm{ m}}\approx 2,1 \textrm{ eV} $]]
Ohessa on heliumin energiatasokaavio, jossa on joitakin heliumin energiatiloja. Keltaista valoa vastannut energia 2,1 eV on siirtymä kolmannelta viritystilalta ensimmäiselle viritystilalle. Siirtymä on merkitty kuvaan.

Heliumin perustilan ja viritystilojen välillä on suuri energia. Kun helium siirtyy perustilaan, emittoituu UV-säteilyä. Näkyvää valoa emittoituu viritystilan purkautuessa alempaan viritystilaan ennen lopullista purkautumista perustilaan.
Elektronin kvanttitilat monielektroniatomissa
Vedyn energiatilojen kuvaamiseen riitti yksi kvanttiluku, [[$n$]]. Elektronilla on kuitenkin muitakin tiloja kuin edellä määritetyt perus- ja viritystilat. Esimerkiksi joillekin energiatiloille saadaan Schrödingerin yhtälön ratkaisuna useita vaihtoehtoisia todennäköisyysjakauman muotoja eli orbitaaleja. Monielektroniatomeissa tällä on merkitystä. Wolfgang Paulin (1900-1958) mukaan nimetyn Paulin kieltosäännön mukaisesti kaksi elektronia ei voi olla täsmälleen samassa tilassa.
Elektronin tila muodostuu neljän kvanttiluvun kautta.
Pääkvanttiluku [[$n$]] määrää tilan energian. Pääkvanttiluku kuvaa myös, kuinka kaukana atomiytimestä elektroni keskimäärin sijaitsee. Mitä suurempi on pääkvanttiluku, sitä kauemmas todennäköisyysjakauma on keskittynyt. Pääkvanttiluku voi saada arvokseen mitä tahansa positiivisia kokonaislukuja (1, 2, 3, ...). Arvoille käytetään joskus myös tunnuksia K, L, M, N, ...
Sivukvanttiluku [[$\ell$]] kertoo orbitaalin muodon. Kuvissa atomiydin on keskellä. Atoimiytimen ympärille piirretään alue, jonka sisällä elektroni on 95 % todennäköisyydellä. Sininen ja punainen väri ovat kuvissa vain, jotta orbitaalien muodot hahmottuvat paremmin. Sivukvanttiluku voi saada arvokseen kokonaisluvun välillä [[$0\le \ell \le n-1$]]. Sivukvanttiluvun arvoille käytetään myös tunnuksia s, p, d, f, ...

Magneettinen kvanttiluku [[$m$]] kertoo orbitaalin asennon. Esimerkiksi p-orbitaaleja on kolme, koska yllä näkyvät p-orbitaalin pallukat voivat olla x-, y- tai z-suunnassa. Eri asentojen vaikutus kvanttitilan energiaan havaitaan atomin ollessa ulkoisessa magneettikentässä. Siksi asentoa kuvaavaa kvanttilukua kutsutaan magneettiseksi kvanttiluvuksi. Magneettikentän vaikutus energiatasoihin paljastuu siten, että aineen emissiospektrin spektriviivat jakaantuvat magneettikentässä useampiin lähekkäisiin spektriviivoihin. Magneettinen kvanttiluku voi saada kokonaislukuarvoja välillä [[$-\ell \dots \ell$]], eli vaihtoehtoisia asentoja on sitä enemmän, mitä monimutkaisemmasta muodosta on kyse.
Spinkvanttiluku [[$m_s$]] erottaa kaksi muuten samassa tilassa olevaa elektronia toisistaan. Spinkvanttiluku vaikuttaa elektronin käyttäytymiseen vastaavalla tavalla kuin makroskooppisen hiukkasen käyttäytymiseen vaikuttaa se, pyöriikö se itsensä ympäri myötä- vai vastapäivään. Spinkvanttiluvulla on kaksi arvoa, jotka merkitään +½ ja -½. Elektronin spiniä ei kuitenkaan pidä mieltää elektronin pyörimisliikkeeksi.
Elektronien asettuminen kvanttitiloille
Paulin kieltosäännön mukaisesti täsmälleen samalla kvanttitilalla voi olla vain yksi elektroni. Siten kahdella elektronilla täytyy vähintään yhden kvanttiluvuista [[$n, \ell, m, m_s$]] erota toisistaan.
Monielektroniatomissa elektronit asettuvat kvanttitiloille siten, että matalaenergisimmät tilat täyttyvät ensin. Jokaista pääkvanttiluvun määräämää energiatasoa vastaa tietty määrä sivukvanttiluvun mukaisia alatasoja. Ensimmäisen pääkvanttiluvun arvo on 1. Koska sivukvanttiluku on aina pienempi kuin pääkvanttiluku, on sen ainoa mahdollinen arvo 0. Myös magneettinen kvanttiluku saa tällöin arvon 0. Spinkvanttiluku voi saada kaksi arvoa (+1/2 tai -1/2), joten tasolle [[$n=1$]] mahtuu kaksi elektronia.
Pääkvanttiluvun kasvaessa muilla kvanttiluvuilla on useampia mahdollisia arvoja. Alla oleva kaavio kuvaa tilojen rakentumista tasolle [[$n=2$]] saakka. Huomataan, että yhdistelmiä on kahdeksan. Päätasolle 2 mahtuu kahdeksan elektronia.

Vety ja helium perustilassa
Vedyn ainoa elektroni on perustilassa päätasolla [[$n=1$]]. Tälle energiatasolle mahtuu kaksi elektronia spinkvanttiluvun erottamina. Heliumatomilla on kaksi elektronia, joten molemmat elektronit mahtuvat tasolle [[$n=1$]].
Litium ja beryllium perustilassa
Litiumilla on kolme elektronia, joten kolmas elektroni ei enää mahdu päätasolle [[$n=1$]]. Litiumin perustilalla kolmas elektroni sijoittuu tasolle [[$n=2$]], jossa elektroni sijoittuu matalimmalle alatasolle [[$\ell=0$]]. Tälle alatasolle mahtuu kaksi spinkvanttiluvun erottamaa elektronia. Berylliumilla on neljä elektronia, joten atomissa täyttyy pääkvanttiluvun [[$n=2$]] alataso [[$\ell =0$]].
Muut 2. jakson alkuaineet
Energiatasolla [[$n=2$]] sivukvanttiluku voi saada nollan lisäksi arvon [[$\ell = 1$]]. Tällä alatasolla magneettinen kvanttiluku [[$m$]] voi saada arvot -1, 0, 1. Koska jokaiselle tasolle mahtuu kaksi elektronia spinkvanttiluvun erottamina, on täydellä alatasolla [[$\ell = 1$]] kuusi elektronia ja tasolla [[$n=2$]] yhteensä kahdeksan elektronia. Kun tähän lasketaan tilalla [[$n=1$]] olevat kaksi elektronia, voi atomilla tilalla [[$n=2$]] olla enintään kymmenen elektronia. Täysien kuorien atomit ovat jalokaasuja ja edellä mainittu kymmenen elektronin atomi on neon. Alkuaineilla litiumista neoniin täytetään tilaa [[$n=2$]]. Nämä ovat 2. jakson alkuaineita.
Atomien ionisaatioenergiat ja jaksollinen järjestelmä
Jos atomin pääkvanttiluvun määräämä elektronikuori on täysi, atomin ei ole energeettisesti edullista ottaa vastaan tai luovuttaa elektronia. Tällaiset atomit vuorovaikuttavat heikosti toisten atomien kanssa. Niiden ionisoimiseen tarvitaan paljon energiaa ja ne kuuluvat jalokaasuihin. Vetyatomilla ionisaatioenergia on 13,6 eV. Heliumilla se on suurempi, 24,6 eV. Heliumin ionisaatioenergia on atomeista suurin, koska elektronikuori on täysi ja elektronit sijaitsevat lisäksi lähellä atomiydintä.
Litiumilla ionisaatioenergia on selvästi vetyä alhaisempi: 5,4 eV. Tämä johtuu siitä, että energiataso [[$n=1$]] on täysi ja kolmas elektroni sijoittuu energiatasolle [[$n=2$]], kauemmaksi ytimestä. Sisemmän energiatason elektronit varjostavat uloimman elektronin ja ytimen välistä vuorovaikutusta pienentäen ionisaatioenergiaa. Kun uloimmalla energiatasolla on vain yksi elektroni, atomi vuorovaikuttaa herkästi muiden atomien tai ionien kanssa. Tällaisten alkuaineiden ionisaatioenergia on alhainen, ja ne luopuvat uloimmasta elektronistaan helposti.
Ionisaatioenergia kasvaa pääsääntöisesti saman energiatason elektronien lukumäärän lisääntyessä. Joitain poikkeuksia tosin on. Esimerkiksi berylliumin (neljä elektronia) ionisaatioenergia on suurempi kuin boorin (viisi elektronia). Berylliumilla on täysi pääkvanttiluvun, [[$n=2$]], alataso, [[$\ell=0$]]. Boorilla yksi elektroni sijoittuu alatasolle [[$\ell=1$]], jolloin se on helpommin irrotettavissa atomista. Suurimmat ionisaatioenergiat havaitaan jalokaasuilla, joilla on täydet uloimman päätason alatasot.

Ionisaatioenergian muutos atomin järjestysluvun mukaan. Taulukossa havaitaan notkelmat, kun elektronit alkavat täyttää samassa jaksossa uutta energian alatasoa. Lähde: NIST Atomic Spectra Database, Ionization Energies Data.
| Alkuaine | Elektronirakenne | Ionisaatioenergia (eV) |
|---|---|---|
| Vety | 1s1 | 13,6 |
| Helium | 1s2 | 24,6 |
| Litium | 1s22s1 | 5,4 |
| Beryllium | 1s22s2 | 9,3 |
| Boori | 1s22s22p1 | 8,3 |
| Hiili | 1s22s22p2 | 11,3 |
| Typpi | 1s22s22p3 | 14,5 |
| Happi | 1s22s22p4 | 13,6 |
| Fluori | 1s22s22p5 | 17,4 |
| Neon | 1s22s22p6 | 21,6 |
| Natrium | 1s22s22p63s1 | 5,1 |
Yllä olevassa taulukossa elektronirakenne on ilmaistu käyttämällä sivukvanttiluvulle [[$\ell$]] arvoja s, p, d, f, ... lukuarvojen 0, 1, 2, 3, ... sijaan. Esimerkiksi typen rakenteen merkintä 1s22s22p3 tarkoittaa, että tilassa [[$n=1$]], [[$\ell=0$]] on kaksi elektronia (eri spinkvanttiluvuilla), tilassa [[$n=2$]], [[$\ell=0$]] on myös kaksi elektronia (taas eri spinkvanttiluvuilla) ja tilassa [[$n=2$]], [[$\ell=1$]] on kolme elektronia (eri magneettikvanttiluvuilla eli eri asennossa olevilla orbitaaleilla).
Kolmatta jaksoa raskaammat alkuaineet
Energiatason [[$n=3$]] jalokaasu on argon. Argonilla on 18 elektronia. Seuraavalla alkuaineella kaliumilla 19. elektroni sijoittuu uudelle energiatasolle [[$n=4$]], vaikka energiatasolla [[$n=3$]] on alataso 3d täyttämättä. Alatason 3d energia on kuitenkin suurempi kuin tilan 4s. Näin ollen kalium aloittaa neljännen jakson. Vasta kun alataso 4s on täysi, alkaa taso 3d täyttyä.
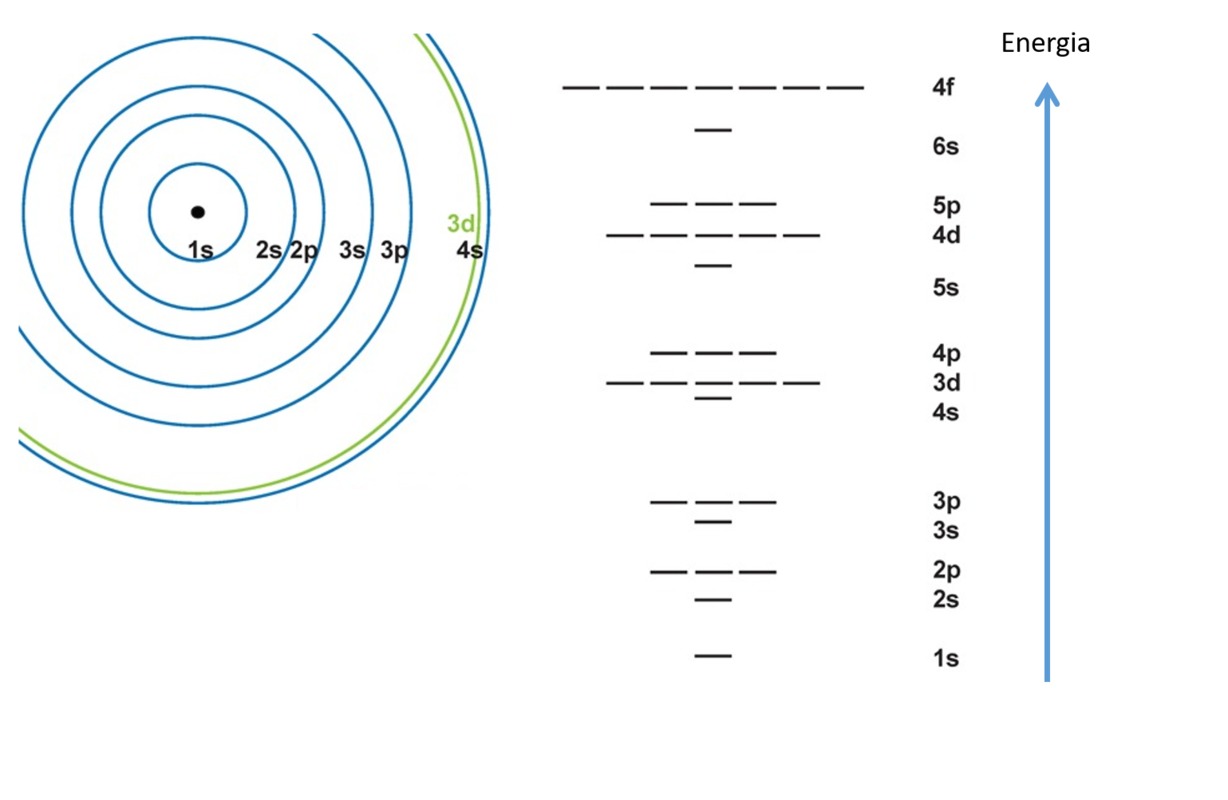
Elektronit asettuvat tasoille, joiden energia on mahdollisimman alhainen.
Kvanttimekaniikan ymmärtäminen on selittänyt jaksollisen järjestelmän rakentumisen edellä kuvatulla tavalla. Jaksollinen järjestelmä muotoutuu sen mukaisesti, miten elektronit täyttävät energiatiloja.
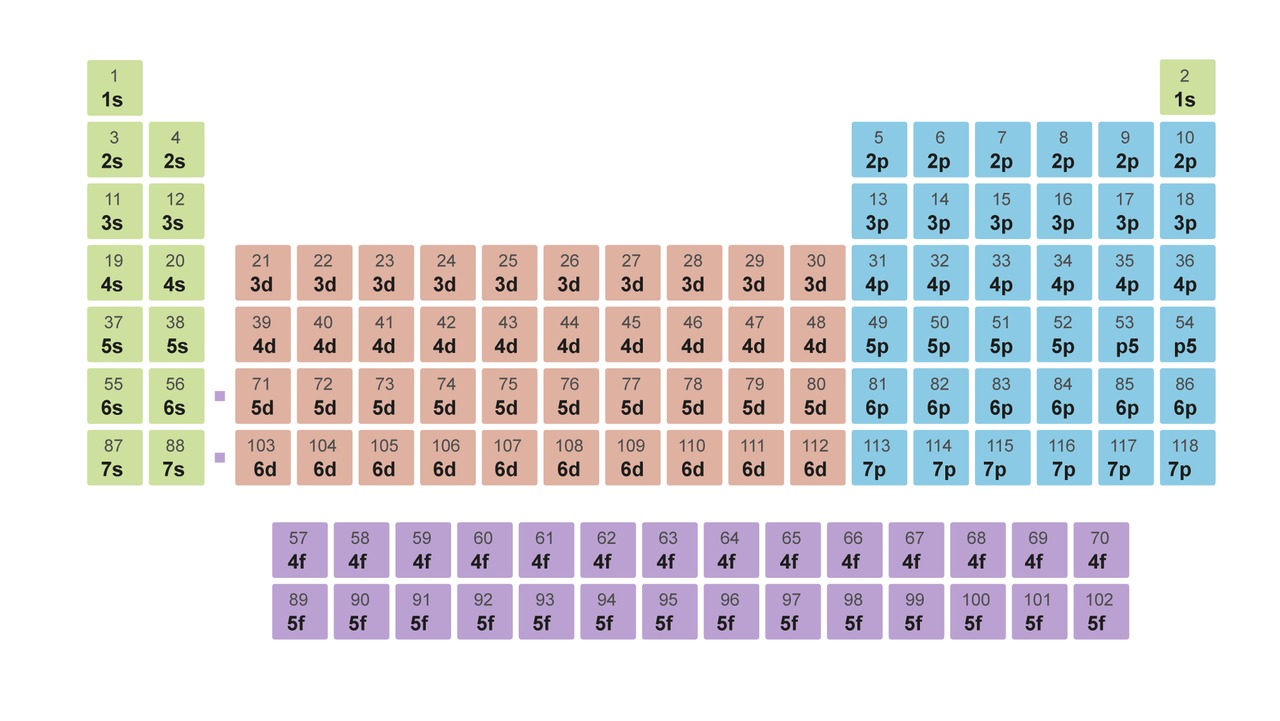
Kuvassa ovat jaksollisen järjestelmän osat sen mukaan, millä energiatasolla atomin uloimmat elektronit ovat.
Esimerkkejä
Esimerkki 1
Oheiseen heliumin energiatasokaavioon on merkitty eräs mahdollinen siirtymä viritystilalta toiselle. Näkyykö kyseisen säteilyn piikki oheisessa spektrissä?

Esimerkki 2
Tarkastellaan perustilassa olevan neonkaasun ionisaatiota. Neonatomin ionisaatioenergia on 21,56 eV.
a) Kuinka suuri on elektronin nopeuden oltava, jotta se pystyisi liike-energiansa ansiosta ionisoimaan neonkaasun atomin?
b) Mikä on sellaisen fotonin aallonpituus, joka voi ionisoida neonkaasun atomin?