Reaktioyhtälö
Kemiallisessa reaktiossa aine tai aineet muuttuvat toisiksi aineiksi.
Kemiallisia reaktioita tapahtuu jatkuvasti niin hengittäessä, ruoansulatuksessa kuin palamisessakin vain muutaman tapauksen mainitaksemme.
 Sekä palaminen että lihan kypsyminen ovat kemiallisia reaktioita.
Sekä palaminen että lihan kypsyminen ovat kemiallisia reaktioita.
Reaktioyhtälö
Kemiallista reaktiota kuvataan reaktioyhtälöllä, josta käy ilmi mitkä aineet osallistuvat reaktioon ja mitä reaktiossa syntyy.
Aineita, jotka osallistuvat kemialliseen reaktioon, kutsutaan lähtöaineiksi ja aineita, jotka muodostuvat kemiallisen reaktion jälkeen, kutsutaan reaktiotuotteiksi. Reaktioyhtälössä nuoli kuvaa kuinka lähtöaineet muuttavat reaktiotuotteiksi. [[$$\text{lähtöaineet} \ \rightarrow \ \text{reaktiotuotteet}$$]]
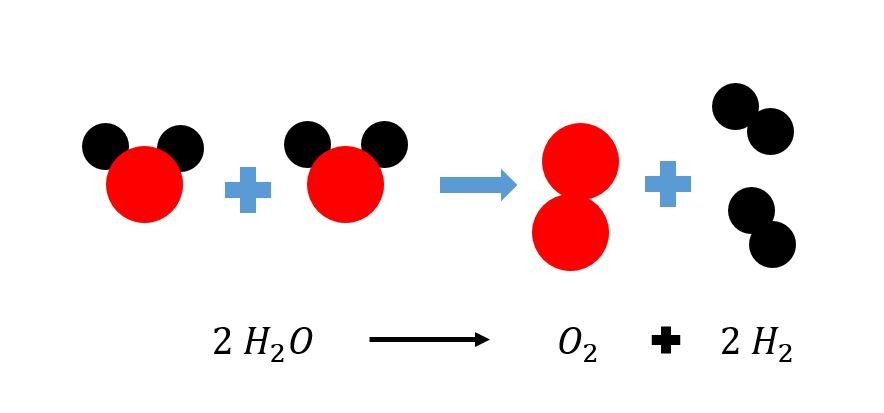 Kuvassa on esitetty reaktioyhtälönä veden hajoaminen hapeksi ja vedyksi. Huomaa, että happi ja vety esiintyvät kaksiatomisina molekyyleinä. Huomaa myös, että kutakin atomia esiintyy nuolen molemmilla puolilla yhtä monta kappaletta.
Kuvassa on esitetty reaktioyhtälönä veden hajoaminen hapeksi ja vedyksi. Huomaa, että happi ja vety esiintyvät kaksiatomisina molekyyleinä. Huomaa myös, että kutakin atomia esiintyy nuolen molemmilla puolilla yhtä monta kappaletta.
Kemiallisissa reaktioissa pätee aineen häviämättömyyden laki. Aineen häviämättömyyden laki tarkoittaa sitä, että kemiallisessa reaktiossa yhtäkään atomia ei häviä eikä yhtäkään atomia synny lisää. Atomit vain järjestäytyvät uusiksi yhdisteiksi tai puhtaiksi aineiksi.
Kemiallisissa reaktioissa tapahtuu aina energian muutoksia. Kemiallinen reaktio voi joko vapauttaa energiaa tai sitoa energiaa.
Energiaa vapauttavia reaktioita kutsutaan eksotermisiksi reaktioiksi. Energian vapautuminen voidaan havaita esimerkiksi lämpönä tai valona.
Energiaa sitovia reaktioita kutsutaan endotermisiksi reaktioiksi. Energian sitoutuminen voidaan havaita esimerkiksi reaktiotuotteen jäähtymisenä.
Kemiallisia reaktioita tapahtuu jatkuvasti niin hengittäessä, ruoansulatuksessa kuin palamisessakin vain muutaman tapauksen mainitaksemme.
 Sekä palaminen että lihan kypsyminen ovat kemiallisia reaktioita.
Sekä palaminen että lihan kypsyminen ovat kemiallisia reaktioita.Reaktioyhtälö
Kemiallista reaktiota kuvataan reaktioyhtälöllä, josta käy ilmi mitkä aineet osallistuvat reaktioon ja mitä reaktiossa syntyy.
Aineita, jotka osallistuvat kemialliseen reaktioon, kutsutaan lähtöaineiksi ja aineita, jotka muodostuvat kemiallisen reaktion jälkeen, kutsutaan reaktiotuotteiksi. Reaktioyhtälössä nuoli kuvaa kuinka lähtöaineet muuttavat reaktiotuotteiksi. [[$$\text{lähtöaineet} \ \rightarrow \ \text{reaktiotuotteet}$$]]
 Kuvassa on esitetty reaktioyhtälönä veden hajoaminen hapeksi ja vedyksi. Huomaa, että happi ja vety esiintyvät kaksiatomisina molekyyleinä. Huomaa myös, että kutakin atomia esiintyy nuolen molemmilla puolilla yhtä monta kappaletta.
Kuvassa on esitetty reaktioyhtälönä veden hajoaminen hapeksi ja vedyksi. Huomaa, että happi ja vety esiintyvät kaksiatomisina molekyyleinä. Huomaa myös, että kutakin atomia esiintyy nuolen molemmilla puolilla yhtä monta kappaletta.Kemiallisissa reaktioissa pätee aineen häviämättömyyden laki. Aineen häviämättömyyden laki tarkoittaa sitä, että kemiallisessa reaktiossa yhtäkään atomia ei häviä eikä yhtäkään atomia synny lisää. Atomit vain järjestäytyvät uusiksi yhdisteiksi tai puhtaiksi aineiksi.
Kemiallisissa reaktioissa tapahtuu aina energian muutoksia. Kemiallinen reaktio voi joko vapauttaa energiaa tai sitoa energiaa.
Energiaa vapauttavia reaktioita kutsutaan eksotermisiksi reaktioiksi. Energian vapautuminen voidaan havaita esimerkiksi lämpönä tai valona.
Energiaa sitovia reaktioita kutsutaan endotermisiksi reaktioiksi. Energian sitoutuminen voidaan havaita esimerkiksi reaktiotuotteen jäähtymisenä.