2. Jaksollinen järjestelmä
Jaksollinen järjestelmä
Jaksollinen järjestelmä
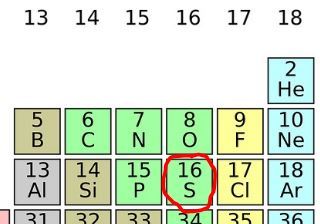
Alkuaineiden jaksolliseen järjestelmään on listattu kaikki tunnetut alkuaineet ominaisuuksiensa perusteella tiettyyn järjestykseen. Jaksollisen järjestelmän avulla voi päätellä mitä ominaisuuksia alkuaineella on ja miten se reagoi muiden alkuaineiden kanssa.
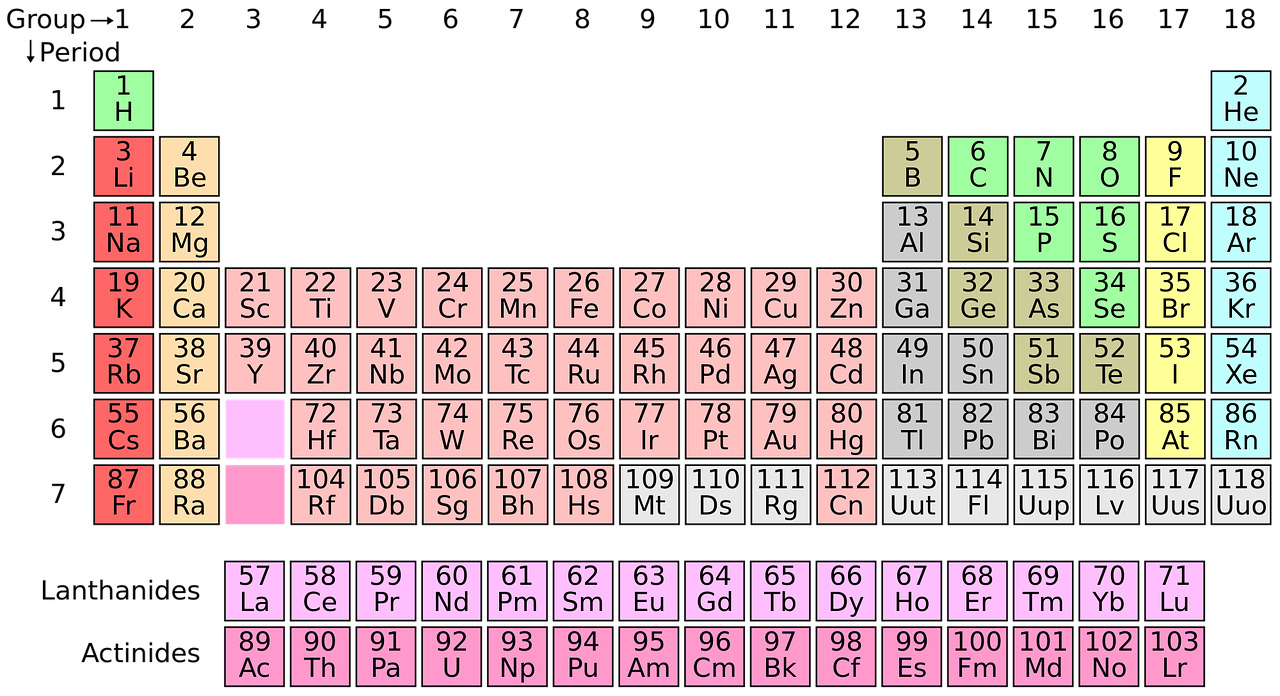
Kaikki jaksollisesta järjestelmästä löytyvät alkuaineet ovat erilaisia, vaikka niiden atomirakenteet olisivat lähes samankaltaiset. Valitaan taulukosta esimerkiksi vety ja helium.
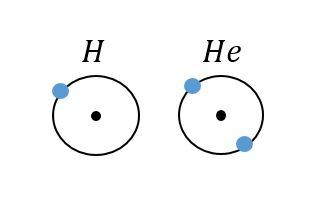
Vety haluaisi saada ainoan energiatasonsa täyteen vastaanottamalla yhden elektronin. Helium sen sijaan on tyytyväinen, koska sillä on ainoa energiatasonsa täynnä ja se on oktetissa. Tästä syystä vety reagoi helposti muiden aineiden kanssa ja on helposti syttyvää, siinä missä heliumia on vaikea saada reagoimaan muiden aineiden kanssa.
Pääryhmät kertovat atomin ulkoelektronien lukumäärän
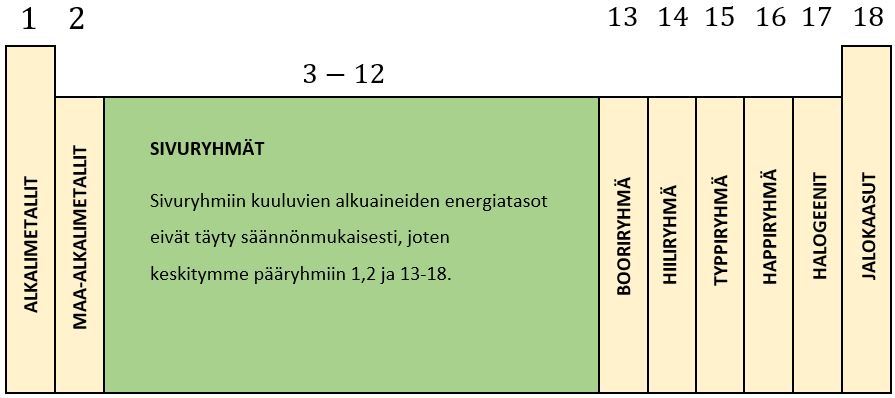
Jaksollisen järjestelmän pystyrivejä kutsutaan ryhmiksi. Ryhmiä 1, 2 ja 13-18 kutsutaan pääryhmiksi, sillä saman pääryhmän alkuaineilla on sama määrä elektroneja uloimmalla energiatasollaan.
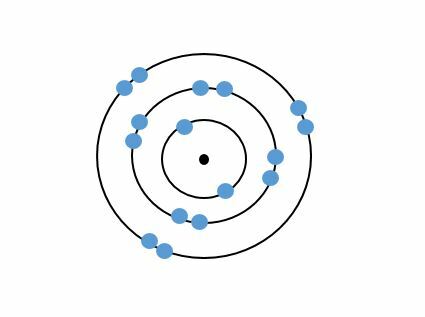
Esimerkiksi kaikilla pääryhmän 8 (jalokaasut) alkuaineilla on heliumia lukuunottamatta kahdeksan elektronia uloimmalla tasollaan, joten ne ovat kaikki oktetissa eivätkä reagoi helposti muiden alkuaineiden kanssa.
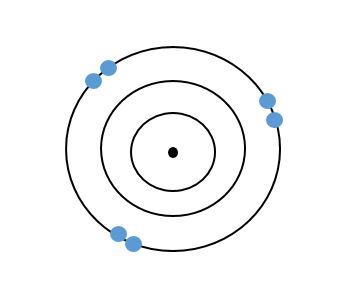
Toisaalta kaikilla pääryhmän 7 alkuaineilla (halogeenit) on seitsemän ulkoelektronia. Päästäkseen oktettiin halogeenit ovat halukkaita vastaanottamaan yhden elektronin, joten halogeenit reagoivat helposti muiden alkuaineiden kanssa.
Koska atomin ulkoelektronien lukumäärä kertoo alkuaineen reaktiivisuudesta, niin saman pääryhmän alkuaineet ovat ominaisuuksiltaan samankaltaisia.
Jaksot kertovat atomin energiatasojen lukumäärän
Jaksollisen järjestelmän vaakarivejä kutsutaan jaksoiksi. Saman jakson alkuaineilla on sama määrä energiatasoja.
Esimerkiksi ensimmäiseen jaksoon kuuluu vain kaksi alkuainetta, vety ja helium, joilla molemmilla on vain yksi energiataso. Seuraava alkuaine, litium, hyppää toiselle vaakariville, koska sen kolmas elektroni ei mahdu ensimmäiselle tasolle.
Alkuaineiden jaksolliseen järjestelmään on listattu kaikki tunnetut alkuaineet ominaisuuksiensa perusteella tiettyyn järjestykseen. Jaksollisen järjestelmän avulla voi päätellä mitä ominaisuuksia alkuaineella on ja miten se reagoi muiden alkuaineiden kanssa.

Kaikki jaksollisesta järjestelmästä löytyvät alkuaineet ovat erilaisia, vaikka niiden atomirakenteet olisivat lähes samankaltaiset. Valitaan taulukosta esimerkiksi vety ja helium.

Vety haluaisi saada ainoan energiatasonsa täyteen vastaanottamalla yhden elektronin. Helium sen sijaan on tyytyväinen, koska sillä on ainoa energiatasonsa täynnä ja se on oktetissa. Tästä syystä vety reagoi helposti muiden aineiden kanssa ja on helposti syttyvää, siinä missä heliumia on vaikea saada reagoimaan muiden aineiden kanssa.
Pääryhmät kertovat atomin ulkoelektronien lukumäärän
Jaksollisen järjestelmän pystyrivejä kutsutaan ryhmiksi. Ryhmiä 1, 2 ja 13-18 kutsutaan pääryhmiksi, sillä saman pääryhmän alkuaineilla on sama määrä elektroneja uloimmalla energiatasollaan.

Esimerkiksi kaikilla pääryhmän 8 (jalokaasut) alkuaineilla on heliumia lukuunottamatta kahdeksan elektronia uloimmalla tasollaan, joten ne ovat kaikki oktetissa eivätkä reagoi helposti muiden alkuaineiden kanssa.
Toisaalta kaikilla pääryhmän 7 alkuaineilla (halogeenit) on seitsemän ulkoelektronia. Päästäkseen oktettiin halogeenit ovat halukkaita vastaanottamaan yhden elektronin, joten halogeenit reagoivat helposti muiden alkuaineiden kanssa.
Koska atomin ulkoelektronien lukumäärä kertoo alkuaineen reaktiivisuudesta, niin saman pääryhmän alkuaineet ovat ominaisuuksiltaan samankaltaisia.
Jaksot kertovat atomin energiatasojen lukumäärän
Jaksollisen järjestelmän vaakarivejä kutsutaan jaksoiksi. Saman jakson alkuaineilla on sama määrä energiatasoja.
Esimerkiksi ensimmäiseen jaksoon kuuluu vain kaksi alkuainetta, vety ja helium, joilla molemmilla on vain yksi energiataso. Seuraava alkuaine, litium, hyppää toiselle vaakariville, koska sen kolmas elektroni ei mahdu ensimmäiselle tasolle.