Sähkökemiaa
Sähkökemia
- Sähkökemia on kemian osa-alue, jossa tutkitaan kemiallisia reaktioita joissa kuluu tai vapautuu sähköenergiaa
- (Tavallaan kaikki kemia on "sähkökemiaa"
- "sähkö" tarkoittaa elektronien (tai muiden varauksellisten hiukkasten kuten ionien) liikettä
- kaikki kemialliset reaktiot liittyvät elektronien liikkumiseen paikasta toiseen
- sähköjohdoissa kulkeva sähkö on nimenomaan elektronien liikettä, ionit ei mahdu kulkemaan metalliatomien välissä.)
Jalousjärjestys
hapettuminen = elektronien luovuttamista
pelkistyminen = elektronien vastaanottamista
pelkistyminen = elektronien vastaanottamista
Metallien jännitesarja
| ← Epäjalot metallit | Jalometallit → | |||||||||||||||||
| Li | K | Ba | Ca | Na | Mg | Al | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Ag | Hg | Pt | Au |
- Jännitesarja kertoo kuinka helposti metalli luovuttaa ulkoelektroninsa
- Tämä riippuu metalliatomin rakenteesta (elektronit, protonit, neutronit)
- Mitä enemmän vasemmalla, sitä helpommin luovuttaa (ulko)elektronejaan!
- Metallit jaetaan jaloihin ja epäjaloihin vertaamalla niitä vedyn hapettumiskykyyn.
- Epäjalot metallit vapauttavat hapon kanssa reagoidessaan vetykaasua
- (vety pelkistyy! [[$ 2 H^+ + 2 e^- \rightarrow H_2 $]])
- (vety pelkistyy! [[$ 2 H^+ + 2 e^- \rightarrow H_2 $]])
- Jalometallit eivät reagoi happojen kanssa muodostaen vetyä
- (jotkut jalometallit voivat vapauttaa happihappojen kanssa reagoidessaa kaasumaisia oksideja)
- kupari + typpihappo: reaktioyhtälö, video
- kupari + typpihappo: reaktioyhtälö, video
- (jotkut jalometallit voivat vapauttaa happihappojen kanssa reagoidessaa kaasumaisia oksideja)
- Epäjalot metallit vapauttavat hapon kanssa reagoidessaan vetykaasua
- Epäjalompi metalliatomi pelkistää jalomman metalli-ionin (atomiksi)
ELI: kun kaksi metallia reagoi keskenään, niin - epäjalompi hapettuu (luovuttaa elektroneja!)
- jalompi pelkistyy (vastaanottaa elektroneja!)
- JOS jalompi metalli on valmiiksi pelkistyneenä (atomi, puhdas metalli) TAI
- JOS epäjalo metalli on valmiiksi hapettuneena (yhdisteenä tai positiivinen ioni)
- niin reaktiossa ei tapahdu mitään!
- esimerkit kirjan s.209
Lisätietoa: Jalometallit
- Ihmiset arvostavat jalometalleja niiden ulkonäön ja pysyvyyden takia.
- Kultaa voi löytää luonnosta pelkistyneenä metallina, kun useimmat metallit ovat maankuoressa yhdisteinä (usein oksideina!)
- Hopea esiintyy usein rikin yhdisteinä
- Tummumat hopeaesineissä ovat hopeasulfidia (AgS2), joka on helppo pelkistää takaisin hopeaksi elektrolyytin ja epäjalomman metallin avulla (esim. Al)
- Tummumat hopeaesineissä ovat hopeasulfidia (AgS2), joka on helppo pelkistää takaisin hopeaksi elektrolyytin ja epäjalomman metallin avulla (esim. Al)
- Se, että metalli on jaloa ei tee siitä välttämättä arvokasta!
- Arvometalliksi kutsutaan metallia, joka haluttujen ominaisuuksiensa lisäksi on myös harvinaista.
- Mitä vähemmän metallia on saatavilla sitä korkeampi hinta (yleensä).
Sähkön tuottoa ja käyttöä
Sähkökemian historiaa
- Luigi Galvani luuli keksineensä "eläinsähkön"
https://backyardbrains.com/experiments/Galvani_Volta
- Alessandro Volta osoitti, että kahden metallin välillä kulkee sähkövirta, jos ne on upotettu sähköä johtavaan liuokseen eli elektrolyyttiin
- Elektrolyytti = ioneja sisältävä liuos (joka johtaa siksi sähköä)
- Lisätietoa:
- Eläinten (ja ihmisten) kudosnesteet ovat elektrolyyttejä
- Kaikki ihmisen solujen, hermojen ja lihasten toiminta perustuu sähkökemiaan
- Eläimiä ei siis tarvittu muuhun kuin elektrolyytiksi!
Sähkökemiallinen pari
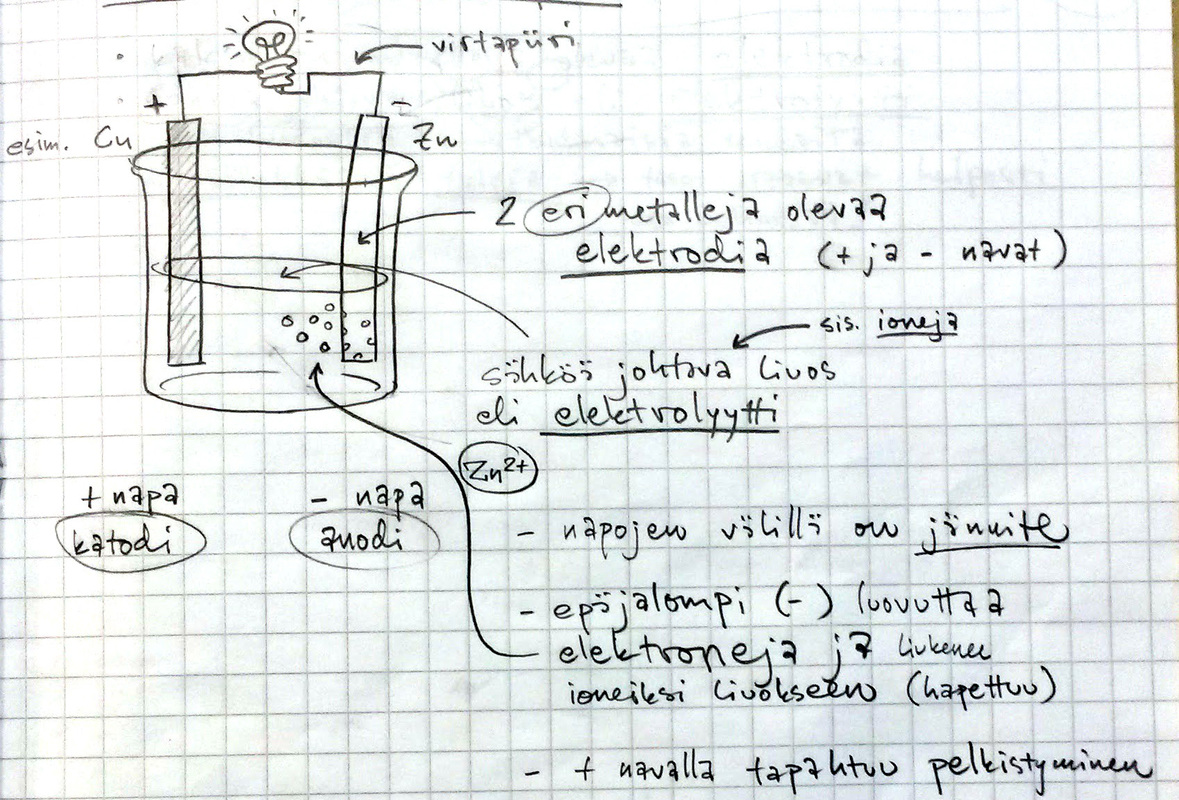
- Kahden eri metallin välille muodostuu potentiaaliero eli jännite
- Sitä suurempi mitä kauempana toisistaan jännitesarjalla
- Paristot ovat sähköparin sovelluksia
- sinkki-hiili -paristo: Zn + MnO2, elektrolyyttinä NH4Cl-hyytelö (hiilisauva päällystetty mangaanioksidilla)
- alkaliparistoissa elektrolyyttinä emäs (eli alkali) NaOH tai KOH (elektrodeina edelleen Zn + MnO2)
- Akuissa kemialliset reaktiot ovat käännettäviä
- käytettäessä (eli purettaessa) sähköpari antaa sähkövirtaa
- ladattaessa reaktio etenee päinvastaiseen suuntaan (ulkoinen jännitelähde!)
- Litiumioniakku on nykyisin yleisin ladattavissa sähkölaitteissa käytettävä energianlähde
| HUOM! Paristoja ei voi ladata! Kemiallinen reaktio ei toimi elektrolyysissä ja tuloksena on voimakas lämpötilan nousu ja mahdollinen räjähdys. |
Elektrolyysi
- Elektrolyysissä sähköparissa tapahtuva reaktio pakotetaan päinvastaiseen suuntaan ulkoisella jännitelähteellä (sähköllä!)
- positiiviset ionit pelkistyvät alkuaineeksi katodin pinnalle (+ ja - navat toisin päin kuin sähköparissa!)
- käyttöä: epäjalojen metallien puhdistus, kaasujen valmistus, sähköä johtavien esineiden pinnoitus

