8.2 Radioaktiivisuus ja ydinreaktiot
Radioaktiivisuus
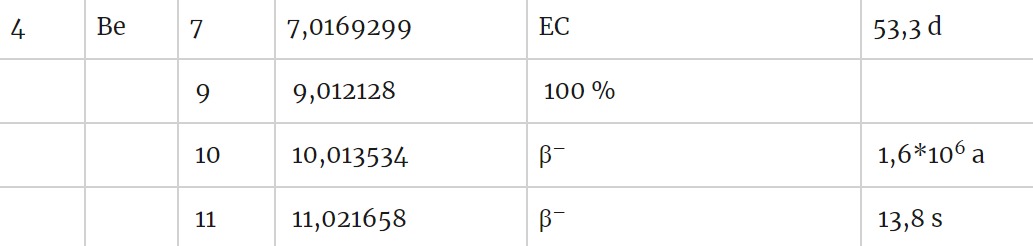
Alfahajoamisessa radioaktiivisen isotoopin ytimestä irtoaa alfahiukkanen eli heliumydin. Esimerkiksi:
[[$ \quad ^{211}_{83}\text{Bi} \rightarrow ^{207}_{81}\text{Au}+^4_2\text{He} $]]
 Beeta- -hajoamisessa ytimen neutroni muuttuu protoniksi, elektroniksi ja antineutriinoksi. Kokonaissähkövaraus ja massaluku säilyvät. Esimerkiksi:
Beeta- -hajoamisessa ytimen neutroni muuttuu protoniksi, elektroniksi ja antineutriinoksi. Kokonaissähkövaraus ja massaluku säilyvät. Esimerkiksi:[[$ \quad ^{95}_{40}\text{Zr} \rightarrow ^{95}_{41}\text{Nb}+^0_{-1}\text{e}+\bar{v} $]]
 Beeta+-hajoamisessa ytimen protoni muuttuu neutroniksi, positroniksi ja neutriinoksi. Kokonaissähkövaraus ja massaluku säilyvät. Esimerkiksi:
Beeta+-hajoamisessa ytimen protoni muuttuu neutroniksi, positroniksi ja neutriinoksi. Kokonaissähkövaraus ja massaluku säilyvät. Esimerkiksi:[[$ \quad ^{78}_{35}\text{Br} \rightarrow ^{78}_{34}\text{Se}+^0_{+1}\text{e}+v $]]
Elektronisieppauksessa ydin kaappaa elektronin omalta elektronikuoreltaan, jolloin sen protoni muuttuu neutroniksi ja neutriinoksi. Esimerkiksi:
[[$ \quad \text{e}+^{49}_{23}\text{V} \rightarrow ^{49}_{22}\text{Ti}+v $]]
Gammasäteilyä lähettävä ydin ei muutu toiseksi vaan kyse on ytimen viritystilan purkautuessa vapautuvasta energiasta. Usein radioaktiivisen hajoamisreaktion tytärydin jää viritystilaan, joka purkautuu myöhemmin. Gammasäteilyä havaitaan siis usein esim alfa- hajoamisen yhteydessä.
Aktiivisuus ja hajoamislaki
Radioaktiivisesta näytteestä hajoaa tietyssä ajassa aina yhtä suuri prosenttiosuus.
Näytteessä jäljellä olevien radioaktiivisten ydinten määrä noudattaa mallia [[$N(t)=N_0e^{-\lambda t}$]], missä [[$\lambda$]] on hajoamisvakio. Mitä suurempi hajoamisvakio, sitä nopeammin näyte hajoaa.
Hajoamisvakion sijaan hajoamisnopeutta kuvataan usein puoliintumisajalla [[$T_{1/2}$]], joka kertoo, missä ajassa puolet radioaktiivisista ytimistä hajoaa. Puoliintumisaika liittyy hajoamisvakioon: [[$T_{1/2}=\dfrac{\ln 2}{\lambda}$]].
Radioaktiivisen hajoamisen ja muiden ydinreaktioiden energia
 Reaktion energia saadaan laskemalla "lopputuotteiden massat" - "alkutuotteiden massat" ja muuttamalla tämä massa energiaksi vastaavuuden [[$E=mc^2$]] mukaisesti.
Reaktion energia saadaan laskemalla "lopputuotteiden massat" - "alkutuotteiden massat" ja muuttamalla tämä massa energiaksi vastaavuuden [[$E=mc^2$]] mukaisesti.- Ydinreaktioihin osallistuvien ytimien massat saadaan vähentämällä isotooppitaulukon atomimassoista atomiin kuuluvien elektronien kokonaismassa.
- Massan muutos on järkevää laskea välituloksena yksikössä u.
- Energian laskemisessa voidaan hyödyntää yhtä atomimassayksikköä vastaavaa tunnettua energiamäärää: [[$ \mathrm{u}=931{,}49\ \dfrac{\mathrm{MeV}}{c^2} $]]
Esimerkki: Beetahajoamisen energia
Tarkastellaan hajoamisen laskennallista käsittelyä isotoopille Mg-23. Kyseessä on beeta+-aktiivinen isotooppi, jonka hajoamisen reaktioyhtälö on seuraava:
[[$\quad ^{23}_{12}\text{Mg} \rightarrow {^{23}_{11}\text{Na}}+{^{\ \ \ 0}_{+1}\text{e}}^++\nu $]]
Massan muutoksen laskemiseksi etsitään atomien massat isotoopppitaulukosta. Ydinten massat saadaan vähentämällä niistä atomin elektronien kokonaismassa:
[[$ \quad \begin{align}m_{\text{Mg-ydin}}&=m_{\text{Mg-atomi}}-12 m_\text{e} \\ \, \\ m_{\text{Na-ydin}}&=m_{\text{Na-atomi}}-11m_\text{e} \\ \end{align} $]]
Massan muutos saadaan vähentämällä emoytimen eli magnesiumin massasta reaktiossa syntyvien natriumytimen ja positronin massat. Positronin massa on sama kuin elektronin.
[[$ \quad \begin{align} \Delta m &=m_{\text{Mg-ydin}}-m_{\text{Na-ydin}}-m_{\text{positroni}} \\ \, \\ &=m_{\text{Mg-atomi}}-12 m_\text{e}-(m_{\text{Na-atomi}}-11m_\text{e})-m_\text{e} \quad \\ \, \\ &=m_{\text{Mg-atomi}}-m_{\text{Na-atomi}}-2m_\text{e} \\ \, \\ &= 22,994124 \text{ u}-22,989767 \text{ u}-2\cdot 5,485799\cdot 10^{-4} \text{ u} \\ \, \\ &=0,0032598402 \text{ u}\approx 0,003260 \text{ u} \\ \end{align} $]]
Massan muutos on 0,003260 u. Huomataan, että vähennyslaskun vastaus saadaan neljän merkitsevän numeron tarkkuudella. Reaktioenergia on siis
[[$ \quad Q=\Delta m c^2=0,0032598402 \cdot 931,49 \text{ MeV/c}^2\cdot c^2 \approx 3,037 \text{ MeV} $]]