2.2 Kovalenttisen sidoksen muodostuminen - HYBRIDISAATIOTEORIA
Kvanttimekaanisen atomimallin mukaan elektronit sijaitsevat atomiorbitaaleilla.
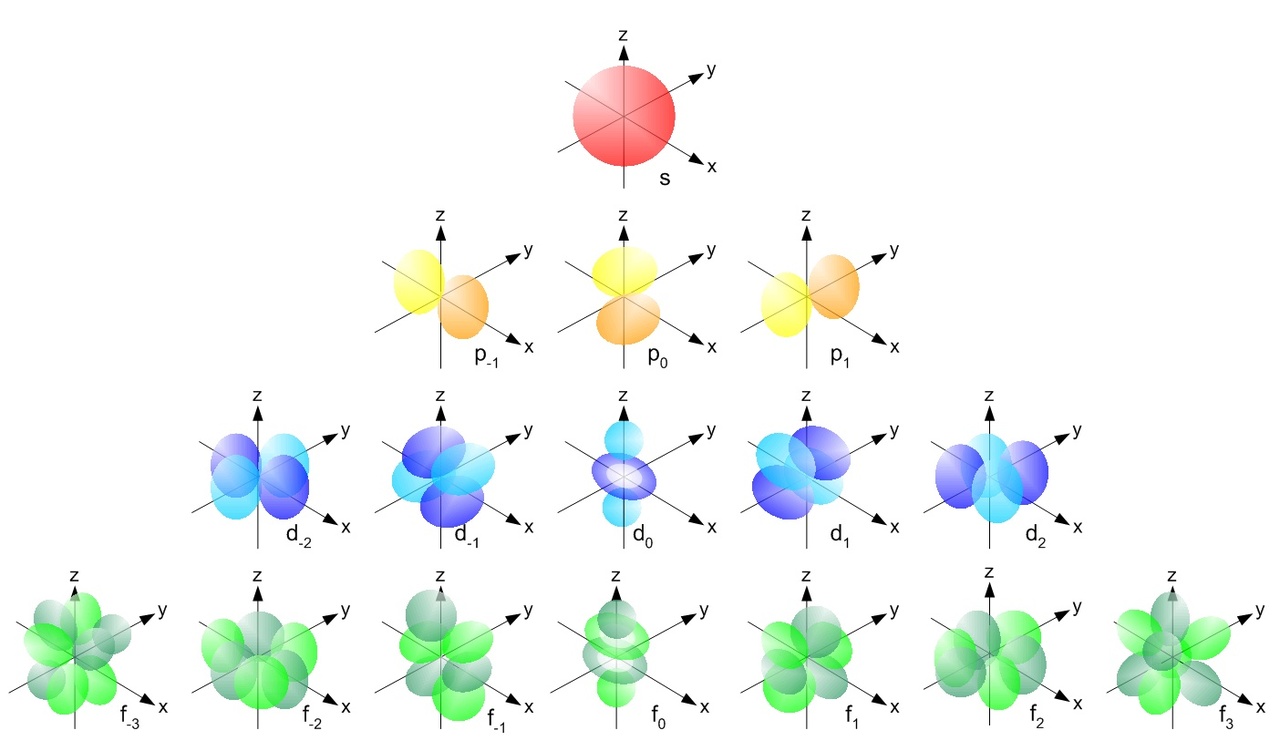
Orbitaaleja kuvataan rajapintakuvaajila, elektronit löytyvät todennäköisimmin näiltä alueilta.
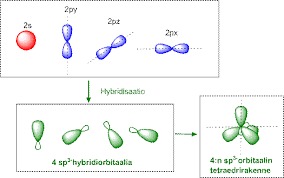
Hiilen ulkokuoren elektronit muodostavat neljä samanlasta sidosta esim. CH4-molekyylissä.
Hiili muodostaa neljä sp3-hybridiorbitaalia, muodostuu neljä sigma sidosta.

Hybridisaatio on atomiorbitaalien uudelleenjärjestyminen, jolloin muodostuu uusia avaruudellisesti eritavoin suuntautuneita orbitaaleja. sp3-hybridisaatiossa molekyylin muoto on TETRAEDRI.
Hiiliatomien välille muodostuu kaksoisidos - sp2-hybridisaatio.
Kolme sigmasidosta ja yksi piisidos.
Molekyylin muoto on TASOMAINEN.
Hiiliatomien välille muodostuu kolmoisidos - sp-hybridisaatio.
Kaksi sigmasidosta ja kaksi piisidosta.
Molekyylin muoto on LINEAARINEN.
Katso oppikirjan taulukko sivulta 61, siinä on yhteenveto hybridisaatiosta.

Orbitaaleja kuvataan rajapintakuvaajila, elektronit löytyvät todennäköisimmin näiltä alueilta.
Hiilen ulkokuoren elektronit muodostavat neljä samanlasta sidosta esim. CH4-molekyylissä.
Hiili muodostaa neljä sp3-hybridiorbitaalia, muodostuu neljä sigma sidosta.

Hybridisaatio on atomiorbitaalien uudelleenjärjestyminen, jolloin muodostuu uusia avaruudellisesti eritavoin suuntautuneita orbitaaleja. sp3-hybridisaatiossa molekyylin muoto on TETRAEDRI.

Hiiliatomien välille muodostuu kaksoisidos - sp2-hybridisaatio.
Kolme sigmasidosta ja yksi piisidos.
Molekyylin muoto on TASOMAINEN.
Hiiliatomien välille muodostuu kolmoisidos - sp-hybridisaatio.
Kaksi sigmasidosta ja kaksi piisidosta.
Molekyylin muoto on LINEAARINEN.
Katso oppikirjan taulukko sivulta 61, siinä on yhteenveto hybridisaatiosta.