Sähkökemiallinen pari - muistiinpanot
Sähkökemiallinen pari eli paristo
Periaate
Ts. hapettumis-pelkistymisreaktio muuttaa kemiallista energiaa sähköenergiaksi. Mitä kauempana metallit ovat toisistaan jännitesarjassa, sitä suurempi jännite niiden välille muodostuu. (Eli miten suuri jalousero niillä on)
- Aina, kun kaksi eri metallia on elektrolyytin välityksellä kosketuksessa toisiinsa, syntyy ns. sähkökemiallinen pari.
- Elektrolyytti on ioneja sisältävä liuos, yleensä suola- tai happoliuos
- Kun metallit yhdistetään johtimilla esim lamppuun, sen läpi kulkee sähkövirta ja laite toimii.
- Kemiallinen energia → sähköenergia

Periaate
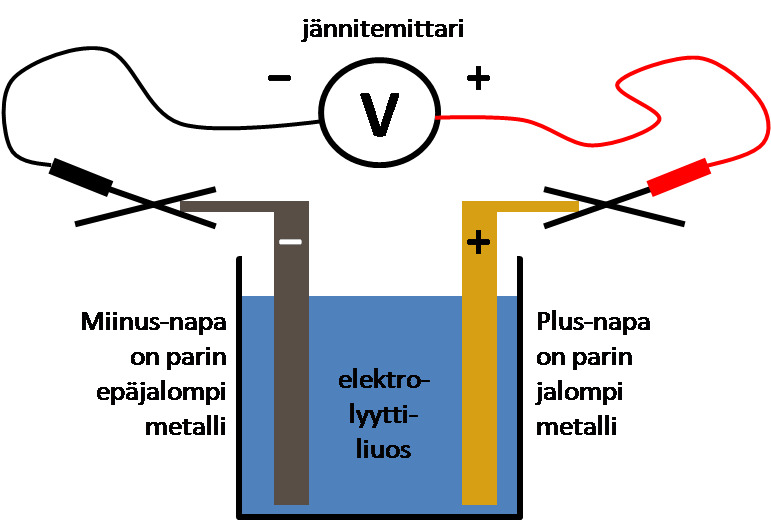
- Selvitetään, kumpi metalleista on epäjalompi. Se hapettuu eli luovuttaa elektroneja e−
- Epäjalommasta metallista muodostuu sähköparin miinusnapa (sisältää elektroneja)
- Elektroneja alkaa virrata miinusnavalta johdinta pitkin kohti jalompaa metallia, joka plusnapana vetää elektroneja puoleensa.
- Virtapiirin pitää olla suljettu, jotta sähkövirta kulkisi siinä.
→ Elektrolyytin positiiviset metalli-ionit kulkeutuvat liuoksessa kohti epäjalompaa metallia, joka miinusnapana vetää niitä puoleensa.
Ts. hapettumis-pelkistymisreaktio muuttaa kemiallista energiaa sähköenergiaksi. Mitä kauempana metallit ovat toisistaan jännitesarjassa, sitä suurempi jännite niiden välille muodostuu. (Eli miten suuri jalousero niillä on)